扩展功能
文章信息
- 张客松, 韩青, 陈炳鹏, 邹运, 杨科荣, 王辰宇, 王金成
- ZHANG Kesong, HAN Qing, CHEN Bingpeng, ZOU Yun, YANG Kerong, WANG Chenyu, WANG Jincheng
- 3D打印技术辅助治疗髋臼肿瘤1例报告及文献复习
- Assisted treatment of acetabulumtumor with 3D printing technology:A case report and literature review
- 吉林大学学报(医学版), 2018, 44(04): 828-832
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 828-832
- 10.13481/j.1671-587x.20180426
-
文章历史
- 收稿日期: 2017-12-23
骨盆肿瘤切除后如何填补截骨后残留的大范围骨缺损,如何重建骨盆的功能和解剖形态,一直以来是困扰骨科医生的难题[1-3]。骨盆肿瘤切除后,骨盆重建主要采用组配式骨盆假体重建术[4-5],由于患者骨盆解剖形态与肿瘤侵袭范围和恶性程度的个体化差异,导致肿瘤切除范围的不同。为彻底切除肿瘤,降低复发率,术中需要切除大量骨组织及周围组织,肿瘤切除后往往无法保证充足的骨量[6-8]。近年来,定制骨盆假体在骨盆肿瘤治疗中的应用一定程度上提高了假体与骨盆的匹配性[8-10],然而传统技术制造的定制假体精确度差,且表面无相应微孔结构来促进骨与软组织长入,骨盆重建后的长期生物学稳定性较差[1-3]。为解决上述问题,本研究应用3D打印骨盆模型辅助术前设计,结合3D打印截骨导板进行辅助截骨,随后植入3D打印个体化钛合金骨盆假体进行骨盆的重建。3D打印截骨导板可提高骨盆截骨精确度,保证假体与残余骨盆相互匹配。另外,已有研究[1, 3]表明:3D打印骨盆假体可以精确填补骨盆截骨后的骨缺损部位,达到较好的骨盆解剖重建和功能重建效果。针对传统组配式骨盆假体松动率较高的问题,本研究应用的3D打印假体表面设计有网格结构,以期促进假体与骨融合,降低假体松动率,达到改善患者术后运动功能和生活质量的目的。
1 资料与方法 1.1 临床资料患者,女性,62岁。右肾透明细胞癌,右骨盆髋关节转移癌。患者5个月前无明显诱因右髋关节疼痛,活动后疼痛加剧,就诊于吉大林大学第二医院,诊断为“右肾透明细胞癌,右侧髋臼转移癌(EnnekingⅡB期)”。经全身骨显像检查(静脉注射99mTc-MDP,20mCi)和骨盆CT检查未发现其他部位转移。右髋4字实验(+);右髋关节活动度:伸0°,屈曲60°,内旋10°,外旋15°,内收10°,外展15°。骨盆CT检查:右侧髂骨及髋臼骨质破坏,髁间软组织阴影最大层面51 mm×42 mm(图 1,见插页三)。经全科会诊后决定行右侧半骨盆次全切及半骨盆重建术。本研究中3D打印个体化定制半骨盆假体植入手术经吉林大学第二医院医学伦理学会批准。在进行充分的医患沟通后,患者及家属签署手术知情同意书。
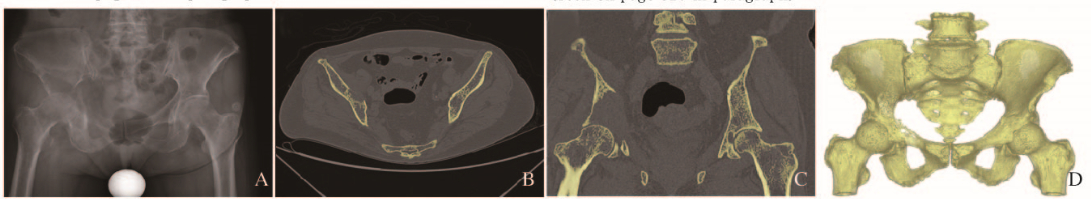
|
| 图 1 髋臼转移癌患者术前骨盆X线(A)、CT图像(B, C)和骨盆CT三维重建(D) Figure 1 Preoperative X-Ray(A), CT images(B, C) of pelvis, and 3D reconstruction data(D) of pelvic CT of patient with metastatic acetabular tumor |
|
|
骨盆CT采用日本飞利浦公司生产的256排螺旋CT扫描。各项参数如下:电子管电流232mA,电子管电压120kV, 扫描层厚1 mm。扫描后导出DICOM格式的骨盆CT数据。
1.2.2 制作3D打印光固化树脂骨盆模型将导出的DICOM格式骨盆CT数据导入Mimics14.0软件对骨盆进行三维重建,获得STL格式骨盆文件。将STL文件导入Magics软件对骨盆模型进行前处理并生成模型支撑。从Magics软件导出处理后的骨盆STL文件。向EOS P110尼龙粉末机和SLA450树脂打印机导入带有支撑数据的分层文件,打印患者光固化树脂骨盆模型(图 2,见插页四)。

|
| A:Design image of 3D printing pelvic osteotomy guide in Magics 16.0 Software; B: 3D printing pelvic osteotomy guide; C:3D printing titanium alloy pelvic prosthesis; D: Matching experiment of 3D printing titanium alloy pelvic prosthesis and 3D printing pelvic model 图 2 骨盆截骨导板的设计制作和3D打印钛合金骨盆假体 Figure 2 Design and manufacture of pelvic osteotomy guide and 3D printing titanium alloy pelvic prosthesis |
|
|
以患者健侧半骨盆镜像图像和术前规划的截骨范围作为构建3D打印钛合金假体形状的基本依据。在构建截骨导板时,将截骨线设计到距离肿瘤边缘2cm以上以保证肿瘤的彻底切除。本研究设计的3D打印截骨导板有与骨盆解剖形状一致的结合平面,导板上设计有截骨导向槽和固定孔。术中截骨导板定位成功后,以克氏针通过固定孔固定于骨盆相应位置进行截骨。设计完成后使用EOS P 110 3D打印机制造尼龙材料截骨导板。
1.2.4 设计与制造3D打印个体化半骨盆假体根据健侧半骨盆镜像图像以及患侧截骨范围设计3D打印骨盆假体。在假体骨接触面设计孔隙直径为400μm、孔隙率为60%的3D打印网格结构。骨盆假体选择Ti6Al4V材料,使用ArcamA1金属打印机以电子束熔融技术制造(图 2,见插页四)。
1.2.5 术前体外模拟匹配实验本研究使用3D打印截骨导板对患者患侧半骨盆树脂模型进行体外模拟截骨。截骨后的残余骨盆模型与3D打印半骨盆假体进行模拟匹配,以验证截骨导板与骨盆、3D打印半骨盆假体和残余骨盆匹配性(图 2,见插页四)。
1.3 手术过程全身麻醉生效后,患者取左侧卧位,采用右髋部K-L切口,显露股骨颈后垂直,暴露骨盆肿瘤区,将3D打印导板定位于骨盆相应位置,固定于骨盆后进行截骨,随后植入3D打印钛合金骨盆假体并用螺钉进行固定。安装46/28mm骨水泥髋臼杯,固定牢固后,选用10号生物型股骨颈假体及28/-4mm球头,插入股骨柄,复位髋关节,活动髋关节见活动度良好,冲洗术野,缝合各层组织,无菌辅料包扎。
1.4 随访结果术后2d嘱患者行下肢功能锻炼, 术后21 d出院。术后1、3、6和12月分别复查骨盆X线及CT,可见假体位置良好(图 3)。术后随访记录:健康调查简表(SF-36)评分术后6个月108.15分,12个月75.35分;肌肉骨骼肿瘤协会(MSTS)评分术后6个月16分,术后12个月11分;髋关节Harris评分术后6个月27分,术后12个月52分。术后12个月,患者能无辅助行走约1 km以上,日常生活能自理。
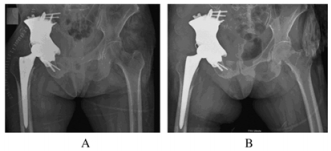
|
| 图 3 髋臼转移癌患者术中(A)和术后12个月(B)X线片 Figure 3 X-ray images in operation (A) and 12 months after operation (B) of patient with metastatic acetabulum tumor |
|
|
骨盆肿瘤尤其是继发性骨盆肿瘤患者5年生存率较低,且术后复发率高[9]。传统骨盆假体难以满足形态学方面的个体化需求,通常不能达到对骨盆的解剖重建。在截骨方面,植入传统组配式假体需要进行大量截骨,使骨盆周围肌腱失去原有附着点,周围软组织失去了骨盆的承托作用,导致患者术后下肢运动功能下降[5-9]。本研究采用了3D打印技术进行骨盆肿瘤精确切除及骨盆解剖和功能重建,其优势如下。
2.1 精确截骨截骨导板是一种可以明显提高截骨精确度的辅助截骨工具。目前个体化截骨导板已经开使广泛应用于骨盆肿瘤切除术[9-10]、股骨远端骨肉瘤切除术[11]和全膝关节置换术[12]等手术中。相对于截骨导航系统,截骨导板具有更高的截骨精度,更短的定位时间。Jentzsch等[13]研究显示:在4例骨盆肿瘤切除重建术中,1例患者应用截骨导板辅助截骨,术后测量截骨线与术前规划对比最大误差为0.4cm,而另1例无辅助截骨的患者截骨线与术前规划最大误差达到了2.8cm。Cartiaux等[14]报道了应用骨盆截骨导板对24个骨盆模型进行体外模拟截骨的研究,共规划96条截骨线,在骨盆截骨导板的辅助下,髂骨前、髂骨后截骨精度分别达到了1.0和1.2 mm的高精确度。上述研究表明:应用骨盆截骨导板可以明显提高骨盆截骨精度,骨盆截骨导板在提高截骨精确度的同时,也降低了术中骨盆附近重要血管神经损伤的发生率,减少了术中出血量。本研究采用截骨导板进行截骨,术中截骨导板术中与骨盆完美匹配,可完全按照术前计划进行截骨。该方式既提高了截骨的精准度,又明显缩短了手术时间,为下一步植入3D打印个体化骨盆假体,最后完成对骨盆的解剖重建奠定了基础。
2.2 简化手术流程骨盆肿瘤切除重建手术流程复杂,手术时间长,术中出血量大。Wei等[1]报道的3D打印骶骨假体骨盆重建手术时间为5 h,出血量3400 mL。Sun等[7]报道的16例原发骨盆肿瘤患者植入定制假体半骨盆重建研究中,平均手术时间为3.5 h,平均出血量2600 mL。Laffosse等[15]研究显示:10例髋臼肿瘤患者自体同侧股骨头骨移植骨盆重建手术平均手术时间5.2h,平均出血量2700 mL。本研究中由于应用3D打印骨盆模型进行术前规划以及模拟手术,术中应用3D打印截骨导板辅助截骨增强术中术前对病情以及手术流程的了解,手术时间仅为104min,术中出血量仅为900mL,远低于上述报道。骨盆肿瘤切除手术中使用3D打印骨盆模型、3D打印截骨导板及3D打印骨盆假体进行术前模拟和术中使用,能简化手术流程,明显缩短手术时间,减少术中出血量。
2.3 骨盆的解剖和功能重建骨盆肿瘤切除重建手术中,最大可能恢复骨盆原有的形态和功能并尽可能保留未侵及的骨质是骨盆重建的目标[1-3]。3D打印骨盆假体是以患者骨盆形态为基础进行个体化设计的,在恢复患者骨盆原有解剖形态方面具有难以比拟的优势。3D打印钛合金骨盆假体可以达到骨盆的解剖重建,并能提高患者下肢运动功能,改善患者术后生活质量。Wei等[1]曾经报道了1例植入“U型”3D打印钛合金骶骨假体进行的骶骨肿瘤切除重建的病例,术后患者骨盆环恢复了完整性,并且达到了骨盆解剖重建的标准。Chen等[2]报道:1例髂骨肿瘤患者应用3D打印髂骨假体精确填补骨盆肿瘤切除后的骨缺损部位,联合应用截骨导航系统提高了截骨精确度。Fan等[3]报道:应用3D打印技术在骨肿瘤保肢手术研究中分别设计了3D打印锁骨假体和3D打印骨盆假体,其中在3D打印髂骨假体骨盆重建研究中,手术时间仅为130min,术中出血量仅为800mL,术后18个月随访患者MSTS评分达到27分。3D打印半骨盆假体形状以患者健侧半骨盆镜像与规划截骨范围为构建依据,最大程度地达到对骨盆的解剖重建。3D打印半骨盆假体的研究中,大多结合了3D打印骨盆模型进行术前规划和模拟手术,且术中结合3D打印截骨导板和骨盆截骨导航系统等技术手段提高截骨精确度。这些辅助手段也成为了3D打印骨盆假体能保证匹配性并达到满意的骨盆重建效果的重要因素。
在保证骨盆解剖重建的同时,改善患者术后运动功能和生活质量也十分重要[1-2, 16]。研究[5-6]表明:定制骨盆假体骨盆重建术后较组配式假体功能更加优越。Danlșman等[6]报道了7例髋臼肿瘤患者,4例植入组配式鞍状骨盆假体进行骨盆肿瘤切除骨盆重建术,3例植入定制骨盆假体,定制骨盆假体组术后平均MSTS评分达总分的79%,而组配式假体组平均MSTS评分仅为总分的44%。Sun等[7]对16例原发骨盆肿瘤患者植入定制骨盆假体进行骨盆重建术,患者术后平均MSTS评分达到总分的72%。Wang等[5]报道的50例植入组配式假体进行骨盆肿瘤切除重建的研究中,最近一次随访患者平均MSTS评分仅达到总分的61.4%。本研究中,由于患者肾透明细胞癌恶性程度较高,后期发生扩散,生活质量评分和MSTS评分有所降低,SF-36评分由术后6个月的108.15分降低至术后12个月的75.35分,MSTS评分由术后6个月的16分降低至术后12个月的11分;但是在局部评分方面,本例患者患侧髋关节Harris评分由术后6个月的27分提高至术后12个月的52分, 说明植入3D打印骨盆假体进行骨盆重建对于患者下肢功能具有明显的改善。
2.4 骨盆长期稳定骨盆的长期稳定状态对于改善患者术后下肢功能至关重要。为了骨盆的长期稳定,本研究在假体与骨盆交界面设计了孔隙直径400 μm、孔隙率60%的3D打印网格结构。表面粗糙的3D打印网格结构有利于促进骨长入,促进假体与骨的融合,从而有利于骨盆重建后的长期稳定[1-3]。3D打印网格的形态十分复杂,通过传统的工业制造技术难以达到[1-2],这就突出了3D打印技术在假体制造方面的优势。在Wei等[1]的研究中,研究团队设计并制造了孔隙直径800μm、孔隙率为50%~80%的网格结构的3D打印钛合金骶骨髂骨假体来促进假体与骨的融合。Fan等[3]在骨肿瘤的保肢手术中,分别设计并制造了3D打印钛合金锁骨假体、肩胛假体和骨盆假体,假体表面均设计有3D打印钛合金网格结构。上述3D打印网格与本研究应用的类似,被证明具有良好的促进骨长入和软组织黏附的效果。
本研究应用3D打印技术进行骨盆肿瘤的精准切除和重建并获得了成功,在术后为期12个月的随访中也取得了较为满意的短期随访效果,为类似骨盆肿瘤切除重建提供了一个可行的方法。因本研究仅以1例髋臼肿瘤患者为例探索了3D打印技术在骨盆肿瘤切除重建术中的应用,其效果尚需更多的生物学、生物力学试验和临床试验来验证。
| [1] | Wei R, Guo W, Ji T, et al. One-step reconstruction with a 3D-printed, custom-made prosthesis after total en bloc sacrectomy:a technical note[J]. Eur Spine J, 2017, 26(7): 1902–1909. DOI:10.1007/s00586-016-4871-z |
| [2] | Chen X, Xu L, Wang Y, et al. Image-guided installation of 3D-printed patient-specific implant and its application in pelvic tumor resection and reconstruction surgery[J]. Computer Methods Programs Biomed, 2016, 125: 66–78. DOI:10.1016/j.cmpb.2015.10.020 |
| [3] | Fan H, Fu J, Li X, et al. Implantation of customized 3-D printed titanium prosthesis in limb salvage surgery:a case series and review of the literature[J]. World J Surg Oncol, 2015, 13: 308. DOI:10.1186/s12957-015-0723-2 |
| [4] | Kitagawa Y, Ek ET, ChoongPF. Pelvic reconstruction using saddle prosthesis following limb salvage operation for periacetabular tumour[J]. J Orthop Surg(Hong Kong), 2006, 14(2): 155–162. DOI:10.1177/230949900601400210 |
| [5] | Wang B, Xie X, Yin J, et al. Reconstruction with modular hemipelvic endoprosthesis after pelvic tumor resection:a report of 50 consecutive cases[J]. PLoS One, 2015, 10(5): e0127263. DOI:10.1371/journal.pone.0127263 |
| [6] | Danisman M, Mermerkaya MU, Bekmez S, et al. Reconstruction of periacetabular tumours with saddle prosthesis or custom-made prosthesis, functional results and complications[J]. Hip Int J, 2016, 26(2): e14–18. DOI:10.5301/hipint.5000306 |
| [7] | Sun W, Li J, Li Q, et al. Clinical effectiveness of hemipelvic reconstruction using computer-aided custom-made prostheses after resection of malignant pelvic tumors[J]. J Arthroplasty, 2011, 26(8): 1508–1513. DOI:10.1016/j.arth.2011.02.018 |
| [8] | Dai KR, Yan MN, Zhu ZA, et al. Computer-aided custom-made hemipelvic prosthesis used in extensive pelvic lesions[J]. J Arthroplasty, 2007, 22(7): 981–986. DOI:10.1016/j.arth.2007.05.002 |
| [9] | Holzapfel BM, Pilge H, Prodinger PM, et al. Customised osteotomy guides and endoprosthetic reconstruction for periacetabular tumours[J]. Int Orthopaed, 2014, 38(7): 1435–1442. |
| [10] | Menendez LR, Ahlmann ER, Falkinstein Y, et al. Periacetabular reconstruction with a new endoprosthesis[J]. Clin Orthop Related Res, 2009, 467(11): 2831–2837. DOI:10.1007/s11999-009-1043-z |
| [11] | Ma L, Zhou Y, Zhu Y, et al. 3D-printed guiding templates for improved osteosarcoma resection[J]. Sci Rep, 2016, 6: 23335. DOI:10.1038/srep23335 |
| [12] | Ng VY, DeClaire JH, Berend KR, et al. Improved accuracy of alignment with patient-specific positioning guides compared with manual instrumentation in TKA[J]. Clin Orthop Related Res, 2012, 470(1): 99–107. DOI:10.1007/s11999-011-1996-6 |
| [13] | Jentzsch T, Vlachopoulos L, Furnstahl P, et al. Tumor resection at the pelvis using three-dimensional planning and patient-specific instruments:a case series[J]. World J Surg Oncol, 2016, 14(1): 249. DOI:10.1186/s12957-016-1006-2 |
| [14] | Cartiaux O, Pau L, Francq BG, et al. Improved accuracy with 3D planning and patient-specific instruments during simulated pelvic bone tumor surgery[J]. Ann Biomed Engineering, 2014, 42(1): 205–213. DOI:10.1007/s10439-013-0890-7 |
| [15] | Laffosse JM, Pourcel A, Reina N, et al. Primary tumor of the periacetabular region:resection and reconstruction using a segmental ipsilateral femur autograft[J]. Orthop TraumatolSurg Res, 2012, 98(3): 309–318. DOI:10.1016/j.otsr.2011.11.007 |
| [16] | Rengierv F, Mehndiratta A, von Tengg-Kobligk H, et al. 3D printing based on imaging data:review of medical applications[J]. Int J Computer Assisted Radiol Surg, 2010, 5(4): 335–341. DOI:10.1007/s11548-010-0476-x |
 2018, Vol. 44
2018, Vol. 44


