扩展功能
文章信息
- 李晓, 邱香, 马振卉, 田亚萍
- LI Xiao, QIU Xiang, MA Zhenhui, TIAN Yaping
- 皮肤转移癌伴发带状疱疹1例报告并文献复习
- Skin metastatic carcinoma complicated with herpes zoster:A case report and literature review
- 吉林大学学报(医学版), 2018, 44(04): 825-827
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 825-827
- 10.13481/j.1671-587x.20180425
-
文章历史
- 收稿日期: 2017-12-03
2. 吉林大学第一医院放射线科, 吉林长春 130021
2. Department of Radiology, First Hospital, Jilin University, Changchun 130021, China
皮肤转移癌是恶性肿瘤通过血行或淋巴道转移、组织间隙直接扩散或外科手术种植而继发于皮肤的病变[1]。皮肤并不是肿瘤的主要转移部位,通常情况下,当发生皮肤转移时,其他器官也受到了影响,是预后不良的表现[2]。皮肤转移癌临床少见,内脏肿瘤患者皮肤转移癌发生率为0.7%~9.0%[3],一般发生在原发肿瘤诊断后3~5年内,多发年龄为50~70岁[3-4],尽管发生率低,但是皮肤转移癌的诊断十分重要,因为皮肤转移癌有时是潜在内脏肿瘤的首发表现或者是肿瘤复发的第一征象[5]。现总结本院收治的1例皮肤转移癌伴发带状疱疹患者的临床资料,其皮肤转移发生的时间远远晚于文献报道,结合文献复习报道如下。
1 临床资料 1.1 一般资料患者,女性,71岁。因右胸壁皮疹4个月,加重并累及右背部20d于2017年8月来本科就诊。4个月前,无明显诱因发现右胸壁出现红斑、水疱伴轻微疼痛,于当地中医院诊断为“带状疱疹”,给予口服中药及外用膏药(具体不详)疼痛好转,局部仍有红斑、丘疹和结节。20d前皮损出现破溃、糜烂、有渗液,疼痛明显,皮损逐渐扩大加深,融合成片,渐波及右腋下及背部。病程中患者出现活动后胸闷、气短,无发热、咳嗽、咳痰、恶心和呕吐等症状,饮食、睡眠尚可,二便正常,体质量无明显变化。否认药物过敏史。既往史:11年前于外院行右乳单纯切除术+右腋窝淋巴结切除术,术后病理诊断为乳腺髓样癌。随后于外院行5次化疗,复查情况不详。
1.2 皮肤科检查右侧胸壁、腋下、背部可见大片浸润性红斑,红斑表面形成30 cm×20 cm大小暗红色不规则溃疡,上覆黑痂,易剥离并出血,基底不平,边缘隆起、质硬,可见散在露珠至鸽蛋大小的丘疹、水疱及红色结节,轻微触痛,触之有浸润感。右侧乳房缺如,右前胸壁可见1个长约30 cm的陈旧手术瘢痕。
1.3 实验室检查血常规:白细胞11.09×109 L-1,中性粒细胞百分比76%。肝功能:门冬氨酸氨基转移酶38.4 U·L-1,胆碱脂酶4214 U·L-1,总蛋白58.4 g·L-1,白蛋白29.8 g·L-1,白球比1.04,前白蛋白0.10 g·L-1。肺CT显示:右侧胸腔积液,胸骨及右侧部分肋骨有改变,考虑转移所致;右侧乳腺占位性病变,双侧腋窝多发淋巴结转移,右侧胸壁软组织增厚及多发结节影, 考虑转移可能;右锁骨上窝淋巴结肿大。骨扫描:第9胸椎、第1及第3腰椎放射性增高。全腹部多排CT三期增强:肝左叶内侧段及肝右叶后段近表面低强化影,不除外转移所致;右侧腹壁皮肤增厚及皮下改变,转移所致可能性大。皮损穿刺病理检查:浸润性癌,伴广泛梗死(图 1,见插页三)。免疫组织化学染色:雌激素受体(ER)(-),孕激素受体(PR)(-),人表皮生长因子受体2(Her-2)(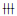
|
| A:Peripheral lymphocyte infiltration of cancer cells(HE,×200);B:Gland tubular growth of cancer cells in center(HE,×400). 图 1 患者皮损处组织病理形态表现 Figure 1 Pathomorphology of skin lesion tissue of patient |
|
|

|
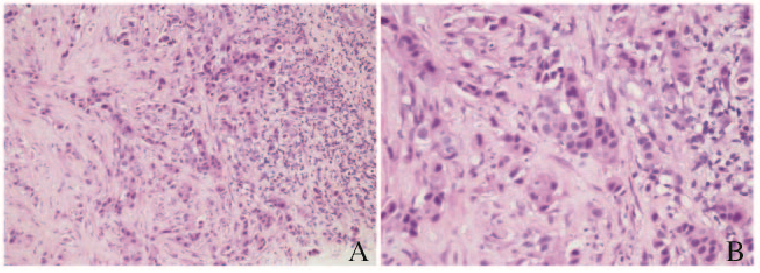
| A:Her-2(+);B:Ki67(+) 图 2 患者皮损处组织免疫组织化学染色结果(×100) Figure 2 Immunohistochemical staining results of skin lesion tissue of patient(×100) |
|
|
本例患者诊断为乳腺癌皮肤转移并发颈部淋巴结转移、肝转移、右侧腹壁转移、胸膜转移、骨转移和双侧腋窝淋巴结转移。局部给予黄柏液每日3次湿敷,改性几丁质每日2次外用。清创换药后,转入相关科室继续治疗。应用头孢唑肟2.0g, 每日2次静点;多西他赛联合曲妥珠单抗化疗,2个疗程后患者皮损情况有改善,但未能完全愈合。
2 讨论皮肤转移癌临床少见,多数意味着肿瘤的扩散和预后不良,通常平均生存期为7个月[6],也有文献[1, 7]报道平均生存期为3~18个月和13.8~36.0个月。皮肤转移癌中约60%的原发病为腺癌,主要包括乳腺癌、肺癌和胃肠道癌[3],Lookingbill等[8]报道:23.9%的女性乳腺癌患者有皮肤转移。van den Hurk等[9]报道:被诊断为原发性乳腺癌的患者发生皮肤转移往往晚于其他部位的转移。乳腺癌中ER和PR是重要的预后因子和预测因子。文献[10]报道:ER阴性乳腺癌5年复发率约33.3%,高于ER阳性者。本例患者免疫组织化学染色ER(-)、PR(-),皮肤转移发生在乳腺癌诊断11年后,转移时间明显长于多数文献报道的时间,本次就诊同时发现了胸膜转移、骨转移和肝转移等多处转移,预后差。恶性肿瘤皮肤转移的机制尚未明确,但淋巴转移被认为是最主要的转移途径,表现为皮下结节和皮肤红色丘疹[7],结合本例患者的临床表现,可能为乳腺癌术后残存的癌细胞经过皮肤丰富的淋巴管,在术后免疫功能低下时形成转移,具体机制还有待研究。
皮肤转移癌临床表现多样,通常是突然发生的无痛或疼痛性结节,可以是单发或多发,研究[3]显示:75%的皮肤转移癌发生在头皮、肚脐、胸部和腹部。皮损也可以表现为皮肤炎症、硬化及萎缩等,同一患者可有多种皮损同时发生。皮肤转移癌通常早期快速发展、随后病情稳定[3],因而常常被误诊为带状疱疹、皮脂腺囊肿、血管瘤、皮肤纤维瘤和皮肤感染等[11]。本例患者早期皮损表现为红斑水疱伴有疼痛,当地医院诊断为“带状疱疹”并给予相应诊治后,疼痛缓解、局部仍有红斑、丘疹、结节,20d前皮损扩大加深,出现浸润性红斑结节,迅速破溃、形成溃疡,就诊于本院行皮损处病理检查,结果显示:浸润性癌,伴广泛梗死,因此诊断为皮肤转移癌伴发带状疱疹。
目前对皮肤转移癌的治疗主要是系统和局部治疗两方面,系统治疗是通过化疗药物控制癌细胞扩散增殖、控制感染,局部治疗是通过清创及外用药物控制感染、加速创面愈合,但往往不能有效控制病情,特别是对于皮肤转移面积大、失去手术机会和传统治疗无效者。尽管皮肤转移癌很少直接威胁生命,但局部的疼痛、渗液、溃疡、感染及精神压力等很大程度上增加感染机会、加重病情,影响患者生活质量[12-13]。近年来有文献[14]报道:应用电化学疗法(electrochemotherap, ECT)可解决这一难题。ECT是通过电化学反应使局部内环境改变,达到治疗肿瘤的目的, 适用于乳腺癌、头面颈等体表肿块的辅助治疗,特别对术后复发转移灶和不能耐受化疗、放疗患者的晚期癌灶治疗前景较好,有明显抗癌和缓解疼痛的作用,不良反应少。Wichtowski等[15]报道:采用ECT治疗1例乳腺癌伴皮肤及皮下组织大面积转移患者,接受ECT治疗后,患者皮肤深大溃疡明显愈合。本例患者溃疡面积远远大于Wichtowski等报道的病例,给予化疗、全身和局部抗感染治疗后,创面缩小,脓液消失,但仍有少量渗液,溃疡未能完全愈合。ECT为皮肤转移癌患者今后治疗提供了新的思路。
综上所述,皮肤转移癌有着早期发展迅速、随后缓解的规律,其临床表现无特异性,因此临床医生应充分认识皮肤转移癌的临床特点,在诊治过程中提高警惕,及时行组织病理检查及其他部位的相关检查,可减少皮肤转移癌误诊和漏诊,并为患者争取治疗时间。
| [1] | Dehal A, Patel S, Kim S, et al. Cutaneous metastasis of rectal cancer:a case report and literature review[J]. Perm J, 2016, 20(1): 74–78. |
| [2] | Sittart JA, Senise M. Cutaneous metastasis from internal carcinomas:a review of 45 years[J]. Anais Bras Dermatol, 2013, 88(4): 541–544. DOI:10.1590/abd1806-4841.20131165 |
| [3] | Weimann ET, Botero EB, Mendes C, et al. Cutaneous metastasis as the first manifestation of occult malignant breast neoplasia[J]. An Bras Dermatol, 2016, 91(5 Suppl1): 105–107. |
| [4] | Bittencourt Mde J, Carvalho AH, Nascimento BA, et al. Cutaneous metastasis of a breast cancer diagnosed 13 years before[J]. An Bras Dermatol, 2015, 90(3 Suppl1): 134–137. |
| [5] | Prabhu S, Pai SB, Handattu S, et al. Cutaneous metastases from carcinoma breast:the common and the rare[J]. Indian J Dermatol Venereol Leprol, 2009, 75(5): 499–502. DOI:10.4103/0378-6323.55395 |
| [6] | Brown G, Kurtzman D, Lian F, et al. Eruptive nodules of the head and neck:a case report of metastatic prostate cancer[J]. Dermatol Online J, 2014, 20(2): 21544. |
| [7] | Kamaraju S, Depke J, Povletich J, et al. Cutaneous metastasis due to breast cancer in a patient with primary biliary cirrhosis:A case report[J]. Case Rep Oncol, 2016, 9(3): 718–725. DOI:10.1159/000452145 |
| [8] | Lookingbill DP, Spangler N, Sexton FM, et al. Skin involvement as the presenting sign of internal carcinoma[J]. J Am Acad Dermatol, 1990, 22(1): 19–26. DOI:10.1016/0190-9622(90)70002-Y |
| [9] | van den Hurk CJ, Eckel R, van de Poll-Franse LV, et al. Unfavourable pattern of metastases in M0 breast cancer patients during 1978-2008:a population-based analysis of the Munich Cancer Registry[J]. Breast Cancer Res Treat, 2011, 128(3): 795–805. DOI:10.1007/s10549-011-1372-y |
| [10] | 李刚, 宁连胜. 雌孕激素受体与女性原发乳腺癌术后复发转移关系的临床研究[J]. 中华肿瘤防治杂志, 2006, 13(3): 187–189. |
| [11] | 徐和甜, 张东, 王贺, 等. 乳腺癌术后皮肤转移1例[J]. 皮肤病与性病, 2017, 39(4): 303–304. |
| [12] | Nashan D, Meiss F, Braun-Falco M, et al. Cutaneous metastases from internal malignancies[J]. Dermatol Ther, 2010, 23(6): 567–580. DOI:10.1111/dth.2010.23.issue-6 |
| [13] | Kähler KC, Egberts F, Gutzmer R. Palliative treatment of skin metastases in dermato-oncology[J]. J German Sci Dermatol:JDDG, 2013, 11(11): 1041–1045. |
| [14] | 周炳刚, 魏昌晟, 张智, 等. 低毫安电化学疗法抑制磷酸肌醇3激酶/蛋白激酶B信号通道抗人乳腺癌细胞株MDA-MB231侵袭迁移的机制[J]. 中华实验外科杂志, 2016, 33(4): 917–921. |
| [15] | Wichtowski M, Potocki P, Kufel-Grabowska J, et al. Electrochemotherapy in the treatment of massive, multisite breast cancer metastasis to the skin and subcutaneous tissue:A case report[J]. Breast Care(Basel), 2016, 11(5): 353–355. |
 2018, Vol. 44
2018, Vol. 44


