扩展功能
文章信息
- 朱效慧, 孟琴, 冯世燕
- ZHU Xiaohui, MENG Qin, FENG Shiyan
- TP53在不明原因复发性流产患者绒毛组织中的表达及其对人滋养层细胞生长的影响
- Expression of TP53 in villus tissue of unexplained recurrent spontaneous abortion and its effect on growth of human trophoblast cells
- 吉林大学学报(医学版), 2018, 44(04): 796-800
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 796-800
- 10.13481/j.1671-587x.20180419
-
文章历史
- 收稿日期: 2017-07-11
2. 临沂医专附属医院妇产科, 山东 临沂 276000
2. Department of Obstetrics and Gynecology, Linyi Medical College, Linyi 276000, China
复发性流产(recurrent spontaneous abortion, RSA)是指育龄妇女连续2次或2次以上自然流产,虽然RSA的发生率不足5%,但给患者造成了极大的影响,且会随着RSA次数的增加而增加下次流产的风险[1]。目前已知的RSA的原因有内分泌异常、生殖道感染畸形及染色体异常等,然而仍然有50%左右的RSA未找到原因,称为不明原因复发性流产(unexplained recurrent spontaneous abortion,URSA)[2]。URSA占RSA的60%~70%,由于发病的原因不明确,治疗非常困难,也无针对性的治疗措施,给患者的身心和经济造成了沉重的负担[3-4]。因此,研究URSA的发病机制,并找到安全高效的治疗方法是解决URSA的关键。
肿瘤蛋白P53(tumor protein P53,TP53)起初被认为是一种抑癌基因。TP53能抑制或激活基因的表达和转录,避免基因发生突变。随着对TP53研究的深入,研究[4-5]显示:TP53在生殖中也起重要作用。研究[6-7]显示:TP53多态性与RSA有关,若有发育毒性物质以氧化应激的方式起作用,TP53基因能保护胚胎发育,若发育毒性物质以激活细胞凋亡的方式起作用,TP53基因能导致胚胎的异常发育。但TP53对URSA的影响及机制目前尚未清楚。鉴于TP53基因在胚胎发育方面的作用,本研究拟探讨TP53在URSA绒毛组织中的表达及其对人滋养层细胞生物学特性的影响,以期为后续URSA的研究提供理论依据。
1 资料与方法 1.1 一般资料患者组:选取2014年9月—2015年6月山东省临沂市人民医院妇产科收治的URSA患者40例,年龄21~39岁,平均年龄30.4岁,孕期42~ 79 d,平均孕期59.2 d;所有患者尿人绒毛膜促性腺激素(HCG)呈阳性,B超检测均显示为宫内孕,无胎心音。对照组:选取同时期在山东省临沂市人民医院就诊的实施人工流产的健康孕妇30例, 年龄21~39岁,平均年龄29.3岁;孕期40~74 d,平均孕期49.2 d;所有研究对象尿HCG呈阳性,B超检测均显示为宫内孕,有胎心,胎儿正常发育。
1.2 细胞、试剂和主要仪器人滋养层HTR-8细胞购自中国医学科学院基础医学研究所细胞中心。胎牛血清、RPMI1640培养基和胰酶均购自美国Gibco公司,青、链霉素购自美国Amresco公司,荧光定量试剂盒和反转录试剂盒购自日本TaKaRa公司,细胞凋亡试剂盒购自美国ACTGene公司,Bcl-2和Bax单克隆抗体均购自美国Millipore公司,Cleaved-Caspase3单克隆抗体购自福州迈新生物技术公司,BCA试剂盒购自碧云天生物技术有限公司。CO2细胞培养箱(HERAcell型)购自美国Thermo公司,倒置荧光显微镜(CK2-TRC-3型)购自日本Olympus公司,流式细胞仪(LSR Ⅱ)购自美国BD公司,垂直电泳槽(DYCZ-24EN)购自北京六一生物科技有限公司,128C型酶标仪购自奥地利CliniBio公司。
1.3 样本收集和处理所有样本的采集均经过患者及家属的知情同意。所有研究对象的绒毛组织均在无菌条件下通过负压吸引术获得,置于-80℃冰箱中保存。
1.4 细胞培养从液氮罐中取出人滋养层HTR-8细胞,37℃水浴溶解,向冻存管中加入含有10%FBS、100 g·L-1链霉素和100 U·mL-1青霉素的RPMI1640培养基培养。传代3~4次调整细胞状态,细胞融合度达到90%以上时,0.25%胰蛋白酶消化细胞,含10%FBS培养基终止消化,调整细胞密度为4×105mL-1,细胞接种于96孔板中,置于37℃、5% CO2培养箱中培养。
1.5 细胞转染按照美国Invitrogen公司的LipofectamineTM2000转染方法进行细胞转染。HTR-8细胞分为3组:空白对照组,细胞中加入无血清的RPMI1640培养基;空载体组,细胞中转染合成的无干扰作用的siRNA;TP53-siRNA组,细胞中转染合成的靶向抑制TP53的特异性siRNA。siRNA均由广州瑞博奥生物科技有限公司设计并合成。取生长至对数期的HTR-8细胞,消化后接种于24孔板中进行培养。将siRNA转染到HTR-8细胞中,37℃、5% CO2培养箱中培养3~4h,换成含10%FBS的RPMI1640培养基并观察转染效率,继续培养细胞48h。
1.6 RT-PCR法检测绒毛组织中TP53 mRNA表达水平取绒毛组织,在加入液氮的研钵中研磨成粉末后转入经DEPC水处理的EP管中,按照说明书(美国Invitrogen公司)加入1mL Trizol裂解细胞,提取总RNA。紫外分光光度计检测提取的总RNA质量,A(260)/A(280)值为1.8~2.0表明RNA纯度高。通过逆转录试剂盒将总RNA反转录成cDNA,按照实时定量PCR试剂盒说明进行目的基因的扩增。以GAPDH为内参,根据RT-PCR法检测的Ct值,采用2-△△ct方法计算TP53 mRNA表达水平。实验重复3次,取平均值。
1.7 Western blotting法检测绒毛组织中和各组HTR-8细胞中TP53蛋白表达水平绒毛组织在预先加入液氮的研钵中研磨成粉末,转入已加入适量裂解液的离心管中,置于冰上裂解反应30 min,4℃、15000 r·min-1离心15 min,收集上清。BCA试剂盒测定蛋白浓度。上样缓冲液与蛋白样品充分混匀,100℃变性5 min后进行SDS-PAGE电泳,电泳结束后转印蛋白至PVDF膜上,5%脱脂奶粉室温封闭2 h。分别以1:500稀释的TP53作为一抗,4℃孵育过夜,TBST清洗后加入1:1000稀释的辣根过氧化物酶标记的二抗,37℃孵育1 h。TBST清洗,ECL发光剂显影后用自动凝胶成像系统采集图像。以目的蛋白与内参GAPDH蛋白的灰度值比值作为目的蛋白的相对表达水平。各组HTR-8细胞中TP53蛋白表达水平检测方法同上。实验重复3次,取平均值。
1.8 流式细胞术检测细胞凋亡率取转染48 h细胞,胰酶消化成单细胞悬液,调整细胞浓度为4×105mL-1,取1 mL细胞悬液加入培养瓶中,37℃、5% CO2培养箱中培养48h,观察到细胞贴壁生长状态良好时,收集悬浮及贴壁细胞,1 000 r·min-1离心5 min,AnnexinⅤ-FITC结合液重悬细胞,避光室温孵育10 min,离心,弃上清,PI冰盒中避光孵育10 min。流式细胞术检测空白对照组和TP53-siRNA组细胞凋亡率。
1.9 Transwell小室检测细胞迁移数取转染48h的细胞,接种于Transwell小室的上室,置于含10%胎牛血清的RPMI1640培养基培养,下室加入含10%胎牛血清的RPMI1640培养基培养,培养48 h后弃去培养液,用棉签轻轻拭去膜上的细胞,HE染色后在倒置显微镜下进行迁移细胞计数。随机计数5个高倍视野(×200)下侵袭至滤膜下表面的细胞数,计算平均值,实验重复3次。
1.10 Western blotting法检测凋亡相关蛋白Caspase3、Bcl-2和Bax蛋白表达水平取转染48 h的空白对照组和TP53-siRNA组细胞,提取细胞中的蛋白,BCA试剂盒检测提取的蛋白浓度,采用1.5中方法检测空白对照组和TP53-siRNA组细胞中Caspase3、Bcl-2和Bax蛋白表达水平。
1.11 统计学分析采用SPSS20.0统计软件进行统计学分析。对照组和患者组TP53 mRNA和蛋白表达水平,各组细胞凋亡率、细胞迁移数和TP53、Cleaved- Caspase3、Bcl-2、Bax蛋白表达水平均以x±s表示,在符合正态分布前提下进行t检验或单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 2组研究对象绒毛组织中TP53 mRNA和蛋白表达水平对照组和患者组绒毛组织中TP53mRNA表达水平分别为1.000±0.000和3.549±0.326,蛋白表达水平分别为0.021±0.004和0.273±0.032,患者组绒毛组织中TP53 mRNA和蛋白表达水平均明显高于对照组(P < 0.01)。见图 1。
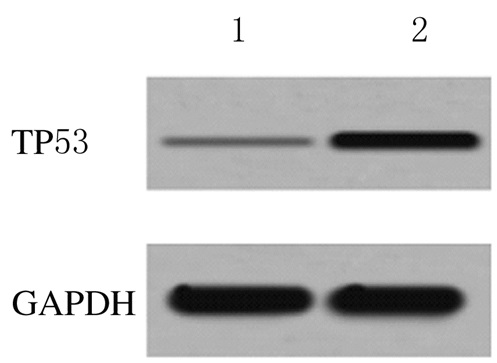
|
| Lane 1: Control group; Lane 2:Patient group. 图 1 2组研究对象绒毛组织中TP53蛋白表达电泳图 Figure 1 Electrophoregram of expressions of TP53 protein in villus tissue of subjects in two groups |
|
|
细胞转染48 h后,TP53-siRNA组细胞中TP53蛋白表达水平(0.112±0.009)明显低于空白对照组(0.387±0.012)和空载体组(0.398±0.014)(P < 0.01),空载体组与空白对照组比较差异无统计学意义(P>0.05)。见图 2。

|
| Lane 1: Blank control group; Lane 2: Vector group; Lane 3: TP53-siRNA group. 图 2 各组HTR-8细胞中TP53蛋白表达电泳图 Figure 2 Electrophoregram of TP53 expressions in HTR-8 cells in various groups |
|
|
细胞转染48 h后,TP53-siRNA组细胞凋亡率(3.46%±0.56%)明显低于空白对照组(15.38%±1.21%)(P < 0.01)。见图 3。
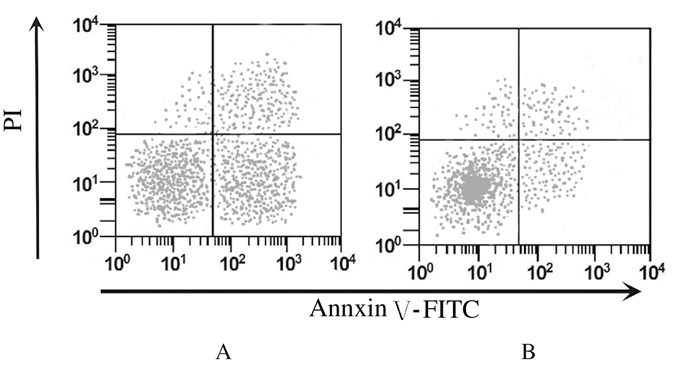
|
| A: Blank control group; B: TP53-siRNA group. 图 3 流式细胞术检测各组细胞凋亡率 Figure 3 Apoptoic rates of cells in two groups detected by flow cytometry |
|
|
细胞转染48h后,Transwell小室检测,空白对照组和TP53-siRNA组细胞迁移数分别为71.23±8.88和152.46±6.54,TP53-siRNA组细胞迁移数明显高于空白对照组(P < 0.01)。
2.5 各组细胞中Cleaved-Caspase3、Bax和Bcl-2蛋白表达水平细胞转染48 h后,与空白对照组比较,TP53-siRNA组细胞中Cleaved-Caspase3和Bax蛋白表达水平均明显降低(P < 0.01),Bcl-2蛋白表达水平明显升高(P < 0.01)。见图 4和表 1。
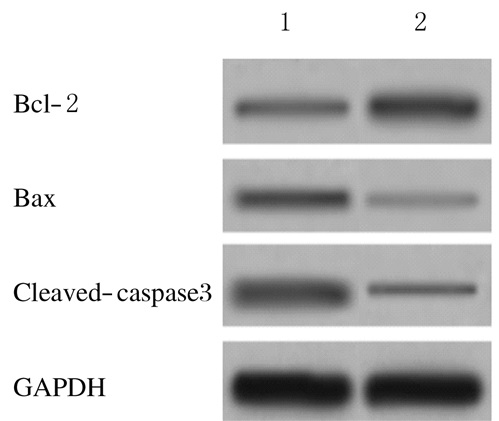
|
| Lane 1:Blank control group; Lane 2:TP53-siRNA group. 图 4 Western blotting法检测各组细胞中Cleaved-Caspase3、Bax和Bcl-2蛋白表达电泳图 Figure 4 Electrophoregram of expressions of Cleaved-Caspase3, Bax, and Bcl-2 proteins detected by Western blotting method |
|
|
| (n=3, x±s) | |||
| Group | Cleaved-Caspase3 | Bax | Bcl-2 |
| Blank control | 0.436±0.032 | 0.372±0.031 | 0.166±0.015 |
| TP53-siRNA | 0.160±0.018* | 0.141±0.017* | 0.415±0.036* |
| * P < 0.01 compared with blank control group. | |||
细胞凋亡与维持机体的正常生理功能及组织器官的发育有关联,在妊娠孕卵的着床和胚胎的正常发育过程中发挥重要作用[8]。研究[9]显示:滋养层细胞大量的凋亡可导致细胞侵入功能不足,可诱导患者绒毛组织中细胞发生凋亡,说明滋养层细胞凋亡过多可能是引起反复自然流产的原因。研究[10-12]显示:TP53在生殖过程中扮演重要角色,可通过下调Bcl-2和上调Bax的表达启动细胞凋亡,在URSA患者中TP53的表达升高,且能诱导人滋养层细胞凋亡。提示TP53可能与URSA有关。但目前TP53对URSA的影响及其机制尚未清楚。
本研究首先检测了URSA患者绒毛组织中TP53的表达,结果显示:URSA患者绒毛组织中TP53mRNA和蛋白表达水平均明显升高,与已往的研究[12]结果一致。RNA干扰技术是使特定基因表达沉默的一项新技术,目前在多种疾病治疗、基因功能研究等方面广泛应用[13-14]。鉴于TP53在URSA患者绒毛组织中的高表达,本研究通过RNA干扰技术沉默人滋养层细胞TP53表达,结果显示:TP53受到干扰后人滋养层细胞凋亡率明显降低,迁移能力升高,提示沉默TP53表达可降低URSA的发生率。
Caspase家族在细胞凋亡过程中起重要作用,Caspase3是该家族关键成员,也是能在胎盘组织中表达的Caspase[15-16]。研究[17-18]显示:Caspase3在URSA患者绒毛组织中的表达水平明显高于对照组,说明Caspase3表达水平升高可能是引起流产的原因。Bax和Bcl-2在细胞凋亡过程中起重要的调控作用,Bax促进细胞凋亡,Bcl-2抑制细胞凋亡,Bax/Bcl-2比值升高促进细胞凋亡,反之则抑制细胞凋亡[19]。通过调节Bax/Bcl-2比值可影响人滋养层细胞的凋亡[20]。本研究结果显示:干扰TP53表达后Cleaved-Caspase3和Bax表达水平降低,Bcl-2表达水平升高,提示干扰TP53表达对人滋养层细胞凋亡的影响机制可能是通过调控Cleaved-Caspase3、Bax和Bcl-2表达实现的。
综上所述,在URSA患者绒毛组织中TP53呈高表达,沉默人滋养层HTR-8细胞TP53表达能明显促进细胞迁移和抑制细胞凋亡。本研究为探讨URSA患者的诊疗途径提供了理论基础。
| [1] | Li S, Wang L, Xing Z, et al. Expression level of TNF-α in decidual tissue and peripheral blood of patients with recurrent spontaneous abortion[J]. Cent Eur J Immunol, 2017, 42(2): 156–160. |
| [2] | Demetriou C, Abu-Amero S, White S, et al. Investigation of the Annexin A5 M2 haplotype in 500 white European couples who have experienced recurrent spontaneous abortion[J]. Reprod Biomed Online, 2015, 31(5): 681–688. DOI:10.1016/j.rbmo.2015.07.004 |
| [3] | Yang K, Zhang B, Lou GY, et al. The study of the prognostic value of mixed lymphocyte reaction blocking factor (MLR-Bf) for the pregnancy outcome after lymphocyte immunization in different kinds of patients with unexplained recurrent spontaneous abortion[J]. Int J Clin Exp Pathol, 2017, 10(1): 688–694. |
| [4] | Karim S, Jamal HS, Rouzi A, et al. Genomic answers for recurrent spontaneous abortion in Saudi Arabia:An array comparative genomic hybridization approach[J]. Reprod Biol, 2017, 17(2): 133–143. DOI:10.1016/j.repbio.2017.03.003 |
| [5] | Bouaoun L, Sonkin D, Ardin M, et al. TP53 variations in human cancers:new lessons from the IARC TP53 database and genomics data[J]. Hum Mutat, 2016, 37(9): 865–876. DOI:10.1002/humu.2016.37.issue-9 |
| [6] | Chen H, Yang X, Wang Z. Association between p53 Arg72Pro polymorphism and recurrent pregnancy loss:an updated systematic review and meta-analysis[J]. Reprod Biomed Online, 2015, 31(2): 149–153. DOI:10.1016/j.rbmo.2015.05.003 |
| [7] | Kang HJ, Rosenwaks Z. p53 and reproduction[J]. Fertil Steril, 2018, 109(1): 39–43. DOI:10.1016/j.fertnstert.2017.11.026 |
| [8] | Dong X, Yang L, Wang H. miR-520 promotes DNA-damage-induced trophoblast cell apoptosis by targeting PARP1 in recurrent spontaneous abortion (RSA)[J]. Gynecol Endocrinol, 2017, 33(4): 274–278. DOI:10.1080/09513590.2016.1266476 |
| [9] | 杨倩兰, 王育. 三氯生对人早孕滋养细胞11β-HSD2和HLA-G表达的影响[J]. 上海交通大学学报:医学版, 2016, 36(6): 787–792. |
| [10] | Speidel D. The role of DNA damage responses in p53 biology[J]. Arch Toxicol, 2015, 89(4): 501–517. DOI:10.1007/s00204-015-1459-z |
| [11] | Tian X, Zeng G, Li X, et al. Cantharidin inhibits cell proliferation and promotes apoptosis in tongue squamous cell carcinoma through suppression of miR-214 and regulation of p53 and Bcl-2/Bax[J]. Oncol Rep, 2015, 33(6): 3061–3068. DOI:10.3892/or.2015.3942 |
| [12] | Shen C, Zhong N. Long non-coding RNAs:The epigenetic regulators involved in the pathogenesis of reproductive disorder[J]. Am J Reprod Immunol, 2015, 73(2): 95–108. DOI:10.1111/aji.2015.73.issue-2 |
| [13] | Gammon DB, Ishidate T, Li L, et al. The antiviral RNA interference response provides resistance to lethal arbovirus infection and vertical transmission in Caenorhabditis elegans[J]. Curr Biol, 2017, 27(6): 795–806. DOI:10.1016/j.cub.2017.02.004 |
| [14] | Bisaria N, Jarmoskaite I, Herschlag D. Lessons from enzyme kinetics reveal specificity principles for RNA-guided nucleases in RNA interference and CRISPR-based genome editing[J]. Cell Syst, 2017, 4(1): 21–29. |
| [15] | 韦家俊, 李浩, 廖小明, 等. 肢体缺血后处理对局灶性脑缺血再灌注大鼠Caspase-3和细胞凋亡的影响[J]. 中国老年学杂志, 2017, 37(4): 804–806. |
| [16] | 冯本周. GPR30在子痫前期胎盘组织和正常胎盘组织中的差异表达及其临床意义[J]. 海南医学院学报, 2016, 22(7): 692–695. |
| [17] | Wu F, Tian F, Zeng W, et al. Role of peroxiredoxin2 downregulation in recurrent miscarriage through regulation of trophoblast proliferation and apoptosis[J]. Cell Death Dis, 2017, 8(6): e2908. DOI:10.1038/cddis.2017.301 |
| [18] | Sha J, Liu F, Zhai J, et al. Alteration of Th17 and Foxp3+ regulatory T cells in patients with unexplained recurrent spontaneous abortion before and after the therapy of hCG combined with immunoglobulin[J]. Exp Ther Med, 2017, 14(2): 1114–1118. DOI:10.3892/etm.2017.4574 |
| [19] | Erfani S, Khaksari M, Oryan S, et al. Nampt/PBEF/visfatin exerts neuroprotective effects against ischemia/reperfusion injury via modulation of Bax/Bcl-2 ratio and prevention of caspase-3 activation[J]. J Mol Neurosci, 2015, 56(1): 237–243. DOI:10.1007/s12031-014-0486-1 |
| [20] | Xia S, Zhen Y, Ma H, et al. Abnormal expression of microRNA-575 leads to missed abortion through regulating apoptosis and angiogenesis[J]. Exp Ther Med, 2017, 14(5): 3993–4000. |
 2018, Vol. 44
2018, Vol. 44


