扩展功能
文章信息
- 郑燕, 王娜, 吴命坤, 刘静乔, 孟亚丽
- ZHENG Yan, WANG Na, WU Mingkun, LIU Jingqiao, MENG Yali
- 米非司酮对稽留流产患者血清和绒毛组织中Ang-1、Ang-2、VEGF、TNF-α和IL-6表达水平的影响
- Influence of mifepristone in expression levels of Ang-1, Ang-2, VEGF, TNF-α and IL-6 in serum and villus tissue of patients with missed abortion
- 吉林大学学报(医学版), 2018, 44(04): 791-795
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 791-795
- 10.13481/j.1671-587x.20180418
-
文章历史
- 收稿日期: 2017-10-26
稽留流产是指胚胎或胎儿已死亡滞留宫腔内不能及时自然排出,是流产中的一种特殊类型[1]。导致稽留流产发生的人群主要有室外职业者、初产妇、自然流产病史患者、贫血和乙肝病毒携带者,环境因素和其他未知因素也是稽留流产发生的重要原因[2]。研究[3-5]表明:在妊娠过程中,受精卵着床到胎盘形成过程与新血管的生成有密切关系,血管生成素(angiopoietin,Ang)和血管内皮生长因子(vascular endothelial growth factor,VEGF)参与该过程。对于稽留流产的治疗,目前临床上主要以米非司酮联合米索前列醇终止妊娠,该方法具有临床疗效好和药物不良反应少等特点[6]。目前对米非司酮终止稽留流产的具体机制尚未明确,关于Ang和VEGF在稽留流产患者血清中的表达和相关性研究较少。本研究通过观察米非司酮对68例稽留流产患者血清和绒毛组织中Ang-1、Ang-2和VEGF表达水平的影响,并检测细胞因子肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)的表达情况,阐明米非司酮终止稽留流产的作用机制,为临床上应用米非司酮终止稽留流产提供理论依据。
1 资料与方法 1.1 临床资料选取2014年3月—2017年3月在本院就诊的孕10~16周的稽留流产患者68例作为药流组,年龄20~39岁,停经10~16周。纳入标准:①年龄20~40岁,平时月经规律;②夫妻双方染色体核型无异常;③经B超检查提示胚胎已停止发育,胎死宫中,子宫体积均不同程度小于孕周;④无内分泌异常;⑤无血栓形成倾向;⑥排除免疫因素和感染因素影响。选择自愿要求终止妊娠的孕10~16周正常妊娠者51例为对照组,年龄20~38岁,停经时间10~16周。纳入标准:①年龄20~40岁,平时月经规律;②既往正常分娩史且无不良孕产史;③此次孕期无腹痛、阴道流血和其他不适,未保胎治疗;④B超检查提示胎儿存活,子宫大小与孕周相符。均自愿要求终止妊娠。所有入选者血尿常规、肝功能和凝血功能正常,无子宫畸形及其研究对象内外科并发症,无米索前列醇应用禁忌证。以上研究对象在年龄、孕周、孕次和产次等方面比较差异均无统计学意义(P>0.05),具有可比性。
1.2 分组和给药对照组研究对象于手术前1d抽取静脉血,第2天采用常规负压吸引流产,手术后收集静脉血和绒毛。药流组患者给药前1d抽取静脉血,于第2天19:00、第3天7:00、19:00分别口服给予米非司酮50 mg,第4天8:00口服给予米索前列醇600 μg,于同一天抽取静脉血,观察宫缩、妊娠物排出情况、阴道出血量和不良反应等,孕囊排出后即刻收集绒毛。
1.3 样本的采集及制备收集研究对象静脉血后,静置30 min,3000 r·min-1离心15 min,取血清,-20℃保存。收集患者绒毛组织后,采用生理盐水冲洗,10%甲醛溶液固定1 d后,常规脱水,采用石蜡包埋,制作4 μm连续切片,切片于60℃下烤片2h后行免疫组织化学染色。常规脱蜡水化,磷酸盐缓冲液(PBS)漂洗;采用羊血清工作液封闭非特异性抗原修复;分别加入Ang-1、Ang-2、VEGF、TNF-α和IL-6一抗,对照组切片以PBS代替一抗,4℃过夜。室温孵育40 min后加入生物素标记的羊抗兔二抗IgG和底物;二氨基联苯胺(DAB)显色,苏木素复染,常规脱水、透明、封片。Ang-1、Ang-2和VEGF试剂盒由北京博奥森生物科技有限公司提供,TNF-α和IL-6试剂盒由武汉博士德生物工程公司提供。
1.4 ELISA法检测血清中Ang-1、Ang-2、VEGF、TNF-α和IL-6水平取患者血清,采用ELISA法检测血清中Ang-1、Ang-2、VEGF、TNF-α和IL-6水平,于各检测孔加入100 μL样本溶液,加入50 μL标准品和对照,孵育2h,洗涤,加入200 μL偶联抗体,孵育2 h,洗涤后加入200μL底物,避光孵育30 min,加入20 μL终止液。采用酶标仪(美国Thermo公司)测定各孔吸光度(A)值。根据标准曲线计算所测标本中各检测指标的水平。
1.5 免疫组织化学法检测绒毛组织中Ang-1、Ang-2、VEGF、TNF-α和IL-6表达水平绒毛组织行常规免疫组织化学方法染色,切片置于显微镜下观察。Ang-1、Ang-2、VEGF、TNF-α、IL-6阳性染色为细胞内有棕黄色颗粒,观察其分布及染色深浅。经病理图像分析系统(德国LEICA公司)在高倍镜(×400)下照相,应用Image-Pro Plus Version 6.0图像分析软件对每张切片的阳性区域进行定量检测,测定阳性反应产物的积分吸光度(IA)值,代表Ang-1、Ang-2、VEGF、TNF-α和IL-6表达水平,染色越深,阳性反应越强,IA值越大。
1.6 统计学分析采用SPSS 18.0统计软件进行统计学分析。2组研究对象血清和绒毛组织中Ang-1、Ang-2、VEGF、TNF-α和IL-6水平以x±s表示,两组间样本均比较采用独立样本t检验,各组治疗前后比较采用配对t检验。Ang-1、Ang-2与VEGF的相关性分析采用Pearson相关分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 2组研究对象临床特征与对照组比较,药流组患者年龄、孕龄、孕次和产次比较差异无统计学意义(P>0.05)。见表 1。
| (x±s) | |||||
| Group | n | Age(year) | Gestational age(t/d) | Gravidity | Parity |
| Control | 51 | 27.9±5.2 | 87.7±10.8 | 1.3±0.2 | 0.15±0.13 |
| Drug abortion | 68 | 28.1±3.7 | 88.4±11.3 | 1.4±0.3 | 0.13±0.08 |
与引产前比较,药流组患者引产后血清中Ang-1、Ang-2、VEGF、TNF-α和IL-6水平明显升高(P < 0.05)。与对照组引产前比较,药流组患者引产前血清Ang-1、Ang-2、VEGF和TNF-α水平差异无统计学意义(P>0.05),IL-6水平明显降低(P < 0.05);与对照组引产后比较,药流组患者引产后血清中Ang-1、Ang-2、VEGF和TNF-α水平明显升高(P < 0.05)。对照组研究对象引产前后血清中Ang-1、Ang-2、VEGF、TNF-α和IL-6水平比较差异均无统计学意义(P>0.05)。见表 2。
| [x±s, ρB/(ng·L-1)] | |||||||||||||||
| Group | n | Ang-1 | Ang-2 | VEGF | TNF-α | IL-6 | |||||||||
| Before | After | Before | After | Before | After | Before | After | Before | After | ||||||
| Control | 51 | 32.36±9.70 | 31.75±7.60 | 26.66±5.10 | 27.47±5.90 | 32.58±7.50 | 30.75±5.60 | 3.28±0.67 | 3.17±0.82 | 6.48±1.68 | 6.65±1.24 | ||||
| Drug abortion | 68 | 30.18±3.80 | 51.65±4.60*△ | 27.65±4.10 | 37.32±5.70*△ | 31.81±5.10 | 44.64±6.70*△ | 2.59±0.90 | 5.84±0.81*△ | 3.17±1.04△ | 5.67±0.51* | ||||
| * P < 0.05 compared with before abortion; △ P < 0.05 compared with control group. | |||||||||||||||
与对照组比较,药流组患者绒毛膜组织中Ang-1、Ang-2、VEGF和TNF-α表达水平均明显升高(P < 0.05),IL-6表达水平明显降低(P < 0.05)。见图 1(插页三)和表 3。
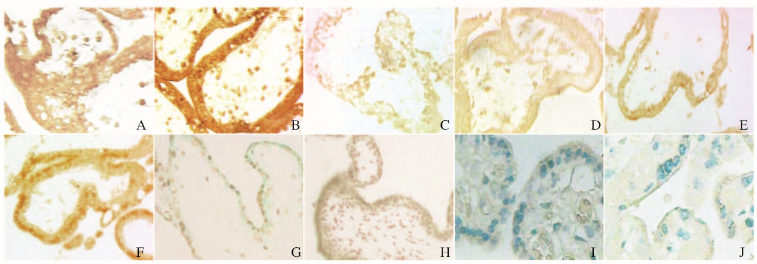
|
| A,B: Ang-1; C,D: Ang-2; E,F: VEGF;G, H:TNF-α; I, J:IL-6;A,C,E, G, I:Control group;B,D,F, H, J:Drug abortion group. 图 1 2组研究对象绒毛组织免疫组织化学染色结果(×400) Figure 1 Results of immunohistochemical staining of villus tissue of subjects in two groups (×400) |
|
|
| (x±s) | ||||||
| Group | n | Ang-1 | Ang-2 | VEGF | TNF-α | IL-6 |
| Control | 51 | 4.25±0.61 | 2.65±0.10 | 5.61±1.61 | 2.88±0.77 | 8.84±1.95 |
| Drug abortion | 68 | 10.59±2.99* | 6.60±1.17* | 11.63±2.07* | 5.35±2.51* | 3.57±0.82* |
| * P < 0.05 compared with control group. | ||||||
Pearson分析结果显示:药流组患者血清中Ang-1水平与VEGF水平呈正相关关系(r=0.849, P=0.012),Ang-2水平与VEGF水平呈正相关关系(r=0.721, P=0.026);药流组患者绒毛组织中Ang-1表达水平与VEGF表达水平呈正相关关系(r=0.590, P=0.019),Ang-2表达水平与VEGF表达水平呈正相关关系(r=0.532, P=0.034)。见表 4。
| Index | VEGF in serum | VEGF in villus tissue | |||
| r | P | r | P | ||
| Ang-1 | 0.849 | 0.012 | 0.590 | 0.019 | |
| Ang-2 | 0.721 | 0.026 | 0.532 | 0.034 | |
胚胎在妊娠过程中的生长发育需要丰富的血液供应所需养分[7]。绒毛膜的绒毛血管生成受到抑制将会导致稽留流产的发生[8-9]。Ang-1、Ang-2和VEGF参与血管形成和发育,在调节血管生成过程中发挥重要作用。VEGF能促进血管内皮细胞分裂,促进新生血管的生成,并维持血管壁的完整性和通透性,在维持血管功能方面具有重要作用[10]。VEGF表达水平的变化影响胎盘血管形成和胚胎生长发育。Ang包括Ang-1、Ang-2、Ang-3和Ang-4,共同调节血管生成及其稳定性[11]。其中Ang-1和Ang-2在怀孕期间的胎盘组织中呈高表达,参与胚胎发育、胎盘血管重建和子宫内膜周期性变化等,对女性孕期正常生殖功能的维持起重要作用[12-14]。正常情况下VEGF和Ang处于平衡状态,VEGF刺激血管内皮细胞增殖,促进血管生成,在血管生成后期,Ang增强新生血管稳定性。此外,在VEGF作用下,Ang-2可拮抗Ang-1促血管结构稳定,消除血管基底膜和管周细胞对血管形成限制,增加内皮细胞对VEGF的敏感性,更有利于血管的出芽和生长[13]。VEGF、Ang-1和Ang-2水平变化会导致血管过度生成或抑制血管系统使血管退化,导致血管新生发生障碍,使胚胎着床失败或妊娠并发症的发生[14]。
TNF-α和IL-6是机体免疫调节的细胞活性因子,TNF-α属于Th1型细胞因子,主要由巨噬细胞产生;IL-6属于Th2型细胞因子,孕期子宫内IL-6主要来源于子宫内膜上皮细胞,能够通过减少机体免疫反应抑制母体排斥,更利于母体维持妊娠[15]。母体正常妊娠机体中Th2型细胞因子水平占优势,稽留流产的发生与Th1/Th2失衡有一定联系[16-18]。本研究结果显示:药流组患者给药后,血清中TNF-α水平明显高于给药前,且绒毛组织中TNF-α表达水平明显高于对照组,与文献[19]结果一致。本文作者认为:米非司酮能促进免疫细胞分泌TNF-α等炎性因子,诱导流产发生,终止稽留流产;药流组患者给药前血清IL-6水平明显低于对照组,可能是由于IL-6水平降低,抑制胚胎绒毛组织血管生成,导致缺氧损伤滋养层细胞和胎儿发育,是引发稽留流产原因之一;药流组患者引产前绒毛组织中Ang-1、Ang-2和VEGF表达水平较对照组明显降低,引产后明显升高,绒毛组织中Ang-1、Ang-2和VEGF表达水平明显高于对照组,患者绒毛组织中Ang-1、Ang-2表达水平和VEGF表达水平呈正相关关系,初步认为VEGF表达水平下降可抑制绒毛组织血管形成,导致供氧不足,Ang-1、Ang-2表达水平降低,最终导致滋养层细胞生长异常,导致稽留流产发生。稽留流产患者服用米非司酮后,Ang-1、Ang-2、VEGF、TNF-α和IL-6水平升高,缓解缺氧,促进绒毛滋养细胞增生,从而达到终止稽留流产的目的[20-21]。
本研究只选用了Th1细胞分泌的TNF-α因子与Th2细胞分泌的IL-6因子作为指标,由于机体免疫过程由多细胞因子参与,因此单一的指标不能准确反映出稽留流产患者治疗过程中总体免疫水平变化,在后续的研究中应增加免疫细胞因子指标,深入探讨Th1/Th2细胞因子与稽留流产的相关性。
| [1] | Wu HL, Marwah S, Wang P, et al. Misoprostol for medical treatment of missed abortion:a systematic review and network meta-analysis[J]. Sci Rep, 2017, 7(1): 1664. DOI:10.1038/s41598-017-01892-0 |
| [2] | 顾华芬, 衣欢, 赵海红, 等. 1945例稽留流产的流行病学及高危因素分析[J]. 生殖与避孕, 2016, 36(3): 195–201. DOI:10.7669/j.issn.0253-357X.2016.03.0195 |
| [3] | Chen ZY, Li J, Huang GY. Effect of Bushen Yiqi Huoxue recipe on placental vasculature in pregnant rats with fetal growth restriction induced by passive smoking[J]. J Huazhong Univ Sci Technol, 2013, 33(2): 293–302. DOI:10.1007/s11596-013-1114-y |
| [4] | Reinsch RC, Murphy AA, Morales AJ, et al. The effects of RU 486 and leuprolide acetate on uterine artery blood flow in the fibroid uterus:a prospective, randomized study[J]. Am J Obstet Gynecol, 1994, 170(6): 1623–1627. DOI:10.1016/S0002-9378(94)70332-9 |
| [5] | 楼湘莹, 王自能, 缪缙, 等. 米非司酮对早孕绒毛滋养细胞Ang-1表达及绒毛间质血管生成的影响[J]. 实用医学杂志, 2008, 24(12): 2044–2045. DOI:10.3969/j.issn.1006-5725.2008.12.013 |
| [6] | 王蓓颖, 李晓翠, 王海云. 复方米非司酮片联合米索前列醇片治疗终止10~16周妊娠及稽留流产的临床研究[J]. 中国临床药理学杂志, 2017, 33(6): 499–501. |
| [7] | 郭丽, 姚水平, 刘爱华, 等. 血管内皮生长因子对异位妊娠早期诊断的意义[J]. 河北医科大学学报, 2013, 34(9): 1071–1073. |
| [8] | 俞玫君, 于春好, 赵慧. 稽留流产患者绒毛组织中血管内皮生长因子及其受体的表达[J]. 中国妇幼保健, 2017, 32(10): 2157–2159. |
| [9] | 梁琳, 胡东辉, 刘黎明, 等. 稽留流产患者血清和绒毛中HIF-1α和VEGF表达水平及其相关性分析[J]. 现代生物医学进展, 2016, 16(16): 3090–3093. |
| [10] | 胡瑞华, 李伟莉. 早期自然流产患者血清VEGF、sFlt-1水平的变化及意义[J]. 中医药临床杂志, 2012, 24(7): 625–626. |
| [11] | 盛静浩, 许正平. 血管生成素研究的希望与挑战-浙江大学血管生成素研究[J]. 中国生物化学与分子生物学报, 2015, 31(12): 1236–1241. |
| [12] | 梁杰, 尹登科, 李白坤, 等. 桃红四物汤对药物致不完全流产早孕大鼠的血管生成及Ang-1, Ang-2, Tie-2表达的影响[J]. 中国中药杂志, 2013, 38(21): 3731–3735. |
| [13] | 陈霞波, 寿旗扬, 龚文波, 等. 四种中药复方对糖尿病肾病大鼠肾脏组织中Ang-1、Ang-2、Tie-2和VEGF mRNA表达影响[J]. 中国中西医结合肾病杂志, 2014, 15(11): 954–956. |
| [14] | Siavashi V, Sariri R, Nassiri SM, et al. Angiogenic activity of endothelial progenitor cells through angiopoietin-1 and angiopoietin-2[J]. Animal Cells Systems, 2016, 20(3): 118–129. DOI:10.1080/19768354.2016.1189961 |
| [15] | 励银智, 宋月轻, 王健. 习惯性流产患者绒毛组织中IL-6的表达及意义[J]. 河北医药, 2011, 33(23): 3604–3605. |
| [16] | 刘佩玲, 赵金霞, 刘湘源. 细胞因子与复发性流产的相关性研究进展[J]. 中国计划生育和妇产科, 2017, 9(10): 16–20. DOI:10.3969/j.issn.1674-4020.2017.10.04 |
| [17] | 曹卫平, 钱秋菊, 樊洁. 早期稽留流产患者免疫机制的研究[J]. 中国妇幼保健, 2008, 23(2): 246–248. |
| [18] | 苏贞文, 姚吉龙, 姜艳华. 维生素D与稽留流产的免疫相关性研究[J]. 中国临床研究, 2015, 28(3): 280–282. |
| [19] | 陈凌燕, 胡丽莎, 陈晓勇, 等. 生化汤加味方在稽留流产药物治疗中增效作用的临床研究及其对血清TNF-α的影响[J]. 中国妇幼保健, 2016, 31(2): 328–330. |
| [20] | Visconti RP, Richardson CD, Sato TN. Orchestration of angiogenesis and arteriovenous contribution by angiopoietins and vascular endothelial growth factor (VEGF)[J]. Proc Natl Acad Sci USA, 2002, 99(12): 8219–8224. DOI:10.1073/pnas.122109599 |
| [21] | 王欢. Ang-1、Ang-2、TSP-1与复发性流产的相关性研究[D]. 太原: 山西医科大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10114-1014324461.htm |
 2018, Vol. 44
2018, Vol. 44


