扩展功能
文章信息
- 谢文杰, 龙海权, 宋代富, 区德锦, 江岚, 陈晞明, 黄炯华
- XIE Wenjie, LONG Haiquan, SONG Daifu, OU Dejin, JIANG Lan, CHEN Ximing, HUANG Jionghua
- 高血压左心室肥厚患者血浆中自噬相关蛋白9a的水平及其临床意义
- Level of autophagy-related protein-9a in plasma of hypertension patients with left ventricular hypertrophy and its clinical significance
- 吉林大学学报(医学版), 2018, 44(04): 786-790
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 786-790
- 10.13481/j.1671-587x.20180417
-
文章历史
- 收稿日期: 2017-11-24
高血压会导致左室压力负荷加重,是心肌肥厚的直接诱因。心肌肥厚持续会进展成为心力衰竭,为此,左心室肥厚(1eft ventricular hypertrophy,LVH)是心脏不良事件的独立危险因素[1]。尽管目前已有的降血压药物,如血管紧张素受体拮抗剂(angiotensin receptor antagonist,ARBs)、血管紧张素转移酶抑制剂(angiotensin converting enzyme inhibition,ACEIs)和β-肾上腺素能受体拮抗剂在降压的同时可有效抑制心肌肥厚的进展[2-4],而且临床证实能使大部分患者获益,但仍有部分患者在血压有效控制的情况下,心肌肥厚并未得到有效控制,不良预后仍存在,其心肌肥厚的机制尚未完全明确。本课题组前期对压力负荷诱导大鼠心肌肥厚的研究[5-6]显示:压力负荷心肌肥厚存在心肌自噬过度激活及自噬相关蛋白9a(autophagy-related protein 9a,ATG9a)异常表达,心肌自噬是心肌肥厚的潜在作用机制。进一步关于干预心肌细胞自噬的实验[5]证实:通过ATG9a调控心肌自噬可以抑制心肌肥厚。由此可见,ATG9a作为自噬调控蛋白在压力负荷心肌肥厚中起重要作用,但ATG9a在高血压心肌肥厚患者血浆中的表达水平以及其对高血压患者LVH的临床预测作用尚不明确。因此,本研究旨在检测高血压LVH患者血浆中ATG9a的水平,研究其与舒张期末室间隔壁厚度(interventricular septum dimension,IVSd)和左心室后壁厚度(left ventricular posterior walldimension,LVPWd)的关系,探讨其对高血压患者LVH的预测价值。
1 资料与方法 1.1 一般资料选择2016年1月—2017年6月在本科住院的128例确诊的高血压患者。高血压诊断标准参照2010年中国高血压防治指南,患者在未使用降压药物的情况下诊室收缩压≥140 mmHg和(或)舒张压≥90mmHg。根据心脏彩色超声结果分为LVH组66例和非LVH组62例。所有纳入患者完善一般临床资料采集,包括年龄、性别、收缩压(SBP)和舒张压(DBP)。由心血管内科专业心脏彩色超声医生采用单盲检查IVSd和舒张末期LVPWd。
1.2 纳入和排除标准LVH患者纳入标准:超声心动图IVSd和(或)LVPWd≥1.1 cm,射血分数(EF)>50%。排除标准:收缩性心力衰竭、N末端脑钠肽前体(NT-proBNP)>400 ng·L-1、帕金森病、特发性肺纤维化、休克、肿瘤、老年人常见的主动脉瓣病变、糖尿病心肌病、继发性淀粉性心肌病、急性期感染、肝硬化等患者及近期应用过干扰素和苯巴比妥者。
1.3 心脏彩色超声检查采用美国GE公司Vivid E9型多功能彩色多普勒超声诊断仪,探头频率2.5~4.0MHz。患者取左侧卧位,常规各个切面扫描检查,取左室长轴切面观察测量IVSd和LVPWd,采用心尖部四腔和两腔心进行双平面法测量左室射血分数(LVEF)。所有患者检查均采用双盲法评价,由经验丰富的主治医师以上职称的超声科医生进行探测。
1.4 酶联免疫吸附测定(ELISA)法检测患者血浆中ATG9a水平收集经临床检测后残余的用EDTA抗凝管采集的患者全血标本3~5mL,室温放置1~2h,1 600 g、4℃离心15 min,获取上层血浆;12 000 g、4℃离心15 min,获取上清-80℃保存。按照购自德国MyBioSource公司的Human Autophagy Ralated Protein 9a试剂盒说明书进行操作,具体操作方法:100μL标准品、待测样品及PBS空白对照样品加入相应的板孔内;50μL酶交联物(enzyme conjugate)加入标准样品及待测样品孔,充分混合,在常温下孵育1h;弃除孵育液,用1×洗涤液浸洗样品孔,连续洗涤5次,充分吸干样品孔内的液体;分别将50μL底物A(substrate A)和底物B(substrate B)加入所用样品孔板(包括标准品、待测样品和PBS空白对照样品),常温孵育15min;所有样品孔均加入50μL终止液,充分混合,采用MK3酶标仪(美国ThermoFisher公司)进行检测。根据标准品,绘制标准曲线,待测样品通过标准曲线计算相关的浓度值。为避免检测的偏倚,所有样品均由熟练掌握ELISA操作的检验技师采用单盲法进行检测。
1.5 统计学分析采用SPSS 18.0统计软件进行统计学分析。所有资料行正态检验,符合正态分布的计量资料(患者年龄、SBP、DBP、IVSd和LVPWd)以x±s表示,2组间比较采用独立样本t检验。计数资料(男性构成比)以百分率(%)表示,2组间比较采用χ2检验。高血压LVH患者血浆中ATG9a水平与IVSd和LVPWd的关系分析采用Pearson线性相关分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组高血压患者一般资料与非-LVH组比较,LVH组患者年龄、SBP、DBP和男性构成比差异均无统计学意义(P>0.05);LVH组患者IVSd和LVPWd均高于非LVH组(P < 0.05)。见表 1。
| Group | n | Age (year) | Male (η/%) | SBP (P/mmHg) | DBP (P/mmHg) | IVSd (l/cm) | LVPWd (l/cm) |
| Non-LVH | 66 | 72.09±7.75 | 53.03 | 144.72±20.74 | 88.53±17.75 | 9.10±0.19 | 8.88±0.18 |
| LVH | 62 | 73.94±9.33 | 54.88 | 148.77±25.10 | 89.95±12.85 | 12.10±0.10* | 11.68±0.96* |
| * P < 0.05 compared with non-LVH group. | |||||||
参照试剂盒操作说明,用标准品浓度梯度及吸光度(A)值描绘标准曲线(图 1),2组患者血浆中ATG9a水平经标准曲线计算获取。与非LVH组[(1.07± 0.03)μg·L-1]比较,LVH组患者血浆中ATG9a水平[(2.21±0.04)μg·L-1]明显升高(P < 0.05)。
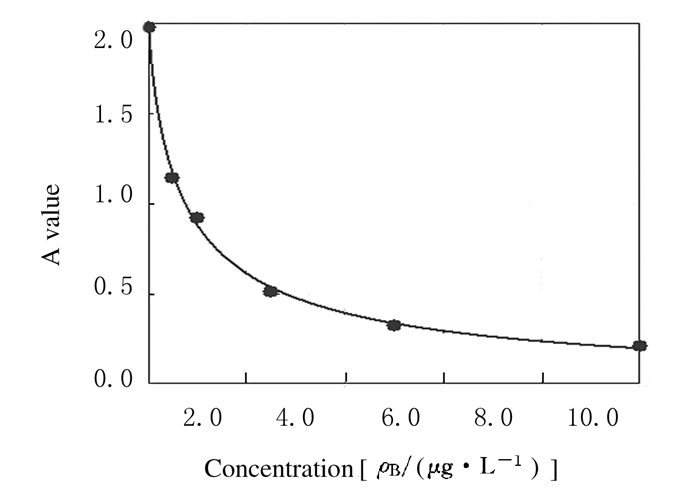
|
| 图 1 ATG9a标准品浓度梯度和A值拟合标准曲线 Figure 1 Standard curve of concentration gradient and A value of ATG9a standard product |
|
|
采用Pearson线性相关分析方法分析高血压LVH患者血浆中ATG9a水平与IVSd和LVPWd的相关性,高血压LVH患者血浆中AT G9a水平与IVSd和LVPWd均呈正相关关系(r=0.774,P < 0.01;r=0.685,P < 0.01)。
2.4 血浆中ATG9a水平诊断高血压LVH的敏感度和特异度分析血浆中ATG9a水平预测高血压患者LVH的敏感度和特异度,受试者工作特征(ROC)曲线下面积(AUC)显示:患者血浆中ATG9a水平AUC为0.976(95%CI:0.923~0.996),见图 2。采用SPSS 18.0统计软件分析其特异性和敏感性,依据ROC曲线,计算出Youden指数,以Youden指数最大的切点(0.876)为最佳临界点,确定血浆中ATG9a水平预测高血压LVH的最佳临界值为1.69μg·L-1,此时的敏感度和特异度分别为96.8%和90.6%。
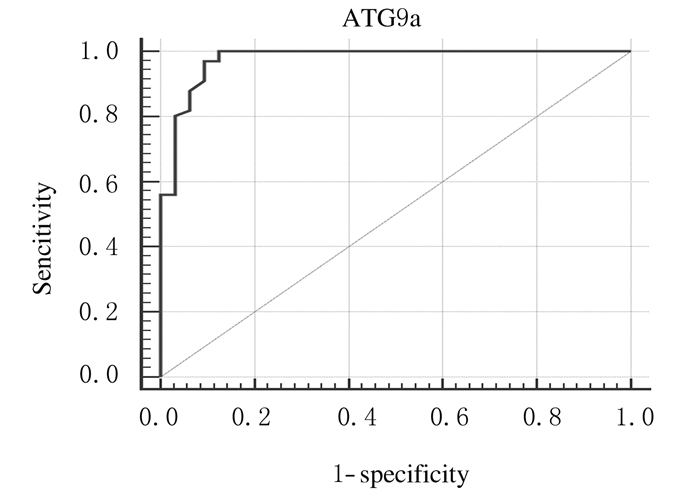
|
| 图 2 血浆中ATG9a水平预测高血压患者LVH的AUC Figure 2 AUC of LVH in hypertension patients predicted with ATG9a levelin plasma |
|
|
近10年来,研究者[7-10]发现:自噬作为真核细胞中通过与溶酶体结合清除体内受损物质的重要途径,参与了各种心血管疾病的病理生理进程,其中包括心肌肥厚、心衰、缺血性心脏病和扩张型心肌病等。体内和体外的实验证据[11]表明:生理水平的自噬是心肌细胞维持体内平衡的重要保证。在压力超负荷诱导的心肌肥厚阶段,心肌自噬激活是一种代偿性反应[12];但在压力超负荷诱导的心衰中,心肌自噬过度激活会导致自噬性心肌细胞死亡[13]。实际上,基础水平的心肌细胞自噬是病理性心肌肥厚的一种适应和自我保护作用,但心肌自噬过度激活,会导致细胞内受损物堆积触发心肌细胞自噬性坏死,进而促进病理性心肌肥厚的进展[14-15]。为此,在心肌肥厚患者血浆中寻找自噬活性变化的分子标志物,对开展调控自噬活性防治心肌肥厚具有重要意义。本课题组前期研究[5-6]显示:在高血压心肌肥厚组织中ATG9a异常表达,且体外诱导其表达变化可调控心肌细胞自噬活性影响心肌细胞肥大。而ATG9a作为哺乳动物体内发现的唯一自噬体膜蛋白,其定位于囊泡/自噬前体膜(phagophore/pre-autophagosomal structure,PAS)中,参与自噬过程和囊泡蛋白的募集[16],是自噬体形成的必需蛋白,诱导ATG9a可调控真核细胞自噬的过程[17]。本课题组前期体外实验[5]证实:调控ATG9a可促进心肌自噬,诱导心肌细胞肥大。本研究拟探讨高血压LVH患者及非LVH患者血浆中ATG9a水平的变化,初步评价其是否具有诊断高血压LVH的临床价值。本研究结果显示:与高血压非LVH组比较,高血压LVH组患者血浆中ATG9a水平升高,提示ATG9a作为心肌自噬调控的重要物质,有望成为临床诊断高血压LVH的潜在标志物。
目前,通过改良传统的方法如心脏磁共振成像(MRI)扫描[18]、心电图(electrocardiogram,ECG)描记[19]和超声心动图(ultrasonic cardiogram,UCG)测量[20]可以很好评价心肌肥厚。然而,上述方法评估LVH各有优劣。MRI可以用来评估LVH,但其费用较高,实用性不强。ECG诊断LVH具有低消耗和实用性强的特点,然而诊断的敏感性较低。UCG诊断LVH的敏感性和精确量化均较ECG好,但UCG测量LVH时与操作者切面的选择有关,主观性较强。目前,诊断和评价高血压患者LVH仍缺乏一种更方便、更精确和客观性更强的生物标志物。本研究结果显示:高血压LVH患者血浆中ATG9a水平与IVSd和LVPWd均呈正相关关系,相关系数分别为0.774和0.685;ROC曲线显示:ATG9a用于诊断高血压LVH的AUC面积为0.976(95%CI:0.923~0.996),提示可采用血浆中ATG9a水平预测高血压患者LVH。为了确定ATG9a预测高血压患者LVH的最佳临界值,本课题组通过计算Youden指数,确定采用ATG9a判断心脏肥厚的最佳临界点为1.69 μg·L-1,此时的敏感度和特异度分别为96.8%和90.6%。由于本研究样本数量的局限性,未能进一步进行Logistic回归分析。虽然,本研究未获取高血压LVH患者的心肌组织,分析ATG9a在患者心肌组织的表达变化,但本课题组前期研究结果显示:高血压大鼠肥厚的心肌组织中ATG9a表达异常升高[6],与高血压LVH患者血浆中ATG9a中水平升高一致。本文作者推测:高血压LVH患者血浆中ATG9a水平升高,可能是压力负荷心肌细胞自噬活性增加进而释放到外周循环血所致。血浆中ATG9a水平在临床上可以通过ELISA法测定,检测费用不高,可操作性强。
综上所述,ATG9a可能作为自噬诱导因子参与心肌肥厚的发生,有望成为预测高血压患者LVH的分子标志物。
| [1] | Okwuosa TM, Soliman EZ, Lopez F, et al. Left ventricular hypertrophy and cardiovascular disease risk prediction and reclassification in blacks and whites:the Atherosclerosis Risk in Communities Study[J]. Am Heart J, 2015, 169(1): 155–161. DOI:10.1016/j.ahj.2014.09.013 |
| [2] | Yang LY, Ge X, Wang YL, et al. Angiotensin receptor blockers reduce left ventricular hypertrophy in dialysis patients:a meta-analysis[J]. Am J Med Sci, 2013, 345(1): 1–9. DOI:10.1097/MAJ.0b013e318249d387 |
| [3] | Verdecchia P, Gentile G, Angeli F, et al. Beyond blood pressure:evidence for cardiovascular, cerebrovascular, and renal protective effects of renin-angiotensin system blockers[J]. Ther Adv Cardiovasc Dis, 2012, 6(2): 81–91. DOI:10.1177/1753944712444866 |
| [4] | Xing F, Chen J, Zhao B, et al. Real role of beta-blockers in regression of left ventricular mass in hypertension patients:Bayesian network meta-analysis[J]. Medicine(Baltimore), 2017, 96(10): e6290. |
| [5] | Huang JH, Sun W, Huang H, et al. miR-34a modulates angiotensin Ⅱ-induced myocardial hypertrophy by direct inhibition of ATG9A expression and autophagic activity[J]. PLoS One, 2014, 9(4): e94382. DOI:10.1371/journal.pone.0094382 |
| [6] | Huang JH, Huang H, Pan W, et al. Renal denervation attenuates cardiac hypertrophy in spontaneously hypertensive rats via regulation of autophagy[J]. Mol Med Rep, 2017, 16(2): 2023–2029. DOI:10.3892/mmr.2017.6790 |
| [7] | Nishida K, Otsu K. Autophagy during cardiac remodeling[J]. J Mol Cell Cardiol, 2016, 95: 11–18. DOI:10.1016/j.yjmcc.2015.12.003 |
| [8] | Schiattarella GG, Hill JA. Therapeutic targeting of autophagy in cardiovascular disease[J]. J Mol Cell Cardiol, 2016, 95: 86–93. DOI:10.1016/j.yjmcc.2015.11.019 |
| [9] | Lin C, Liu Z, Lu Y, et al. Cardioprotective effect of salvianolic acid b on acute myocardial infarction by promoting autophagy and neovascularization and inhibiting apoptosis[J]. J Pharm Pharmacol, 2016, 68(7): 941–952. DOI:10.1111/jphp.12567 |
| [10] | Muhammad E, Levitas A, Singh SR, et al. Plekhm2 mutation leads to abnormal localization of lysosomes, impaired autophagy flux and associates with recessive dilated cardiomyopathy and left ventricular noncompaction[J]. Hum Mol Genetics, 2015, 24(25): 7227–7240. DOI:10.1093/hmg/ddv423 |
| [11] | Mesquita A, Cardenal-Munoz E, Dominguez E, et al. Autophagy in dictyostelium:Mechanisms, regulation and disease in a simple biomedical model[J]. Autophagy, 2017, 13(1): 24–40. DOI:10.1080/15548627.2016.1226737 |
| [12] | Li MH, Zhang YJ, Yu YH, et al. Berberine improves pressure overload-induced cardiac hypertrophy and dysfunction through enhanced autophagy[J]. Eur J Pharmacol, 2014, 728: 67–76. DOI:10.1016/j.ejphar.2014.01.061 |
| [13] | Qin Q, Qu C, Niu T, et al. Nrf2-mediated cardiac maladaptive remodeling and dysfunction in a setting of autophagy insufficiency[J]. Hypertension, 2016, 67(1): 107–117. DOI:10.1161/HYPERTENSIONAHA.115.06062 |
| [14] | Li J, Cai Y. The dual effects of autophagy in myocardial hypertrophy[J]. Acta Cardiol, 2015, 70(4): 493–498. DOI:10.1080/AC.70.4.3096899 |
| [15] | Shimizu I, Minamino T. Physiological and pathological cardiac hypertrophy[J]. Mol Cell Cardiol, 2016, 97: 245–262. DOI:10.1016/j.yjmcc.2016.06.001 |
| [16] | Suzuki SW, Yamamoto H, Oikawa Y, et al. Atg13 HORMA domain recruits Atg9 vesicles during autophagosome formation[J]. Proc Natl Acad Sci USA, 2015, 112(11): 3350–3355. DOI:10.1073/pnas.1421092112 |
| [17] | Kakuta S, Yamaguchi J, Suzuki C, et al. Small gtpase rab1b is associated with atg9a vesicles and regulates autophagosome formation[J]. FASEB J, 2017, 31(9): 3757–3773. DOI:10.1096/fj.201601052R |
| [18] | Haring B, Omidpanah A, Suchy-Dicey AM, et al. Left ventricular mass, brain magnetic resonance imaging, and cognitive performance:Results from the strong heart study[J]. Hypertension, 2017, 70(5): 964–971. DOI:10.1161/HYPERTENSIONAHA.117.09807 |
| [19] | Rider OJ, Ntusi N, Bull SC, et al. Improvements in ECG accuracy for diagnosis of left ventricular hypertrophy in obesity[J]. Heart, 2016, 102(19): 1566–1572. DOI:10.1136/heartjnl-2015-309201 |
| [20] | Lu N, Zhu JX, Yang PX, et al. Models for improved diagnosis of left ventricular hypertrophy based on conventional electrocardiographic criteria[J]. BMC Cardiovasc Disord, 2017, 17(1): 217. DOI:10.1186/s12872-017-0637-8 |
 2018, Vol. 44
2018, Vol. 44


