扩展功能
文章信息
- 安乐, 杨建征, 胡春梅, 于琼, 肖晗, 郝书弘, 唐艳
- AN Le, YANG Jianzheng, HU Chunmei, YU Qiong, XIAO Han, HAO Shuhong, TANG Yan
- 多囊蛋白1基因对人宫颈癌HeLa细胞的抗凋亡作用
- Anti-apoptosis effect of polycystin-1 gene on human cervical cancer HeLa cells
- 吉林大学学报(医学版), 2018, 44(04): 776-779
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 776-779
- 10.13481/j.1671-587x.20180415
-
文章历史
- 收稿日期: 2018-02-12
常染色体显性遗传性多囊肾病(autosomal dominant polycystic kidney disease, ADPKD)是一种常见的单基因遗传病[1-2]。ADPKD主要由PKDl和PKD2基因突变引起, PKD1和PKD2分别编码多囊蛋白1 (polycystin-1,PC1)和多囊蛋白2 (polycystin-1,PC2)。目前研究[3-6]显示:85%~90%的ADPKD与PKD1基因突变有关。
在ADPKD的发病过程中,凋亡信号通路被激活[7-8],细胞凋亡的增加可引起囊泡的发生[9],国内外许多研究把干预囊肿上皮细胞凋亡作为重点,从而达到抑制多囊肾囊肿形成的治疗目的。PC1是一个具有长的细胞外氨基末端、11个跨膜区和短的细胞内羧基末端的跨膜蛋白[10-11]。PC1在MDCK肾细胞中的表达可引起微管的构建并抑制细胞凋亡[12];PC1抗凋亡的机制目前尚不清楚,参与PC1抑制凋亡的信号途径目前已较明确的是磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)等[13-15]。PC1调节蛋白激酶R(PKR)/真核细胞翻译起始因子2α(eIF2α)信号通路及对凋亡影响的研究[15]显示:PC1重组蛋白pEGPF-PC1-5TMC对HEK293T细胞凋亡具有抑制作用。PC1对宫颈癌HeLa细胞是否具有抗凋亡作用目前尚未见报道。本研究选取宫颈癌HeLa细胞作为研究对象,采用MTT法和TUNE法检测PC1对HeLa细胞凋亡的影响, 进一步明确PC1的抗凋亡作用, 为研究PC1在恶性肿瘤细胞中的作用机制提供依据。
1 材料与方法 1.1 细胞、质粒和试剂人宫颈癌HeLa细胞为本实验室保存。在含有10%胎牛血清、100 U·mL-1青霉素及100 mg·L-1链霉素的DMEM高糖培养液中,置于5%CO2、37℃的培养箱中培养。每隔2 ~3 d更换1次培养液,细胞贴壁率达到70% ~80%进行细胞传代。空白对照质粒pEGFP和PC1基因重组质粒pEGFP-PC1-5TMC[15]由陈兴珍博士惠赠。脂质体LipofectamineTM2000购自美国Invitrogen公司,MTT和DMSO购自华美公司,DMEM完全培养基和胎牛血清购自美国HyClone公司,绿色荧光蛋白(GFP)单抗和辣根过氧化物酶标记的羊抗鼠IgG购自鼎国生物公司,化学发光试剂盒购自美国Bio-Rad公司,TUNEL测试剂盒购自美国Promega公司,硝酸纤维膜购自美国Bio-Rad公司。
1.2 转染HeLa细胞以2.0×104 /孔密度接种6孔板, 置于37℃、5% CO2培养箱中培养, 48 h后更换新鲜培养液, 采用脂质体法转染细胞。用无血清DMEM培养液分别稀释质粒pEGFP、pEGFP-PC1-5TMC和LipofectamineTM2000, 室温静置5 min。将2种稀释液轻轻混合, 室温放置20 min。将混合液加至对应的孔板中, 置于37℃、5% CO2条件下培养。6 h后更换成新鲜含10%胎牛血清的DMEM完全培养基继续培养。转染空白对照质粒pEGFP组为空白对照组,转染PC1基因重组质粒pEGFP-PC1-5TMC组为转染组。
1.3 Western blotting法鉴定转染细胞转染后24 h,提取细胞的蛋白, 蛋白浓度按Bradford法选择BSA作为测定标准,并根据标准曲线计算样品中蛋白浓度。80μg蛋白用10%SDS-PAGE分离,转移到硝酸纤维膜上,抗体按照GFP单抗1:2000、辣根过氧化物酶标记的羊抗鼠IgG 1:500使用。按照化学发光试剂盒说明书进行杂交。
1.4 MTT法检测细胞增殖活性细胞增殖实验分为3组。转染组:转染pEGFP-PC1-5TMC质粒组; 空白对照组:转染pEGFP空白对照质粒组; 正常对照组:未转染的HeLa细胞。转染后24 h,将细胞小心收集并接种到96孔培养板中, 每小孔加入200 μL(相当于1×104个细胞)细胞悬液。每板设培养基对照和正常对照,每组设定6复孔。分别在24和48 h(转染后48和72 h)采用MTT法检测细胞吸光度(A)值。将5 g ·L-1 MTT用Dilution Buffer稀释成1 g·L-1,每小孔加入50 μL MTT,在37℃培养箱中孵育4 h; 吸出上清液,每孔加入150 μL DMSO,在平板摇床上摇匀。在酶标仪490 nm波长处检测每孔A值, 细胞增殖活性=测量孔A值-培养基对照孔A值。
1.5 TUNEL法检测细胞凋亡率细胞分别转染pEGFP-PC1-5TMC质粒(转染组)和pEGFP质粒(空白对照组),转染后48 h,将细胞晾干并经2%多聚甲醛室温固定10 min, PBS洗涤2次,室温置于穿透液(含0.05%Triton X-100的PBS)中3 min, 然后按照TUNEL检测试剂盒进行操作,倒置显微镜观察。凋亡细胞计数:每实验组切片数28个,每个切片取8个阳性视野,每个视野计数200个细胞,细胞凋亡率=凋亡细胞数/总细胞数×100%,取平均值。
1.6 统计学分析采用SPSS 16.0统计软件进行统计学分析。细胞增殖活性和细胞凋亡率以x±s表示,2组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 PC1基因重组质粒转染HeLa细胞株的鉴定Western blotting法鉴定PC1基因重组质粒转染HeLa细胞株,采用GFP单抗检测,在相对分子质量约68 000处显示pEGFP-PC1-5TMC蛋白条带。见图 1。
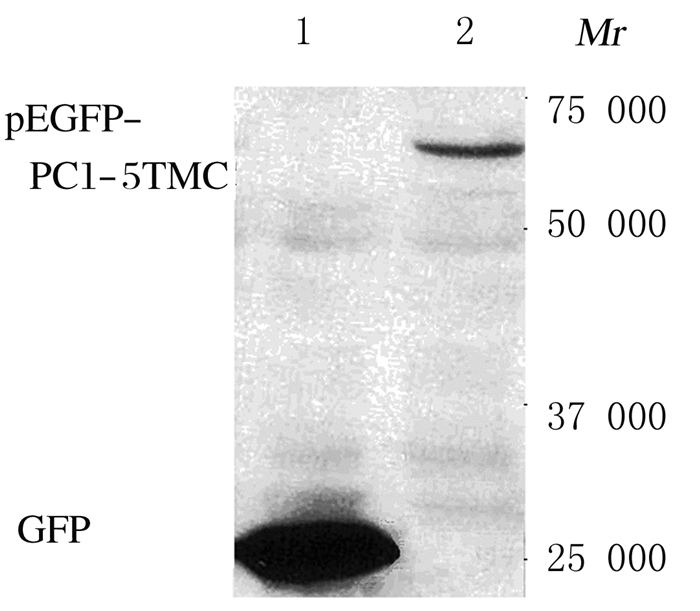
|
| Lane 1: Blank control group; Lane 2: Transfection group. 图 1 Western blotting法鉴定HeLa细胞中pEGFP-PC1-5TMC表达电泳图 Figure 1 Electrophoregram of pEGFP-PC1-5TMC expressions in HeLa cells identified by Western blotting method |
|
|
在转染后48和72h,与正常对照组比较, 转染组细胞增殖活性有所降低,但差异无统计学意义(P>0.05);与空白对照组比较,转染组细胞增殖活性明显升高, 差异有统计学意义(P < 0.05)。见表 1。
| (n=6, x±s) | ||
| Group | A value | |
| (t/h) 48 | 72 | |
| Normal control | 0.762±0.054 | 1.182±0.083 |
| Blank control | 0.629±0.037 | 1.053±0.031 |
| Transfection | 0.727±0.076* | 1.154±0.079* |
| * P < 0.05 compared with blank control group. | ||
TUNEL法结果显示:转染后48 h,转染组和空白对照组均有TUNEL染色阳性细胞,阳性细胞多数皱缩变圆,颗粒感增强,但转染组TUNEL染色阳性细胞数明显少于空白对照组(图 2)。转染组细胞凋亡率(4.2%±1.6%)明显低于空白对照组(7.6%±1.7%)(P < 0.01)。
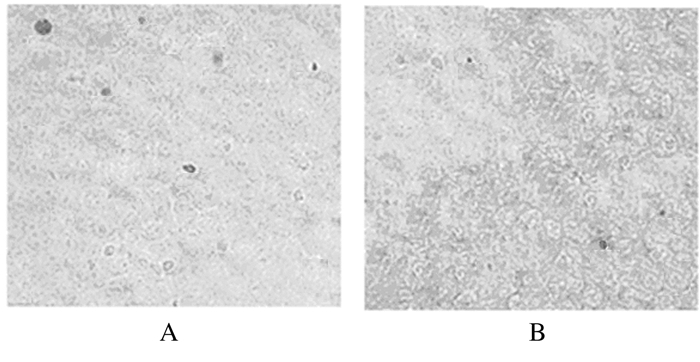
|
| A:Blank control group; B:Transfection group. 图 2 TUNEL法检测各组HeLa细胞凋亡情况(×200) Figure 2 Apoptosis of HeLa cells in various groups detected by TUNEL assay(×200) |
|
|
既往有关PC1抗凋亡作用的研究较少,但已在犬肾上皮MDCK细胞、人肝癌HepG2细胞及人胚肾HEK293T细胞中证实PC1具有抗凋亡作用[13-15]。
MTT法可以灵敏地检测活细胞数,在生物实验中通常用来测定细胞增殖活性。本研究通过检测细胞转染后48和72h时细胞增殖情况,了解PC1对细胞凋亡的作用。本研究结果显示:PC1基因过表达有助于维持细胞增殖,提示PC1对HeLa细胞凋亡具有抑制作用。TUNEL法是目前用来检测细胞凋亡的常用方法之一,其优点是灵敏、可靠,目前有关PC1对细胞抑制凋亡作用的研究多采用TUNEL法[13, 15]。本研究结果显示: PC1明显抑制细胞凋亡率,表明PC1对HeLa细胞具有抗凋亡作用。
PC1和PC2除了在细胞感应信号转导中发挥重要作用外,还参与多种恶性肿瘤的发病[16-19],具有较广阔的研究前景。本研究结果不仅进一步证实了PC1具有抗凋亡作用,还为PC1在肿瘤细胞中的抗凋亡机制研究提供了依据。本研究结果符合既往研究已证实的PC1对MDCK、HepG2和HEK293T细胞有抑制凋亡作用的结论,尤其与PC1对人肝癌HepG2细胞的抗凋亡作用一致,但也有关于PC1能诱导肿瘤细胞HepG2、A549和SW480凋亡的报道[20], 因此,PC1在肿瘤细胞凋亡中的作用机制尚有待更多的研究进一步明确。
| [1] | Kai H, Shinozaki Y, Nishikubo A, et al. Two autosomal dominant polycystic kidney (ADPKD) cases with advanced renal dysfunction, effectively treated with tolvaptan[J]. CEN Case Rep, 2016, 5(1): 87–90. DOI:10.1007/s13730-015-0198-6 |
| [2] | Song X, Haghighi A, Iliuta IA, et al. Molecular diagnosis of autosomal dominant polycystic kidney disease[J]. Expert Rev Mol Diagn, 2017, 17(10): 885–895. DOI:10.1080/14737159.2017.1358088 |
| [3] | 连小英, 白雪源, 张英杰. 多囊肾细胞增殖和凋亡机制及治疗研究进展[J]. 解放军医学杂志, 2016, 41: 949–954. DOI:10.11855/j.issn.0577-7402.2016.11.13 |
| [4] | Kim DY, Park JH. Genetic mechanisms of ADPKD[J]. Adv Exp Med Biol, 2016, 933: 13–22. DOI:10.1007/978-981-10-2041-4 |
| [5] | Xu Y, Li A, Wu G, et al. Perspectives of gene therapies in autosomal dominant polycystic kidney disease[J]. Curr Gene Ther, 2017, 17(1): 43–49. |
| [6] | Potts JW, Mousa SA. Recent advances in management of Autosomal-dominant polycystic kidney disease[J]. Am J Health Syst Pharm, 2017, 74(23): 1959–1968. DOI:10.2146/ajhp160886 |
| [7] | Lemos FO, Ehrlich BE. Polycystin and calcium signaling in cell death and survival[J]. Cell Calcium, 2018, 69: 37–45. DOI:10.1016/j.ceca.2017.05.011 |
| [8] | Mangolini A, de Stephanis L, Aguiari G. Role of calcium in polycystic kidney disease:From signaling to pathology[J]. World J Nephrol, 2016, 5(1): 76–83. DOI:10.5527/wjn.v5.i1.76 |
| [9] | Peintner L, Borner C. Role of apoptosis in the development of autosomal dominant polycystic kidney disease (ADPKD)[J]. Cell Tissue Res, 2017, 369(1): 27–39. DOI:10.1007/s00441-017-2628-6 |
| [10] | Fedeles SV, Gallagher AR, Somlo S. Polycystin-1:a master regulator of intersecting cystic pathways[J]. Trends Mol Med, 2014, 20(5): 251–260. DOI:10.1016/j.molmed.2014.01.004 |
| [11] | Merrick D, Bertuccio CA, Chapin HC, et al. Polycystin-1 cleavage and the regulation of transcriptional pathways[J]. Pediatr Nephrol, 2014, 29(4): 505–511. DOI:10.1007/s00467-013-2548-y |
| [12] | Boletta A, Simons M, Walz L, et al. Polycystin-1, the gene product of PKD1, induces resistance to apoptosis and spontaneous tubulogenesis in MDCK cells[J]. Mol Cell, 2000, 6(5): 1267–1273. DOI:10.1016/S1097-2765(00)00123-4 |
| [13] | Boca M, Boletta P, Simons M, et al. Polycystin-1 induces resistanceto apoptosis through the phosphatidylinositol 3-kinase/Akt signaling pathway[J]. J Am Soc Nephrol, 2006, 17(3): 637–647. DOI:10.1681/ASN.2005050534 |
| [14] | Yu W, Kong T, Beaudry S, et al. Polycystin-1 protein level determines activity of the Galpha12/JNK apoptosis pathway[J]. J Biol Chem, 2010, 285(14): 10243–10251. DOI:10.1074/jbc.M109.070821 |
| [15] | Tang Y, Wang Z, Yang J, et al. Polycystin-1 inhibits eIF2α phosphorylation and cell apoptosis through a PKR-eIF2α pathway[J]. Sci Rep, 2017, 7(1): 11493. DOI:10.1038/s41598-017-11526-0 |
| [16] | Gargalionis AN, Korkolopoulou P, Farmaki E, et al. Polycystin-1 and polycystin-2 are involved in the acquisition of aggressive phenotypes in colorectal cancer[J]. Int J Cancer, 2015, 136(7): 1515–1527. DOI:10.1002/ijc.v136.7 |
| [17] | Ibraghimov-Beskrovnaya O, Natoli TA. mTOR signaling in polycystic kidney disease[J]. Trends Mol Med, 2011, 17(11): 625–633. DOI:10.1016/j.molmed.2011.06.003 |
| [18] | Zhou J. Polycystins and primary cilia:primers for cell cycle progression[J]. Annu Rev Physiol, 2009, 71: 83–113. DOI:10.1146/annurev.physiol.70.113006.100621 |
| [19] | Harris PC, Watson ML. Autosomal dominant polycystic kidney disease:neoplasia in disguise?[J]. Nephrol Dial Transplant, 1997, 12(6): 1089–1090. DOI:10.1093/ndt/12.6.1089 |
| [20] | Zheng R, Zhang Z, Lv X, et al. Polycystin-1 induced apoptosis and cell cycle arrest in G0/G1 phase in cancer cells[J]. Cell Biol Int, 2008, 32(4): 427–435. DOI:10.1016/j.cellbi.2007.12.014 |
 2018, Vol. 44
2018, Vol. 44


