扩展功能
文章信息
- 王海彬, 董志军, 郭立涛, 石晶, 董微丽
- WANG Haibin, DONG Zhijun, GUO Litao, SHI Jing, DONG Weili
- 菩人丹超微粉对STZ诱导糖尿病大鼠视网膜病变的保护作用及其对NF-κB信号通路的影响
- Protective effect of Purendan Superfine Powder on retinopathy of rats with diabetes mellitus induced by streptozotocin and its influence in NF-κB signaling pathway
- 吉林大学学报(医学版), 2018, 44(04): 759-763
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 759-763
- 10.13481/j.1671-587x.20180412
-
文章历史
- 收稿日期: 2017-12-07
糖尿病视网膜病变(diabetic retinopathy, DR)是糖尿病引致视网膜微血管病变和神经组织病变的常见并发症,是导致视力损害的重要原因,近年来DR的发病率呈上升趋势,严重影响患者的生活质量[1]。研究[2-3]表明:血管内皮生长因子(vascular endothelial growth factor,VEGF)和血管生成素2(angiopoietin-2,Ang-2)作为防治DR的重要标志,可反映视网膜组织的损伤程度。另有研究[4-5]表明:晚期糖基化终末产物(advanced glycation end products,AGEs)/晚期糖基化终末产物受体(receptor of advanced glycation end products,RAGE)/核因子κB(nuclear factor-kappa B,NF-κB)信号通路在DR过程中起重要作用。
菩人丹超微粉(Purendan Superfine Powder, 简称PRD)是以苦瓜为君药,以人参和丹参为臣药,加以制首乌、水蛭和葛根配伍组成的中药复方,具有益气养阴清热、活血化瘀通络之功效。研究[6]表明:PRD对病机为“热、虚、瘀”的糖尿病患者有明显疗效。但目前尚无有关PRD对DR影响的相关机制的研究。为进一步探讨PRD对DR的保护作用,本研究主要观察PRD对糖尿病模型大鼠视网膜组织中VEGF和Ang-2蛋白表达的影响,并从AGEs/RAGE/NF-κB信号通路探讨PRD对糖尿病大鼠视网膜微血管损伤的保护作用。
1 材料与方法 1.1 药物、主要试剂和仪器PRD(河北以岭药业集团有限公司),链脲佐菌素(STZ,美国Sigma公司),VEGF和Ang-2引物序列(上海生工生物工程有限公司),兔抗VEGF抗体(美国Cell Signalling公司),Ang-2、AGEs和RAGE抗体(英国Abcam公司),NF-κB P65(美国CST公司),抗兔辣根过氧化物酶(HRP,上海长岛生物技术有限公司)。OneTouch® UltraVue血糖仪(上海强生医疗器材有限公司),电泳仪(西安东澳生物科技有限公司),图像分析软件Quantity One 4.3.1(美国Bio-rad公司)。
1.2 实验动物、分组和给药雄性Wistar大鼠40只,SPF级,体质量200~250 g,购自河北省实验动物中心,动物许可证号: SCXK(冀) 2016-0002。适应性喂养1周,实验室温度22℃~28℃,相对湿度60%~78%。40只大鼠随机分为正常对照组、模型组、低剂量PRD组和高剂量PRD组,每组10只。模型组、低剂量PRD组和高剂量PRD组大鼠禁食12h后,腹腔注射2% STZ(60 mg·kg-1),每天1次,制备糖尿病动物模型。连续注射3d后空腹后取鼠尾血,采用血糖仪测定血糖,以血糖水平≥16.7 mmol·L-1为糖尿病大鼠模型建立成功的标准[7-8]。待模型成功建立后,低剂量和高剂量PRD组大鼠分别灌胃给予1.2和2.4 g·kg-1 PRD,大鼠给药剂量根据成人给药剂量按体表面积换算,大鼠每日等效剂量(g·kg-1)=6.3×成人每日剂量(g·kg-1),自造模成功起连续给药3个月。正常对照组、模型组大鼠分别灌胃给予等体积生理盐水。实验期间大鼠自由进水和进食,不使用胰岛素及其他降糖药物。
1.3 标本收集大鼠禁食12 h后,腹腔注射1%戊巴比妥钠(40 mg·kg-1)麻醉,打开腹腔,腹主动脉置管,取血测定血糖,用生理盐水灌洗至眼球苍白,迅速摘除双眼眼球,去除眼前节及玻璃体,于显微镜下钝性分离视网膜组织,置于-80℃下储存,用于实时定量逆转录-多聚酶链反应(RT-PCR)和Western blotting法检测。
1.4 RT-PCR法检测大鼠视网膜组织中VEGF和Ang-2 mRNA表达水平提取视网膜组织总RNA,按照Thermo公司逆转录试剂盒的方法转录成cDNA,以此为模板进行半定量PCR检测,以β-actin基因的表达作为内参照。目的基因VEGF和Ang-2引物序列见表 1。反应条件:95℃预变性5 min,95℃变性30 s,58℃退火30 s,72℃延伸45 s,循环35次;72℃延伸10 min。PCR结束后以1.5%琼脂糖凝胶电泳检测扩增目的基因cDNA片段的质量,凝胶成像系统分析,以PCR产物的DNA扩增条带的灰度值和内参物扩增条带灰度值的比值作为VEGF和Ang-2 mRNA表达水平。
| Target gene | Primer sequence(5′-3′) | Length of amplification (bp) |
| VEGF | 5′-GCGGGCTGCTGCAATG-3′ 5′-TGCAACGCGAGTCTGTGTTT-3′ |
237 |
| Ang-2 | 5′-TGCAGCTACACTTTCCTC-3′ 5′-TCTATCATCAGCCGTC-3′ |
166 |
| β-actin | 5′-GCACCGCAAATGCTTCTA-3′ 5′-GGTCTTTACGGATGTCAACG-3′ |
225 |
取液氮中保存的视网膜组织,加入PBS(0.01 mmol·L-1,pH7.4)1 mL于匀浆器中冰浴下匀浆,4℃、6 000 r·min-1离心30 min,弃上清,向沉淀物中加入200 μL全细胞裂解液冰浴裂解40 min,4℃、12 000 r·min-1高速离心15 min,收集上清液,按照试剂盒方法对蛋白浓度进行定量,蛋白上样量为50 μg,12% SDS-PAGE凝胶电泳,80~120 V、2 h,电泳完毕后转移至PVDF膜(孔径0.45 μm,美国Pall公司)上;5%脱脂奶粉TBST封闭2 h;加入AGEs(1:1000)、RAGE(1:1000)、NF-κB (1:1000)、VEGF(1:200)和Ang-2(1:200)抗体,PVDF膜用0.5% TBS-T溶液洗膜3次,每次5 min,用二抗辣根过氧化物酶(HRP, 1:5000)交联物室温摇床孵育1 h,0.5% TBS-T溶液洗膜3次后,显影,对显影条带进行灰度分析,以GAPDH作为内参,计算AGEs、RAGE、NF-κB、VEGF和Ang-2条带与GAPDH条带的灰度值比值,代表目的蛋白的表达水平。
1.6 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组大鼠体质量、血糖水平及大鼠视网膜组织中VEGF、Ang-2 mRNA表达水平和AGEs、RAGE、NF-κB、VEGF、Ang-2蛋白表达水平均以x±s表示,组间比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组大鼠血糖水平各组大鼠注射STZ造模24 h后出现多食、多饮和多尿表现,48 h后出现体质量下降和行动迟缓。与正常对照组比较,模型组大鼠体质量明显降低(P < 0.05),血糖水平明显升高(P < 0.05);与模型组比较,低和高剂量PRD组大鼠体质量明显升高(P < 0.05),血糖水平明显降低(P < 0.05);与治疗前比较,治疗后低和高剂量PRD组大鼠血糖水平明显降低(P < 0.05),高剂量PRD组较低剂量PRD组降糖效果更佳。见表 2。
| (n=10, x±s) | |||||
| Group | Body weight(m/mg) | Blood glucose[cB/(mmol·L-1)] | |||
| Before treatment | After treatment | Before treatment | After treatment | ||
| Normal control | 224.05±11.55 | 285.94±12.34 | 6.10±4.56 | 6.67±2.83 | |
| Model | 201.41±9.36* | 206.31±24.61* | 21.74±1.93* | 23.74±5.30* | |
| PRD | |||||
| Low dose | 204.31±8.04* | 253.83±11.29△ | 20.88±2.37* | 15.03±2.73△# | |
| High dose | 203.53±10.34* | 275.55±15.36△ | 21.56±2.53* | 14.64±2.69△# | |
| * P < 0.05 compared with normal control group; △ P < 0.05 compared with model group; # P < 0.05 compared with before treatment. | |||||
与正常对照组比较,模型组大鼠视网膜组织中VEGF和Ang-2 mRNA表达水平明显升高(P < 0.05);与模型组比较,低和高剂量PRD组大鼠视网膜组织中VEGF和Ang-2 mRNA表达水平明显降低(P < 0.05),高剂量PRD组较低剂量组降低更明显。见图 1和表 3。

|
| Lane 1: Normal control group; Lane 2: Model group; Lane 3:Low dose of PRD group; Lane 4:High dose of PRD group. 图 1 RT-PCR法检测各组大鼠视网膜组织中VEGF和Ang-2 mRNA表达电泳图 Figure 1 Electrophoregram of expressions of VEGF and Ang-2 mRNA in retinal tissue of rats in various groups detected by Western blotting method |
|
|
| (n=10, x±s) | ||
| Group | VEGF mRNA | Ang-2 mRNA |
| Normal control | 0.73±0.02 | 0.68±0.04 |
| Model | 1.18±0.03* | 1.14±0.07* |
| PRD | ||
| Low dose | 1.08±0.01△ | 0.95±0.05△ |
| High dose | 0.90±0.02△ | 0.75±0.04△ |
| * P < 0.05 compared with normal control group; △ P < 0.05 compared with model group. | ||
与正常对照组比较,模型组大鼠视网膜组织中AGEs、RAGE、NF-κB、VEGF和Ang-2蛋白表达水平明显升高(P < 0.05);与模型组比较,低剂量和高剂量PRD组大鼠视网膜AGEs、RAGE、NF-κB、VEGF和Ang-2蛋白表达水平明显降低(P < 0.05),高剂量PRD组较低剂量PRD组降低更明显。见图 2和表 4。
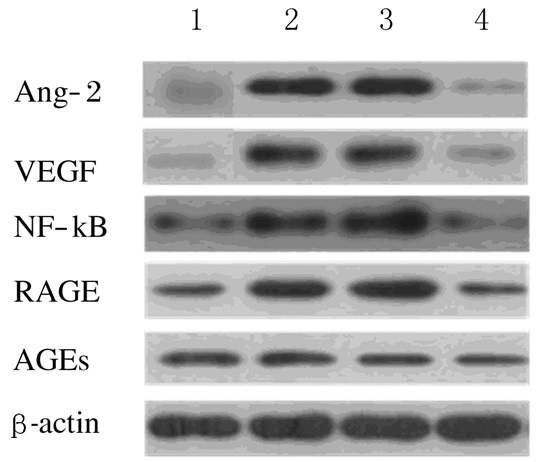
|
| Lane 1: Normal control group; Lane 2: Model group; Lane 3:Low dose of PRD group; Lane 4:High dose of PRD group. 图 2 Western blotting法检测各组大鼠视网膜组织中AGEs、RAGE、NF-κB、VEGF和Ang-2蛋白表达电泳图 Figure 2 Electrophoregram of expressions of AGEs, RAGE, NF-κB, VEGF, and Ang-2 proteins in retina tissue of rats in various groups detected by Western blotting method |
|
|
| (n=10, x±s) | |||||
| Groups | AGEs | RAGE | NF-кB | VEGF | Ang-2 |
| Normal control | 0.29±0.02 | 0.33±0.01 | 0.45±0.04 | 0.48±0.03 | 0.42±0.03 |
| Model | 0.46±0.04* | 0.59±0.01* | 0.91±0.04* | 1.01±0.04* | 0.95±0.04* |
| PRD | |||||
| Low dose | 0.38±0.02△ | 0.43±0.04△ | 0.74±0.03△ | 0.70±0.01△ | 0.76±0.02△ |
| High dose | 0.33±0.01△ | 0.36±0.01△ | 0.64±0.01△ | 0.58±0.02△ | 0.63±0.02△ |
| * P < 0.05 compared with normal control group; △ P < 0.05 compared with model group. | |||||
糖尿病归属为中医“消渴”,病机特点为“阴虚为本,燥热为标;气阴两伤,阴阳俱虚;变证百出,常夹血瘀”,其中“热”“虚”“瘀”为发病的关键[9-10]。中药治疗主要遵循“清热”“补虚”“祛瘀”疗法。PRD由苦瓜、人参、丹参、首乌、水蛭和葛根配伍组成,方中人参、首乌补气养血,丹参、水蛭活血化瘀,苦瓜、葛根清热凉血兼明目,各中药配伍使用,达到清热和营、祛瘀通络的目的。
DR损伤的特征包括内皮细胞功能障碍、血视网膜屏障、视网膜血流量变化、局部缺血和新血管化[11-12]。研究[13]显示:DR的损伤程度与VEGF和Ang-2有密切关联。VEGF是一种血管生成因子和促炎症因子,对视网膜组织血管生成和水肿的发生有明显影响[14]。Ang-2作为一种促血管生成素,与VEGF具有协同作用,可增加视网膜血管通透性,导致视网膜血管内皮细胞功能障碍和慢性炎症的发生[15-16]。本研究结果显示:模型组大鼠视网膜组织中VEGF和Ang-2mRNA及蛋白表达水平均明显升高,说明模型建立成功;用药后PRD组大鼠血糖水平明显降低,同时VEGF和Ang-2mRNA及蛋白表达水平降低,且高剂量PRD组大鼠降低更明显,表明PRD对大鼠DR具有显著疗效。
DR过程中,视网膜组织可产生AGEs,AGEs通过增加血管内皮通透性,促进细胞因子释放和活化蛋白激酶,引起炎症反应,导致视网膜组织病变[17]。NF-κB是一种广泛存在于体内多种细胞的核转录因子,调节多种细胞因子的合成与释放,在机体的免疫和炎症反应、凋亡调控等方面发挥重要作用[18]。AGEs特异性受体RAGE属于免疫球蛋白超家族的细胞表面分子,可结合并降解AGEs。研究[19]证明:发生糖尿病和氧化应激时,RAGE表达可明显升高。AGEs通过与RAGE结合激活NF-κB,同时NF-κB作为RAGE的启动子促进AGEs与RAGE进一步结合,产生正反馈作用[20]。本研究结果显示:PRD可明显降低糖尿病大鼠视网膜组织中AGEs、RAGE和NF-κB蛋白表达水平,表明PRD可降低AGEs的产生,抑制AGEs与RAGE结合,减少NF-κB的分泌,特异性阻断AGEs/RAGE/NF-κB信号通路。
综上所述,PRD对糖尿病大鼠视网膜具有保护作用,下调糖尿病大鼠视网膜组织中VEGF和Ang-2 mRNA及蛋白表达水平,特异性阻断AGEs/RAGE/NF-κB信号通路,减少视网膜微血管渗漏及病理性新生血管生成,减少AGEs形成,减轻炎症反应,是其发挥保护作用的机制之一。
| [1] | 张凤俊, 易敬林, 李晶明, 等. 糖尿病视网膜病变发病机制研究进展[J]. 眼科新进展, 2016, 36(6): 584–587. |
| [2] | 王云枫, 连续, 郭常秀, 等. 糖尿病视网膜病变患者血清血管内皮生长因子及其受体2和血小板反应性蛋白-1的表达[J]. 中国老年学杂志, 2017, 37(7): 1651–1652. |
| [3] | 王兴木, 尤巧英. Ang-2/Tie、VEGF与2型糖尿病视网膜病变关系的研究[J]. 中华全科医学, 2014, 12(9): 1391–1393. |
| [4] | Tzeng TF, Liou SS, Tzeng YC, et al. Zerumbone, a phytochemical of subtropical ginger, protects against hyperglycemia-induced retinal damage in experimental diabetic rats[J]. Nutrients, 2016, 8(8): 449–511. DOI:10.3390/nu8080449 |
| [5] | Hou J, Zheng D, Fung G, et al. Mangiferin suppressed advanced glycation end products (AGEs) through NF-κB deactivation and displayed anti-inflammatory effects in streptozotocin and high fat diet-diabetic cardiomyopathy rats[J]. Can J Physiol Pharmacol, 2016, 94(3): 332–340. DOI:10.1139/cjpp-2015-0073 |
| [6] | 宋新龙, 陈书, 苏冷高娃, 等. 菩人丹对2型糖尿病胰腺微循环损伤大鼠VEGF及其受体VEGFR2/p-VEGFR2和Angiostatin、Endostatin的影响[J]. 世界中西医结合杂志, 2015, 10(5): 627–631. |
| [7] | 陆美萍, 辛传伟, 杨明华, 等. 消渴平合剂对链脲佐菌素诱导的糖尿病肾病大鼠肾功能及miR-192的影响研究[J]. 中华中医药学刊, 2017, 35(5): 1285–1287. |
| [8] | 惠晓丹. 栝楼瞿麦汤干预糖尿病肾病大鼠炎症信号通路机制研究[D]. 扬州: 扬州大学, 2017. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3274545 |
| [9] | 周俊英. 消渴病人的辨证施护[J]. 中国中医药现代远程教育, 2013, 11(22): 136–137. DOI:10.3969/j.issn.1672-2779.2013.22.103 |
| [10] | 熊微, 程绍民, 冯金晨, 等. 糖尿病常见慢性并发症中医治疗进展[J]. 江西中医药, 2017, 48(12): 73–74. |
| [11] | Maleškic S, Kusturica J, Gušic E, et al. Metformin use associated with protective effects for ocular complications in patients with type 2 diabetes-observational study[J]. Acta Med Acad, 2017, 46(2): 116–123. |
| [12] | Nentwich MM, Ulbig MW. Diabetic retinopathy-ocular complications of diabetes mellitus[J]. World J Diabetes, 2015, 6(3): 489–499. DOI:10.4239/wjd.v6.i3.489 |
| [13] | Semeraro F, Cancarini A, Dell'Omo R, et al. Diabetic retinopathy:Vascular and inflammatory disease[J]. Diabet Res, 2015, 2015: 1–16. |
| [14] | Grzelka A, Naskręt D, Araszkiewicz A, et al. Higher concentrations of osteoprotegerin in type 1 diabetic patients are related to retinopathy:Results from the poznań prospective study[J]. Adv Clin Exp Med, 2017, 26(9): 1343–1349. DOI:10.17219/acem/65072 |
| [15] | Zhuge FY, You QY, Zhu QQ, et al. Association of angiopoietin-2 and hypersensitive C-reaction protein with diabetic retinopathy in patients with type 2 diabetes mellitus[J]. Chin J Prevent Control Chron Dis, 2015(8): 232–234. |
| [16] | Pan CW, Wang S, Qian DJ, et al. Prevalence, awareness, and risk factors of diabetic retinopathy among adults with known type 2 diabetes mellitus in an urban community in China[J]. Ophthalmic Epidemiol, 2017, 24(3): 188–194. DOI:10.1080/09286586.2016.1264612 |
| [17] | 岳嵩, 胡悦东, 王馨鹤, 等. 线粒体功能障碍及氧化应激与糖尿病视网膜病变关系的研究[J]. 国际眼科杂志, 2014, 14(12): 2176–2178. DOI:10.3980/j.issn.1672-5123.2014.12.18 |
| [18] | Suchal K, Malik S, Khan SI, et al. Protective effect of mangiferin on myocardial ischemia-reperfusion injury in streptozotocin-induced diabetic rats:role of AGE-RAGE/MAPK pathways[J]. Sci Rep, 2017, 7: 42027. DOI:10.1038/srep42027 |
| [19] | Chen M. Role of the receptor for advanced glycation endproducts (RAGE) in retinal vasodegeneration in diabetic retinopathy[J]. Diabetologia, 2015, 58(5): 1129–1137. DOI:10.1007/s00125-015-3523-x |
| [20] | 王爽, 宋子宣. NF-κB对糖尿病视网膜病变的影响[J]. 国际医药卫生导报, 2015, 21(1): 43–45. |
 2018, Vol. 44
2018, Vol. 44


