扩展功能
文章信息
- 王淼, 母润红, 李明成, 李洪杰
- WANG Miao, MU Runhong, LI Mingcheng, LI Hong Jie
- RNAi沉默survivin和HIF-1α基因对胃癌BGC-823细胞体外增殖和凋亡的影响
- Effects of silencing survivin and HIF-1α genes with RNAi on proliferation and apoptosis of human gastric cancer BGC-823 cells
- 吉林大学学报(医学版), 2018, 44(04): 753-758
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 753-758
- 10.13481/j.1671-587x.20180411
-
文章历史
- 收稿日期: 2017-11-19
2. 北华大学基础医学院免疫教研室, 吉林 吉林 132013
2. Department of Immunology, School of Basic Medical Sciences, Beihua University, Jilin 132013, China
胃癌是全球最常见的恶性肿瘤之一,严重威胁人类健康。中国是胃癌高发国家,胃癌发病率和死亡率均高于全球平均水平,在全球居第4位。目前,胃癌可通过放化疗等多种方式治疗,但缺少对早期胃癌的筛查及诊断,大多数胃癌患者确诊时己进入进展期,导致术后出现复发或丧失了手术的最佳机会[1-2]。随着分子生物学技术的发展,从分子水平研究胃癌的发病原因,寻找胃癌进展的基因将对胃癌的综合治疗有重要的意义[3-4]。肿瘤的发生发展并非单基因和单因素过程,而是多基因和多因素的复杂过程,抑制其基因的表达,可控制肿瘤的发生[4]。RNA干扰(RNAinterference, RNAi)是进行靶基因表达抑制的核酸操作技术,现已成为研究肿瘤基因治疗的有效工具[5-6]。survivin基因是凋亡抑制蛋白(inhibitors of apoptosisprotein, IAP)家族新成员之一,由于其仅在肿瘤和胚胎细胞中特异表达,因而成为肿瘤基因治疗的特异性靶点。国内外研究[7-8]表明:靶向沉默survivin基因的表达能抑制多种肿瘤细胞增殖并促进其凋亡。缺氧诱导因子1α(hypoxia inducible factor1α, HIF-1α)是普遍存在于实体瘤组织中, 抑制其表达对抑制肿瘤的发生发展也可能有重要的临床指导意义[9]。本研究采用RNAi技术沉默胃癌BGC-823细胞中survivin和HIF-1α双基因的表达,观察其对胃癌细胞增殖和凋亡的影响,为胃癌早期诊断和治疗提供新思路。
1 材料与方法 1.1 细胞、试剂和主要仪器人胃癌BGC-823细胞(北华大学药学院药理实验室保存),DMEM培养液和胎牛血清(杭州四季青生物工程材料有限公司),真核转染试剂HifectinⅡ(北京普利莱基因技术有限公司),TRIzol试剂和AnnexinⅤ/PI双染试剂盒(美国Invitrogen公司),逆转录聚合酶链反应(RT-PCR)试剂盒(日本TaKaRa公司),RIPA裂解液、兔抗人survivin和HIF-1α多克隆抗体及BCA蛋白浓度测定试剂盒(武汉博士德公司),台盼蓝(美国Sigma公司),辣根过氧化物酶标记的山羊抗兔IgG抗体(北京中杉金桥生物技术有限公司)。
1.2 小干扰RNA(siRNA)设计策略根据siRNA设计原则,从GenBank数据库选择survivin和HIF-1α的mRNA序列(NM_001168.2;NM_001012270.1;NM_001012271.1;XR_243654.2)基因信息,确定符合siRNA特征的靶序列,分别命名为siRNA-survivin和siRNA-HIF-1α,同时合成错义RNA(scramble RNA, SCR)作为阴性对照(表 1)。此外,设计荧光标记的无靶向siRNA(FAM-siRNA)用于测定siRNA的细胞转染效率。siRNA合成和构建由上海吉玛生物技术制药公司完成。
| Name | Strand | Sequence(5′-3′) |
| siRNA-survivin | Sense strand | GGCUGGCUUCAUCCACUGC-dTdT |
| Antisense strand | GCAGUGGAUGAAGCCAGCC-dTdT | |
| siRNA-HIF-1α | Sense strand | GCAAGACGUUGUUUGAAAU-dTdT |
| Antisense strand | AUUUCAAACAACGUCUUGC-dTdT | |
| SCR | Sense strand | UUCUCCGAACGUGUCACGUTT |
| Antisense strand | ACGUGACACGUUCGGAGAATT |
人胃癌BGC-823细胞用含10%胎牛血清的高糖DMEM培养基,置于37℃、5% CO2、饱和湿度的恒温培养箱中培养。每48h传代1次,取生长状态良好的BGC-823细胞,以每孔1.2×105个细胞接种于6孔培养板中,24h后待细胞铺满每孔约80%,将培养液换为无血清培养基,细胞转染整个步骤完全按照HifectinⅡ真核转染试剂提供的说明书操作。转染siRNA-survivin、siRNA-HIF-1α和SCR的各组细胞分别命名为sis组、siH组和非靶向特异性组(SCR组),同时设空白对照组(无血清培养基)。转染效率=荧光阳性细胞数/筛选细胞总数×100%。
1.4 RT-PCR法检测细胞中survivin和HIF-1α mRNA表达水平用TRIzol试剂提取sis组、siH组、SCR组和空白对照组BGC-823细胞的总RNA, 经紫外分光仪测定RNA的浓度及纯度。凝胶电泳观察RNA的完整性。应用RT-PCR试剂盒逆转录为cDNA,以cDNA为模版,进行RCR扩增,检测各组细胞中survivin和HIF-1α mRNA表达情况。PCR产物经1.5%琼脂糖凝胶电泳后,在紫外成像仪中应用Tanon2500 Gel Imaging system软件获取图像,以GADPH作为内参,根据2-△△Ct法计算mRNA表达水平,每组实验重复3次,取平均值。
1.5 MTT法检测细胞增殖活性取对数生长期BGC-823细胞接种于96孔板中,接种细胞数每孔3×103个,体积100 μL,每组设6复孔,终浓度均为100nmol·L-1。实验分为单干扰组(survivin-siRNA, sis组)、联合干扰组(survivin-siRNA+HIF1α-siRNA, sis+siH组)、非靶向特异性组(SCR组)和空白对照组(无血清培养基)。转染24、48和72 h,终止培养,各孔加入5 g·L-1 MTT 20 μL,继续孵育4 h,弃去上清,各孔加入DMSO 100 μL,继续振摇10 min,充分溶解结晶,于酶标仪上490 nm处测定吸光度[A(490)]值,以A(490)值代表细胞增殖活性。
1.6 Western blotting法检测细胞中survivin和HIF-1α蛋白表达水平分组方法同1.5。转染后48h,用试剂盒提取各组BGC-823细胞总蛋白。采用BCA法检测总蛋白浓度。采用SDS-PAGE电泳分离。一抗为兔抗人survivin单克隆抗体(稀释浓度1:200)、HIF-1α单克隆抗体(稀释浓度1:300)和GADPH单克隆抗体(稀释浓度1:500),4℃过夜。再次用PBST洗膜,加入已稀释的山羊抗兔二抗-HPR(稀释浓度1:2000),置于室温摇床孵育1h。ECL显影。以各实验组灰度值与对照组灰度值之比表示蛋白相对表达水平。
1.7 流式细胞术检测细胞凋亡率分组方法同1.5。转染24h后细胞用胰酶消化,PBS洗涤2次,制备成细胞悬液,加入5 μLAnnexin Ⅴ-FITC和5 μLPI染液,避光室温孵育10 min,采用流式细胞术检测细胞凋亡情况,结果应用WinMDI 2.9分析软件进行分析。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.8 统计学分析采用SPSS17.0统计软件进行统计学分析。各组细胞中细胞增殖活性、survivin和HIF-1α mRNA及蛋白表达水平均以x±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 siRNA转染胃癌BGC-823细胞效率的鉴定siRNA成功转染BGC-823细胞6h后,PBS洗涤3~4次,在激光共聚焦显微镜下观察各组细胞siRNA转染效率。siRNA主要集中在细胞质中,转染成功的细胞有清晰的细胞轮廓,与背景形成明显的反差(图 1,见插页三)。荧光标记siRNA转染细胞效率大于70%, 可以完成后续实验。
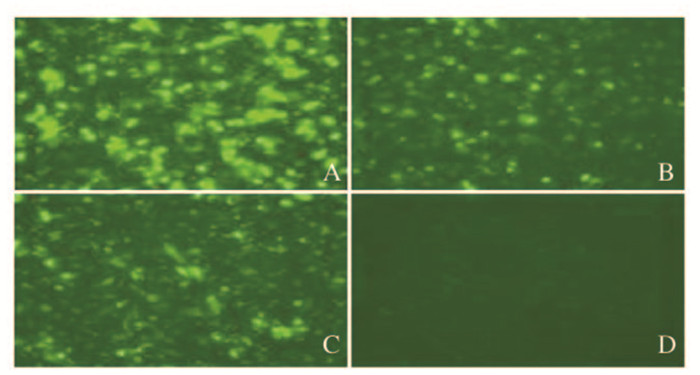
|
| A: Sis group; B: SiH group; C: SCR group D: Blank control group. 图 1 荧光标记siRNA转染BGC-823细胞6 h后荧光表达(×200) Figure 1 Expressions of fluorescence in BGC-823 cells 6 h after transfection with siRNA (× 200) |
|
|
转染48 h后各组细胞均有亮度相似的GADPH基因条带表达,各组survivin/GADPH比值代表survivin基因的mRNA表达水平(图 2),HIF-1α/GADPH比值代表HIF-1α基因的mRNA表达水平(图 3)。与SCR组和空白对照组比较,sis组细胞中survivin mRNA表达水平和siH组细胞中HIF-1αmRNA表达水平明显降低(P<0.05或P<0.01);SCR组与空白对照组比较差异无统计学意义(P>0.05)。见表 2和3。
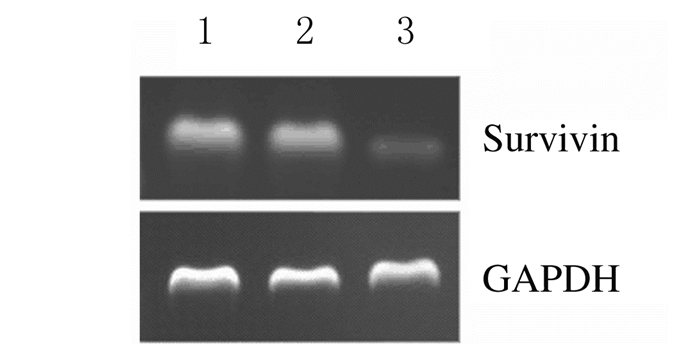
|
| Lane 1: Blank control group; Lane 2:SCR group; Lane 3:Sis group. 图 2 转染48 h后各组细胞中survivin mRNA表达电泳图 Figure 2 Electropheregram of expressions of survivin mRNA in cells in various groups 48 h after transfection |
|
|
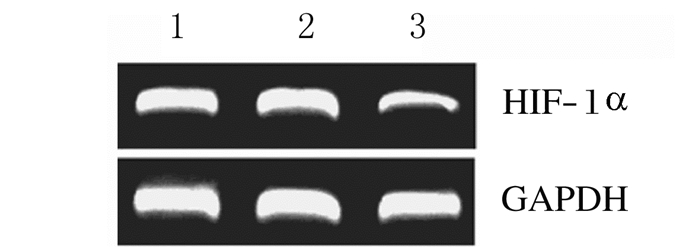
|
| Lane 1:Blank control group; Lane 2: SCR group; Lane 3:SiH group. 图 3 转染48 h后各组细胞中HIF-1α mRNA表达电泳图 Figure 3 Expression levels of HIF-1α mRNA in cells in various groups 48 h after transfection |
|
|
| (n=3, x±s) | |
| Group | Survivin mRNA |
| Blank control | 0.927 0±0.021 7 |
| SCR | 0.947 5±0.032 6 |
| Sis | 0.457 3±0.021 4*△ |
| *P < 0.01 compared with blank control group;△P < 0.01 compared with SCR group. | |
| (n=3, x±s) | |
| Group | HIF-1α mRNA |
| Blank control | 0.826 3±0.032 6 |
| SCR | 0.832 4±0.012 7 |
| SiH | 0.351 6±0.011 6*△ |
| *P < 0.05 compared with blank control group;△P < 0.05 compared with SCR group. | |
与空白对照组比较, SCR组细胞增殖活性无明显变化(P>0.05), sis组和sis+siH组细胞增殖活性明显降低(P<0.05),生长曲线低平,且sis+siH组细胞增殖活性明显低于sis组(P<0.05)。见图 4和表 4。
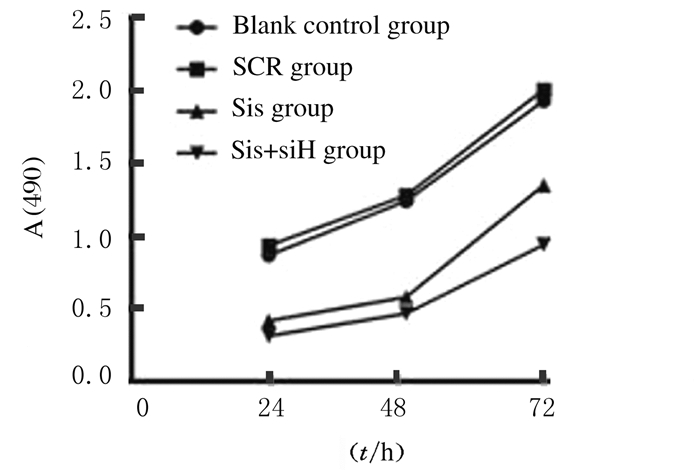
|
| 图 4 转染不同时间各组BGC-823细胞增殖活性 Figure 4 Proliferation activities of BGC-823 cells in various groups at different time after transfection |
|
|
| (n=4, x±s) | |||
| Group | A(490) | ||
| (t/h) 24 | 48 | 72 | |
| Blank control | 0.867 6±0.041 4 | 1.241 0±0.084 1 | 1.928 0±0.077 9 |
| SCR | 0.934 1±0.052 5 | 1.278 0±0.069 0 | 2.004 0±0.095 0 |
| Sis | 0.418 2±0.044 3* | 0.579 0±0.034 0* | 1.349 0±0.156 5* |
| Sis+siH | 0.313 7±0.032 2*△ | 0.467 5±0.055 1*△ | 0.941 0±0.096 1*△ |
| *P < 0.05 compared with blank control group;△P < 0.05 compared with sis group. | |||
与空白对照组比较,sis组surviving蛋白表达水平、sis+siH组surviving和HIF-1α蛋白表达水平明显降低(P<0.05);SCR组与空白对照组比较差异无统计学意义(P>0.05)。见图 5和表 5。

|
| Lane 1: Blank control group; Lane 2:SCR group; Lane 3:Sis group; Lane 4:Sis+siH group. 图 5 各组细胞中survivin和HIF-1α蛋白表达电泳图 Figure 5 Electrophoregram of expressions of survivin and HIF-1α proteins in cells in various groups |
|
|
| (n=4, x±s) | ||
| Group | Survivin protein | HIF-1α protein |
| Blank control | 0.67±0.03 | 0.73±0.01 |
| SCR | 0.68±0.03 | 0.73±0.01 |
| Sis | 0.20±0.02* | 0.70±0.02 |
| Sis+siH | 0.58±0.02* | 0.31±0.02* |
| *P < 0.05 compared with blank control group. | ||
转染48 h后,与空白对照组比较,sis组和sis+siH组细胞凋亡率明显升高(F=109, P<0.01);空白对照组与SCR组间比较差异无统计学意义(P>0.05);sis+siH组细胞凋亡率略高于sis组,但组间比较差异也无统计学意义(P>0.05)。见图 6和表 6。

|
| A: Blank control group; B:SCR group; C:Sis group; D:Sis+siH group. 图 6 流式细胞术检测转染48 h后各组BGC-823细胞凋亡率 Figure 6 Apoptotic rates of BGC-823 cells in various groups 48 h after transfection |
|
|
| (n=4, x±s, η/%) | |
| Group | Apoptotic rate |
| Blank control | 11.54±2.67 |
| SCR | 13.00±2.32 |
| Sis | 16.70±2.03* |
| Sis+siH | 16.74±3.03* |
| *P < 0.01 compared with blank control group. | |
研究[10-11]显示:特异性抑制肿瘤细胞中靶向基因的表达,可有效抑制肿瘤细胞的侵袭,发挥肿瘤基因治疗作用。研究[12-14]表明:survivin和HIF-1α在胃癌细胞内均有一定程度的表达,阻断其表达可抑制肿瘤细胞的生长。国内外学者成功地利用了RNAi技术沉默survivin,可明显抑制胃癌SGC-7901和BGC-823细胞生长增殖[15-17],本研究结果也证实了该结论。本研究结果显示:转染48h后,sis组和sis+siH组胃癌BGC-823细胞的生长受到明显抑制,生长曲线低平,且sis+siH组的生长抑制作用明显强于sis组。本研究结果表明:抑制胃癌BGC-823细胞中surviving和HIF-1α基因表达水平可降低胃癌细胞增殖能力。肿瘤细胞生长一方面由细胞周期的细胞数决定,另一方面也取决于细胞增殖与细胞死亡的比例[18-21]。因此,可通过检测surviving和HIF-1α对胃癌BGC-823细胞凋亡的影响,来评价细胞增殖与凋亡之间的关系。本研究结果显示:sis组和sis+siH组胃癌BGC-823细胞凋亡率明显高于空白对照组和SCR组, 空白对照组与SCR组间比较无明显差异;sis+siH组细胞凋亡率略高于sis组,但组间比较差异无统计学意义。有研究[18]通过靶向诱导内皮细胞凋亡抑制肿瘤血管新生,结果显示:促凋亡蛋白Bm和Bax表达及细胞色素C(CytC)的释放明显增加,而HIF-1α是血管内皮生长因子C(VEGF-C)的上游基因。本研究将surviving和HIF-1α基因作为靶向沉默基因,主要是利用该基因由线粒体释放入胞浆,通过内源性凋亡途径诱导细胞凋亡。
本研究利用Hifectin Ⅱ真核转染试剂,将预先合成的HIF-1α和survivin特异性siRNA直接转染胃癌BGC-823细胞,避免了构建表达载体的过程。此外,为便于观察,将荧光标记的无靶向siRNA(FAM-siRNA)一同转染细胞内,用于测定siRNA的细胞转染效率。本研究结果显示:HifectinⅡ作为一种阳离子脂质体转染试剂,与应用最为广泛的Lipo2000比较,具有转化效率高和操作便捷的优点。
综上所述,RNAi沉默survivin和HIF-1α双靶点基因,可抑制胃癌BGC-823细胞增殖,促进其凋亡。本研究结果初步提示:沉默survivin和HIF-1α基因有望成为胃癌基因治疗的新方法,但其具体的分子作用机制仍需进一步研究。
| [1] | 何苗, 王子卫. miRNA与siRNA胃癌相关研究的现状及进展[J]. 遗传, 2011, 33(9): 925–930. |
| [2] | 孙延霞, 杨绍娟, 高申, 等. siRNA沉默survivin对人胃癌SCG-7901细胞产生的抑制作用[J]. 吉林大学学报:医学版, 2008, 34(3): 477–481. |
| [3] | Yu S, Yang CS, Li J, et al. Cancer Prevention Research in China[J]. Cancer Prev Res (Phila), 2015, 8(8): 662–674. DOI:10.1158/1940-6207.CAPR-14-0469 |
| [4] | Link A, Schirrmeister W, Langner C. Differential expression of microRNAs in preneoplastic gastric mucosa[J]. Sci Rep, 2015, 5(8): 8270. |
| [5] | Liu AH, He AB, Tong WX, et al. Prognostic significance of Livin expression in nasopharyngeal carcinoma after radiotherapy[J]. Cancer Radiother, 2016, 20(5): 384–390. DOI:10.1016/j.canrad.2016.05.013 |
| [6] | Kiraz Y, Adan A, Kartal Yandim M, et al. Major apoptotic mechanisms and genes involved in apoptosis[J]. Tumour Biol, 2016, 37(7): 8471–8486. DOI:10.1007/s13277-016-5035-9 |
| [7] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69–90. DOI:10.3322/caac.v61:2 |
| [8] | Vengut-Climent E, Terrazas M, Lucas R, et al. Synthesis, RNAi activity and nuclease-resistant properties of apolar carbohydrates siRNA conjugates[J]. Bioorg Med Chem Lett, 2013, 23(14): 4048–4051. DOI:10.1016/j.bmcl.2013.05.065 |
| [9] | 母润红, 马方. 特异性干扰survivin基因表达对人舌癌Tca8113细胞体外增殖和侵袭性的影响[J]. 中国免疫学杂志, 2017, 33(9): 1310–1314. |
| [10] | 王雷, 杜媛鲲, 米源, 等. Gli抑制剂诱导胃癌细胞凋亡作用的研究[J]. 重庆医学, 2016, 45(29): 4050–4052. DOI:10.3969/j.issn.1671-8348.2016.29.006 |
| [11] | Huang SP, Wu MS, Shun CT, et al. Cyclooxygenase-2 increases hypoxia-inducible factor-1 and vascular endothelial growth factor to promote angiogenesis in gastric carcinoma[J]. J Biomed Sci, 2005, 12(1): 229–241. DOI:10.1007/s11373-004-8177-5 |
| [12] | Zhao XY, Chen TT, Xia L, et al. Hypoxia inducible factor-1 mediates expression of galectin-1:the potential role in migration/invasion of colorectal cancer cells[J]. Carcinogenesis, 2010, 31(8): 1367–1375. DOI:10.1093/carcin/bgq116 |
| [13] | Xu XL, Yang YR, Mo XF, et al. Design, synthesis, and evaluation of benzofuran derivatives as novel anti-pancreatic carcinoma agents via interfering the hypoxia environment by targeting HIF-1α pathway[J]. Eur J Med Chem, 2017, 137: 45–62. DOI:10.1016/j.ejmech.2017.05.042 |
| [14] | Lee YH, Lee JM, Kim SG, et al. Synthesis and biological evaluation of 1, 2-dithiol-3-thiones and pyrrolo[J]. Bioorg Med Chem, 2016, 24(12): 2843–2851. DOI:10.1016/j.bmc.2016.04.054 |
| [15] | Altieri DC. Survivin and IAP proteins in cell-death mechanisms[J]. Biochem J, 2010, 430(2): 199–205. DOI:10.1042/BJ20100814 |
| [16] | Groner B, Weiss A. Targeting survivin in cancer:novel drug development Approaches[J]. BioDrugs, 2014, 28(1): 27–39. DOI:10.1007/s40259-013-0058-x |
| [17] | 冷松, 刘颖, 孙广慧, 等. 靶向survivin的siRNA对胃癌BGC-823细胞增殖的影响[J]. 中国微生态学杂志, 2010, 22(6): 523–530. |
| [18] | 马方, 母润红, 刘永超, 等. siRNA靶向干扰survivin基因对舌癌细胞系Tca8113侵袭性的影响[J]. 全科口腔医学电子杂志, 2015, 2(2): 94–96, 98. |
| [19] | 杨霞. 靶向诱导内皮细胞凋亡抑制肿瘤血管新生的研究进展[J]. 中山大学学报:医学科学版, 2017, 38(2): 204–214. |
| [20] | 赵川, 李骏萱, 刘雪梅, 等. 肿瘤血管生成机制的研究进展[J]. 中华中医药学刊, 2017, 35(1): 130–132. |
| [21] | 丁顺斌, 王简勤, 蔡明春, 等. miR630在胃癌组织中的表达变化及对胃癌细胞SGC-7901增殖、侵袭力的影响[J]. 山东医药, 2017, 57(15): 9–12. DOI:10.3969/j.issn.1002-266X.2017.15.003 |
 2018, Vol. 44
2018, Vol. 44


