扩展功能
文章信息
- 黄凯文, 李阿荣, 邓志军, 刘若轩, 李常青, 钟世顺, 郭洁文, 张洁, 陈滨
- HUANG Kaiwen, LI Arong, DENG Zhijun, LIU Ruoxuan, LI Changqing, ZHONG Shishun, GUO Jiewen, ZHANG Jie, CHEN Bin
- 荔枝核皂苷对糖调节受损大鼠胰腺组织氧化应激的改善作用及其机制
- Improvement effect of saponin of litchi seed on oxidative stress of pancreas tissue in impaired glucose regulation rats and its mechanism
- 吉林大学学报(医学版), 2018, 44(04): 746-752
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 746-752
- 10.13481/j.1671-587x.20180410
-
文章历史
- 收稿日期: 2018-03-27
2. 广东省广州市中医医院药学部, 广东 广州 510130;
3. 广州中医药大学热带医学研究所, 广东 广州 510006;
4. 广东省生物制品与药物研究所, 广东 广州 510440
2. Department of Pharmacy, Guangzhou Hospital of Traditional Chinese Medicine, Guangdong Province, Guangzhou 510130, China;
3. Institute of Tropical Medicine, Guangzhou University of Traditional Chinese Mdeicine, Guangzhou 510006, China;
4. Guangdong Provincial Institute of Biological Products and Materia Medica, Guangzhou 510440, China
糖调节受损(impaired glucose regulation,IGR)是介于正常血糖与糖尿病之间一种糖调节失衡表现,包括空腹血糖受损和糖耐量受损[1]。IGR是2型糖尿病(T2DM)的主要危险因素,核转录因子E2相关因子2(Nrf2)/血红素加氧酶1(HO-1)信号通路在IGR和T2DM中起重要作用,活化Nrf2/HO-1信号通路可有效防止或延缓上述病程的发展[2-3]。荔枝核为国家药典收载岭南道地药材,荔枝核及其皂苷(saponin of litchi seed,SL)可明显改善高糖-高脂饮食诱导高脂血症-胰岛素抵抗-脂肪肝模型大鼠、地塞米松致胰岛素抵抗模型大鼠的血糖、血脂、胰岛素、瘦素、胰岛素敏感指数(ISI)、肿瘤坏死因子(TNF-α)、超氧化物歧化酶(SOD)和丙二醛(MDA)等指标,并明显改善高脂血症-胰岛素抵抗-脂肪肝模型大鼠的肝、肾功能及组织病理学改变[4-6]。本实验采用高糖高脂饲料建立IGR大鼠模型,研究SL通过调节Nrf2/HO-1信号通路抗氧化应激进而改善IGR的作用及其机制。
1 材料与方法 1.1 实验动物和饲料SPF级SD大鼠72只,雌雄各半,体质量180~200 g,由广东省实验动物中心提供,生产许可证号:SCXK(粤)2013-0002。基础饲料由广东省实验动物中心提供,配方:11%脂肪,21%蛋白质,68%碳水化合物;高脂饲料配方由本实验室前期研究确定,委托广东省实验动物中心加工,配方:43.6%基础饲料,20%猪油,15%蔗糖,15%蛋黄粉,5%酪蛋白,1.2%胆固醇,0.2%胆酸钠。
1.2 药物、主要试剂和仪器荔枝核药材购于广州采芝林药业有限公司(批号:YPA3C0001),经广东省生物制品与药物研究所副主任药师钟世顺鉴定为无患子科植物荔枝(Litchi chinensis Sonn.)的干燥成熟种子。SL提取方法:荔枝核经70%乙醇超声提取,滤液减压浓缩回收乙醇后经大孔吸附树脂柱,用70%乙醇洗脱,得SL,含量为83.5%。盐酸二甲双胍片,中美上海施贵宝制药有限公司,批号:1407082;总胆固醇(CHOL)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、SOD和MDA试剂盒均购自南京建成生物工程研究所,批号分别为A111-1、A110-1、A112-1、A113-1、A001-3、A003-1;总RNA提取试剂Trizol,美国Invitrogen产品,批号:15596026;ReverTra Ace qPCR RT Kit及SYBR® Green Real-time PCR Master Mix,日本TOYOBO公司产品,批号:135600和26200;HO-1、SOD、MDA和β-actin引物由日本TaKaRa公司设计合成;Nrf2一抗,美国Santa Cruz产品,批号:sc-722;HO-1和β-actin一抗,美国CST公司产品,批号分别为5853和4970;核蛋白和胞浆蛋白提取试剂盒,凯基生物有限公司,批号:KGP1100;ECL检测试剂盒,美国Thermo公司产品,批号:32019;其他试剂均为国产分析纯,由广州浩玛生物科技有限公司提供。罗氏卓越型罗康全精密血糖仪和血糖试纸,瑞士罗氏制药公司;奥林巴斯AU5400全自动生化分析仪,美国贝克曼公司;5810R高速冷冻离心机,美国Thermo公司;7500荧光定量PCR仪,美国ABI公司;Synergy HT多功能酶标仪,美国BioTek公司;POWER/PAC 1000电泳仪、POWER/PAC Universal电转装置和GS-800光密度扫描仪,美国BIO-RAD公司。
1.3 动物模型制备、分组和给药造模方法参照参考文献[7-8]:72只SD大鼠适应性饲养7 d后,随机选取12只作为正常对照组,以基础饲料饲养;其余60只采用高脂饲料饲养造模。大鼠连续喂养12周后,禁食16 h不禁水,灌胃给予50%葡萄糖2 g·kg-1,尾静脉采血,检测空腹血糖(FBG)水平,并进行口服葡萄糖耐量试验(OGTT),以FBG 6.1~7.0 mmol·L-1、OGTT 2 h血糖7.8~11.1 mmol·L-1为造模成功标准。将造模成功大鼠随机分为模型组、二甲双胍组(0.2 g·kg-1,相当于成人临床用药剂量的2倍)、低剂量SL组(0.05 g·kg-1,相当于成人临床用药剂量的0.1倍)、中剂量SL组(0.1 g·kg-1,相当于成人临床用药剂量的0.2倍)和高剂量SL组(0.2 g·kg-1,相当于成人临床用药剂量的0.4倍),每组12只。二甲双胍组及低、中和高剂量SL组大鼠均灌胃给药,每日1次,连续给药6周,正常对照组及模型组大鼠灌服等体积生理盐水。给药期间正常对照组大鼠给予基础饲料饲养,其余各组大鼠继续给予高脂饲料饲养,每周末次给药后,大鼠禁食16 h尾静脉采血,检测FBG。
1.4 OGTT及FBG和血脂水平检测OGTT:给药6周末,大鼠禁食16 h,检测FBG后,灌胃给予50%葡萄糖2 g·kg-1,于30、60和120 min自大鼠尾静脉取血,血糖仪检测血糖水平。OGTT结束后,全部大鼠禁食16 h,腹腔注射戊巴比妥钠麻醉,腹主动脉采血,分离血清,采用全自动生化分析仪检测FBG和血脂(CHOL、TG、HDL-C及LDL-C)水平。
1.5 实时荧光定量PCR(Real-time PCR)法检测大鼠胰腺组织中SOD、MDA和HO-1 mRNA表达水平各组随机抽取4只大鼠,取胰腺组织,以Trizol法提取胰腺组织RNA,紫外分光光度计检测RNA纯度,1.5%琼脂糖凝胶电泳检测完整性。RNA样品经逆转录反应合成cDNA模板,随后参照试剂盒进行PCR,反应体系为cDNA模板1 μL,上下游引物各1 μL,SYBRGreen PCR Mix 12.5 μL,DEPC H2O补足总体积至25 μL。反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共40个循环,每次扩增设置β-actin为内参对照。采用美国ABI公司自带的PCR系统软件分析,观察扩增曲线,计算样本归一化的每个反应管内荧光信号到达设定的域值时所经历的循环数(Ct值)、目的基因Ct值与内参Ct值之差△Ct和各组△Ct与正常对照组△Ct之差△△Ct,以△△Ct值的负数为指数计算2-△△Ct,即代表SOD、MDA和HO-1 mRNA表达水平。引物序列及扩增产物大小见表 1。
| cDNA | Primer sequence | Length(bp) |
| HO-1 | Forward 5′-GGGTCCTCACACTCAGTTT-3′ Reversed 5′-CCAGGCATCTCCCTTCCATTC-3′ |
228 |
| SOD | Forward 5′-CACAACTGGTTCACCGCTTG-3′ Reversed 5′-GCCCAACCAGACAGAGAATGA-3′ |
91 |
| MDA | Forward 5′-CGTGCAATCAGTTCGGACC-3′ Reversed 5′-CCAGGCATCTCCCTTCCATTC-3′ |
101 |
| β-actin | Forward 5′- GGGAAATCGTGCGTGACATT-3′ Reversed 5′- GCGGCAGTGGCCATCTC-3′ |
144 |
各组随机抽取大鼠4只,取胰腺组织,按说明书提取全细胞、胞核和胞质蛋白并测定蛋白浓度。每孔上样50 μg,12%聚丙烯酰胺凝胶电泳分离样品,将蛋白转至PVDF膜,5%脱脂奶粉室温封闭2 h,加入一抗溶液(HO-1 1:800,Nrf2 1:500,β-actin 1:1000),4 ℃孵育过夜,TBST缓冲液洗膜,10 min/次,共3次,HRP标记的二抗溶液(1:15000)室温孵育2 h,上述方法洗膜后加入ECL液显色曝光。使用IPWIN60图像分析软件对条带灰度进行分析,以β-actin为内参,以目的蛋白与β-actin灰度值比值表示蛋白表达水平。计算Nrf2核转位率代表Nrf2活化程度,核转位率=细胞核蛋白表达水平/(细胞核蛋白表达水平+细胞浆蛋白表达水平)× 100%。
1.7 氧化应激指标检测取大鼠胰腺组织,以PBS制成10%匀浆液,3500 r·min-1、4 ℃离心15 min,取上清液,按试剂盒说明书检测SOD活性和MDA水平。
1.8 统计学分析采用SPSS13.0统计软件进行统计学分析。各组大鼠FBG水平,OGTT结果,血脂水平,胰腺组织中SOD活性和MDA水平,胰腺组织中SOD、MDA和HO-1 mRNA表达水平及HO-1和Nrf2蛋白表达水平均以x±s表示,组间比较采用单因素方差分析及LSD检验。以P<0.05为差异有统计学意义
2 结果 2.1 给药前后各组大鼠FBG水平给药前,与正常对照组比较,各组大鼠FBG水平均明显升高(P<0.05),但各组间比较差异无统计学意义(P>0.05)。给药后,与正常对照组比较,模型组大鼠FBG水平在各时间点均明显升高(P<0.05);与模型组比较,二甲双胍组和高剂量SL组大鼠FBG水平在各时间点均明显降低(P<0.05或P<0.01),中剂量SL组大鼠FBG在给药后4、5和6周明显降低(P<0.05或P<0.01),但低剂量SL组大鼠FBG水平无明显变化(P>0.05)。见表 2。
| [n=12, x±s, cB/(mmol·L-1)] | |||||||
| Group | Level of FBG | ||||||
| (week) 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| Normal control | 4.59±0.16 | 4.61±0.13 | 4.70±0.12 | 4.68±0.23 | 4.72±0.12 | 4.64±0.13 | 4.65±0.53 |
| Model | 6.78±1.23* | 6.62±1.29* | 6.89±1.05* | 6.72±1.23* | 6.85±1.27* | 6.87±1.25* | 6.88±1.34* |
| Metformin | 6.97±1.29* | 5.16±1.64△△ | 5.31±1.18△△ | 5.43±1.57△△ | 5.86±1.08△ | 5.74±1.19△ | 5.56±1.29△△ |
| SL | |||||||
| Low | 6.51±1.08* | 6.6±1.25 | 6.73±1.06 | 6.37±1.19 | 6.31±1.06 | 6.54±1.11 | 6.58±1.06 |
| Medium | 6.95±1.28* | 6.89±1.04 | 6.31±1.01 | 6.28±1.09 | 5.85±0.54△ | 5.87±0.89△ | 5.95±0.57△ |
| High | 6.72±0.85* | 5.88±0.93△ | 5.96±0.9△ | 6.12±1.09△ | 5.93±1.02△ | 5.65±1.06△△ | 5.76±1.01△△ |
| *P < 0.05 vs normal control group;△P < 0.05,△△P < 0.01 vs model group. | |||||||
与正常对照组比较,模型组大鼠各时间点血糖水平均明显升高(P<0.01);与模型组比较,二甲双胍组和中、高剂量SL组大鼠各时间点血糖水平均明显降低(P<0.05或P<0.01)。见表 3。
| [n=12, x±s, cB/(mmol·L-1)] | ||||
| Group | Blood glucose | |||
| (t/min) 0 | 30 | 60 | 120 | |
| Normal control | 4.82±0.46 | 7.85±0.73 | 7.42±0.62 | 5.68±0.53 |
| Model | 10.88±3.62* | 11.05±3.83* | 11.03±3.94* | 10.46±2.54* |
| Metformin | 7.15±1.69△ | 9.69±1.17△ | 9.77±6.88△ | 7.03±5.37△△ |
| SL | ||||
| Low | 9.95±1.13 | 10.58±2.12 | 10.54±2.25 | 10.05±2.63 |
| Medium | 7.02±4.28 | 9.65±1.13△ | 9.52±1.54△ | 7.65±1.26△△ |
| High | 7.25±2.05△ | 9.85±1.38△ | 9.56±1.23△ | 7.05±1.59△△ |
| *P < 0.01 vs normal control group;△P < 0.05,△△P < 0.01 vs model group. | ||||
与正常对照组比较,模型组大鼠血清中CHOL、TG和LOL-C水平明显升高(P<0.05或P<0.01);与模型组比较,二甲双胍组和中、高剂量SL组大鼠TG水平明显降低(P<0.05或P<0.01),低剂量SL组大鼠血脂水平无明显变化(P>0.05)。见表 4。
| [n=12, x±s, cB/(mmol·L-1)] | ||||
| Group | CHOL | TG | HDL-C | LDL-C |
| Normal control | 1.45±0.26 | 0.37±0.13 | 0.52±0.08 | 0.24±0.03 |
| Model | 2.28±0.48** | 1.65±0.83** | 0.65±0.09 | 0.46±0.24* |
| Metformin | 2.01±0.69 | 0.43±0.34△△ | 0.57±0.08 | 0.38±0.27 |
| SL | ||||
| Low | 2.15±0.51 | 1.67±2.12 | 0.57±0.05 | 0.47±0.15 |
| Medium | 2.12±0.48 | 0.85±0.83△ | 0.54±0.04 | 0.46±0.23 |
| High | 2.05±0.45 | 0.41±0.29△△ | 0.56±0.06 | 0.36±0.12 |
| *P < 0.05,**P < 0.01 vs normal control group;△P < 0.05,△△P < 0.01 vs model group. | ||||
与正常对照组比较,模型组大鼠胰腺组织中SOD活性降低(P<0.01), MDA水平升高(P<0.01);与模型组比较,二甲双胍组和中、高剂量SL组SOD活性升高(P<0.05或P<0.01),MDA水平降低(P<0.05或P<0.01),而低剂量SL组大鼠胰腺组织中SOD活性和MDA水平无明显变化(P>0.05)。见表 5。
| (n=4, x±s) | ||
| Group | SOD [λB/(kU·L-1)] |
MDA [cB/(μmol·L-1)] |
| Normal control | 23.37±0.13 | 30.34±1.95 |
| Model | 13.65±2.83* | 40.69±2.03* |
| Metformin | 20.89±5.07△△ | 31.41±3.69△△ |
| SL | ||
| Low | 15.67±4.52 | 39.38±3.31 |
| Medium | 19.85±4.38△ | 35.11±2.72△ |
| High | 21.34±2.07△△ | 32.38±3.26△△ |
| *P < 0.01 vs normal control group;△P < 0.05,△△P < 0.01 vs model group. | ||
与正常对照组比较,模型组大鼠胰腺组织中MDA和HO-1 mRNA表达水平升高(P<0.05或P<0.01),SOD mRNA表达水平降低(P<0.05)。与模型组比较,二甲双胍组和中、高剂量SL组大鼠胰腺组织中SOD和HO-1 mRNA表达水平升高(P<0.05或P<0.01),MDA表达水平降低(P<0.05或P<0.01)。见表 6。
| (n=4, x±s) | |||
| Group | SODmRNA | MDAmRNA | HO-1mRNA |
| Normal control | 1.00±0.02 | 1.00±0.03 | 1.00±0.03 |
| Model | 0.35±0.08** | 1.69±0.23** | 1.59±0.21* |
| Metformin | 1.13±0.14△△ | 0.52±0.07△△ | 2.58±0.29△△ |
| SL | |||
| Low | 0.51±0.09 | 1.48±3.31 | 1.67±0.43 |
| Medium | 0.85±0.12△ | 1.19±0.24△ | 2.23±0.27△△ |
| High | 1.04±2.07△△ | 0.95±0.27△△ | 2.65±0.32△△ |
| *P < 0.05,**P < 0.01 vs normal control group;△P < 0.05,△△P < 0.01 vs model group. | |||
与正常对照组比较,模型组大鼠胰腺组织中HO-1蛋白表达水平升高(P<0.01);与模型组比较,二甲双胍组和中、高剂量SL组大鼠胰腺组织中HO-1蛋白表达水平升高(P<0.05)。与正常对照组比较,模型组大鼠胰腺组织中胞质和胞核Nrf2蛋白表达水平和核转位率明显升高(P<0.01);与模型组比较,二甲双胍组和中、高剂量SL组胰腺组织中胞质Nrf2蛋白表达水平降低(P<0.05或P<0.01),胞核Nrf2蛋白表达水平及核转位率升高(P<0.05或P<0.01)。见图 1、2和表 7。
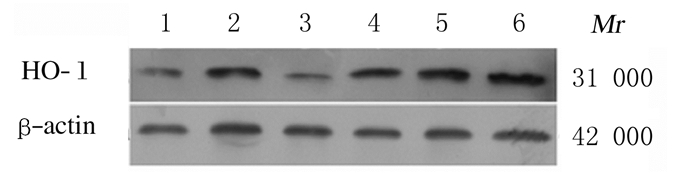
|
| Lane 1: Normal control group; Lane 2: Model group; Lane 3: Low dose of SL group; Lane 4: Medium dose of SL group; Lane 5: High dose of SL group; Lane 6: Metformin group. 图 1 各组大鼠胰腺组织中HO-1蛋白表达电泳图 Figure 1 Electrophoregram of expression levels of HO-1 proteins in pancreas tissue of rats in various groups |
|
|
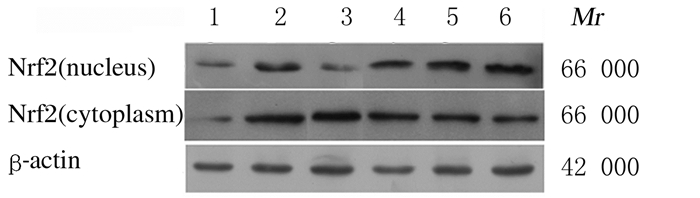
|
| Lane 1: Normal control group; Lane 2: Model group; Lane 3: Low dose of SL group; Lane 4: Medium dose of SL group; Lane 5: High dose of SL group; Lane 6: Metformin group. 图 2 各组大鼠胰腺组织中Nrf2蛋白表达电泳图 Figure 2 Electrophoregram of expression levels of Nrf2 protein in pancreas tissue of rats in various groups |
|
|
| (n=4, x±s) | ||||
| Group | HO-1 protein | Nrf2 protein | Nrf2 nucleus translocation rate (η/%) | |
| Nucleus | Cytoplasm | |||
| Normal control | 0.31±0.02 | 0.25±0.05 | 0.17±0.03 | 25.74±4.94 |
| Model | 0.73±0.22* | 0.68±0.18* | 1.25±0.23* | 35.76±3.92* |
| Metformin | 1.15±0.26△ | 1.25±0.34△△ | 0.75±0.27△△ | 45.72±4.29△△ |
| SL | ||||
| Low | 0.58±0.32 | 0.37±0.07 | 1.17±0.27 | 26.65±4.32 |
| Medium | 0.98±0.11△ | 0.85±0.12△ | 0.95±0.34△ | 40.54±5.36△△ |
| High | 1.23±0.36△ | 1.13±0.39△△ | 0.84±0.31△ | 42.93±3.57△△ |
| *P < 0.01 vs normal control group;△P < 0.05,△△P < 0.01 vs model group. | ||||
IGR是T2DM前期,主要表现为胰岛β细胞胰岛素分泌功能受损。IGR患者血清中多种炎症因子水平明显升高,由此引发的氧化应激作用会加重胰岛β细胞损害及胰岛素抵抗(IR),使糖尿病前期向糖尿病转变[9]。研究[10-11]显示:活性氧簇(ROS)生成参与胰岛β细胞死亡及功能损伤,血糖水平长期偏高诱导氧化应激发生,细胞自身通过抗氧化酶及抗氧化分子清除ROS以抑制氧化应激。Nrf2是调节抗氧化应激反应的重要转录因子,正常状态下,Nrf2通路活性被抑制,细胞发生氧化应激损伤,Nrf2与其特异性受体Kelch样ECH相关蛋白1(Keap 1)解离,发生核转位进入细胞核,并激活抗氧化反应元件(ARE)调控的抗氧化酶基因包括HO-1、谷胱甘肽-S-转移酶等的表达,促进ROS清除、增加谷胱甘肽合成、还原醌类化合物和解毒外源性化学物质等,保护其免受氧化应激损伤,维持细胞内氧分压动态平衡[12-14]。以Nrf2基因缺失(Nrf2-/-)小鼠作为模型对该转录因子进行的系列研究[15-16]显示:Nrf2-/-小鼠更易受到ROS、炎症反应及有毒代谢产物损伤。因此,研究活化Nrf2信号通路对防治IGR具有重要意义。
本研究结果显示:中、高剂量SL可调节大鼠脂质代谢,修复并改善胰腺组织及糖耐量损伤,上调胰腺组织SOD活性、降低MDA及胰腺组织胞质Nrf2蛋白水平,提高胞核Nrf2水平和Nrf2核转位率,上调HO-1表达。Lee等[17]发现:糖尿病状态下胰腺组织中HO-1表达增加,提示其可增强抗氧化作用,保护脏器。本研究结果显示:伴随Nrf2核转位增加,胰腺组织中HO-1表达也随之增强,推测HO-1参与IGR状态下的抗氧化防御,提示SL具有改善糖脂代谢和增强抗氧化应激效果,其作用机制可能与激活Nrf2/HO-1信号途径,促进Nrf2核转位以增强抗氧化物质HO-1基因表达和蛋白合成有关,这与Lee等[17]报道相一致。本课题组前期研究[18]证实:荔枝核具有确切的改善IR作用,并从中分离了4个化合物,分别为豆甾醇、对羟基苯甲醛、胡萝卜苷和山柰酚-3-O-β-D-吡喃葡萄糖苷。最新研究[19]显示:荔枝核有效部位群(皂苷、黄酮、鞣质)能明显改善T2DM-IR模型大鼠糖脂代谢,提高IR-3T3-L1细胞胰岛素敏感性,增加其摄取和利用葡萄糖能力,进而改善IR,相关机制与降低抵抗素(RETN)、蛋白质酪氨酸磷酸酶1B(PTP1B)、内质网源性转录因子(CHOP)及葡萄糖调节蛋白78(GRP78)基因mRNA表达有关。本文作者还将进一步探讨T2DM形成的病理学机制是否与缺氧引起的线粒体生成缺陷及呼吸功能障碍有关联,以证实SL防治IGR可能是通过促进线粒体生成和加速脂肪酸氧化分解实现的。
| [1] | 董银华, 王洪新, 陈泽峰, 等. 糖调节受损大鼠认知障碍及脑组织NF-κBp65、TNF-α的表达[J]. 中风与神经疾病杂志, 2014, 31(10): 891–893. |
| [2] | Nakai K, Fujii H, Kono K, et al. Vitamin D activates the Nrf2-Keap1 antioxidant pathway and a meliorates nephropathy in diabetic rats[J]. Am J Hypertens, 2014, 27(4): 586–595. DOI:10.1093/ajh/hpt160 |
| [3] | Yang SM, Ka SM, Wu HL, et al. Thrombomodulin domain 1 ameliorates diabetic nephropathy in mice via anti-NF-κB/NLRP3 inflammasome-mediated inflammation, enhancement of NRF2 antioxidant activity and inhibition of apoptosis[J]. Diabetologia, 2014, 57(2): 424–434. DOI:10.1007/s00125-013-3115-6 |
| [4] | 郭洁文, 潘竞锵, 邱光清, 等. 荔枝核增强2型糖尿病胰岛素抵抗大鼠胰岛素敏感性作用[J]. 中国新药杂志, 2003, 12(7): 526–529. |
| [5] | 郭洁文, 廖惠芳, 潘竞锵, 等. 荔枝核皂苷改善高脂血症-脂肪肝大鼠胰岛素抵抗的作用机制[J]. 中国药房, 2005, 16(10): 732–734. DOI:10.3969/j.issn.1001-0408.2005.10.004 |
| [6] | 郭洁文, 廖惠芳, 潘竞锵, 等. 荔枝核皂苷改善地塞米松致大鼠胰岛素抵抗的作用机制[J]. 中国药房, 2004, 15(12): 719–720. DOI:10.3969/j.issn.1001-0408.2004.12.005 |
| [7] | Li XG, Li L, Zhou X, et al. Pharmacokinetic/pharmacodynamic studies on exenatide in diabetic rats[J]. Acta Pharmacol Sin, 2012, 33(11): 1379–1386. DOI:10.1038/aps.2012.33 |
| [8] | Ti Y, Xie GL, Wang ZH. TRB3 gene silencing alleviates diabelie cardiomyopatby in a type 2 diabetic rat model[J]. Diabetes, 2011, 60(11): 2963–2974. DOI:10.2337/db11-0549 |
| [9] | Engin A. The pathogenesis of obesity-associated adipose tissue inflammation[J]. Adv Exp Med Biol, 2017, 960: 221–245. DOI:10.1007/978-3-319-48382-5 |
| [10] | Newsholme P, Cruzat VF, Keane KN, et al. Molecular mechanisms of ROS production and oxidative stress in diabetes[J]. Biochem J, 2016, 473(24): 4527–4550. DOI:10.1042/BCJ20160503C |
| [11] | Deng ZJ, Liu RX, Li AR, et al. How do structurally distinct compounds exert functionally identical effects in combating obesity?[J]. Front Pharmacol, 2018, 9: 69. DOI:10.3389/fphar.2018.00069 |
| [12] | Wang X, Hai CX. ROS acts as a double-edged sword in the pathogenesis of type 2 diabetes mellitus:is Nrf2 a potential target for the treatment[J]. Mini Rev Med Chem, 2011, 11(12): 1082–1092. DOI:10.2174/138955711797247761 |
| [13] | Vomund S, Schäfer A, Parnham M. Nrf2, the master regulator of anti-oxidative responses[J]. Int J Mol Sci, 2017, 18(12): 2772. DOI:10.3390/ijms18122772 |
| [14] | David JA, Rifkin WJ, Rabbani PS, et al. The Nrf2/Keap1/ARE pathway and oxidative stress as a therapeutic target in type Ⅱ diabetes mellitus[J]. J Diabetes Res, 2017, 2017(11): 1–15. |
| [15] | Wang Y, Zhang Z, Sun W, et al. Sulforaphane attenuation of type 2 diabetes-induced aortic damage was associated with the upregulation of Nrf2 expression and function[J]. Oxid Med Cell Longev, 2014, 2014: 123963. |
| [16] | Jazwa A, Rojo AI, Innamorato NG, et al. Pharmacological targeting of the transcription factor Nrf2 at the basal ganglia provides disease modifying therapy for experimental parkinsonism[J]. Antioxid Redox Signal, 2011, 14(12): 2347–2360. DOI:10.1089/ars.2010.3731 |
| [17] | Lee SC, Han SH, Li JJ, et al. Induction of heme oxygenase-1 protects against podocyte apoptosis under diabetic conditions[J]. Kidney Int, 2009, 76(8): 838–848. DOI:10.1038/ki.2009.286 |
| [18] | 黄凯文, 郭洁文, 陈剑梅, 等. 荔枝核乙酸乙酯部位化学成分研究[J]. 中药材, 2012, 35(1): 64–66. |
| [19] | 李常青, 廖向彬, 李小翚, 等. 荔枝核有效部位群改善实验性2型糖尿病胰岛素抵抗的作用及机制[J]. 中药材, 2015, 38(7): 1466–1471. |
 2018, Vol. 44
2018, Vol. 44


