扩展功能
文章信息
- 樊海瑞, 赵岩, 傅警龙, 张海波, 王德超, 郜玉钢, 张连学
- FAN Hairui, ZHAO Yan, FU Jinglong, ZHANG Haibo, WANG Dechao, GAO Yugang, ZHANG Lianxue
- 痛风宁胶囊对痛风性肾病模型小鼠主要脏器病理损伤的改善作用
- Improvement effects of Tongfengning Capsule on pathological injuries of major organs in gouty nephropathy model mice
- 吉林大学学报(医学版), 2018, 44(04): 741-745
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 741-745
- 10.13481/j.1671-587x.20180409
-
文章历史
- 收稿日期: 2017-11-01
2. 吉林省长春市长中风湿 骨病医院风湿科, 吉林 长春 130021
2. Department of Rheumatism, Changzhong Rheumatism Hospital, Changchun City, Jilin Province, Changchun 130021, China
痛风是一组嘌呤代谢紊乱、血尿酸水平升高所致组织损伤的异质性疾病,常累及肾脏,引起肾尿酸结石及肾间质病变[1]。目前用于治疗痛风的药物主要有秋水仙碱(colchicine)、白细胞介素1β(interleukin-1β)抑制剂、非甾体抗炎药(NSAIDs)、促肾上腺皮质激素类(ACTH)和皮质类固醇类(corticosteroids)等[2]。此类药物虽作用迅速且效果明显,但患者需长期使用并常伴有严重的不良反应。我国相关专业研究者[3-11]在建立痛风动物模型和观察药物疗效等领域进行了大量考察,证实有些中药具有治疗痛风及其并发症的效果。
痛风宁胶囊(TFN,长春医药大学风湿骨病医院提供)组方由土茯苓、泽兰、蚕砂、黄柏、大黄和金钱草等21味中药组成,是长春中医药大学风湿骨病医院临床多年应用的经验方,在临床上已使用十余年,对痛风具有良好的治疗效果[12-13]。本文作者主要研究不同剂量TFN对腺嘌呤联合乙胺丁醇片所致痛风性肾病模型小鼠主要脏器病理损伤的改善作用,为进一步开发和利用TFN提供理论依据。
1 材料与方法 1.1 实验动物、药物、主要试剂和仪器70只雄性KM小鼠,SPF级,体质量(20±2)g,购自长春市生物制品研究所有限责任公司,动物许可证号:SCXK(吉)2011-0003。TFN胶囊(规格:0.5 g,批准文号:吉药制字Z2007A050),长春市长中风湿骨病医院提供;痛风舒片(TFS)(规格:0.3 g,生产批号:20141201),山西仁源堂药业有限公司;别嘌醇片(规格:0.1 g,生产批号:20150422),世贸天阶制药(江苏)有限责任公司;腺嘌呤(货号:A8626-100G),美国Sigma公司;盐酸乙胺丁醇片(规格:0.25g,批准文号:国药准字H21022349),沈阳红旗制药有限公司。尿酸(UA)、肌酐(Cr)、尿素氮(BUN)、黄嘌呤氧化酶(XOD)、单核趋化蛋白(MCP-1)、肿瘤坏死因子α(TNF-α)和环氧化酶(COX-2)试剂盒均购自长春百金生物科技有限公司;其他试剂均为国产分析纯。酶标仪(SPECTRAMAX190),美谷分子仪器(上海)有限公司。
1.2 动物模型的制备和分组[14-15]70只健康小鼠适应性饲养1周后随机分为7组:对照组,模型组,别嘌醇片和TFS阳性药对照组,低、中和高剂量TFN组,每组10只。除对照组之外,其他各组小鼠均以腺嘌呤(100 mg·kg-1)和盐酸乙胺丁醇片(250 mg·kg-1)灌胃给药进行造模,每天1次。第8天模型制备成功后,各组小鼠开始灌胃给药,共给药14 d。根据人与实验动物给药量的剂量换算[16],低、中和高剂量TFN组TFN剂量分别为200、400和800 mg·kg-1,别嘌醇片剂量为50 mg·kg-1,TFS剂量为600 mg·kg-1; 对照组和模型组小鼠均灌胃给予等量生理盐水。
1.3 指标检测和方法[17]实验第22天给药1 h后,小鼠摘眼球取血,3000 r·min-1离心10 min,分离血清,按试剂盒说明书采用酶联反应法测定血清中UA、Cr、BUN、MCP-1、TNF-α和XOD水平。取小鼠肾脏迅速与生理盐水1:9混合,匀浆,匀浆液取上清检测小鼠肾组织中COX-2活性。
1.4 HE染色观察小鼠肾脏、胸腺和脾脏组织病理形态表现实验第22天给药1 h后,小鼠脱颈椎处死,取其肾脏、胸腺和脾脏组织,用预冷生理盐水进行清洗并称质量,10%甲醛溶液固定24 h,脱水石蜡包埋,切片,置于干净载玻片后,HE染色,光镜下观察组织病理形态表现。
1.5 统计学分析采用SPSS 16.0统计软件进行统计学分析。小鼠血清生化指标和肾组织中COX-2活性均以x±s表示。多组间样本均数比较采用单因素方差分析,组间比较采用SNK-q法。以P<0.05为差异有统计学意义。
2 结果 2.1 各组小鼠血清中UA、Cr和XOD水平与对照组比较,模型组小鼠血清中UA、Cr和XOD水平均明显升高(P<0.01)。与模型组比较,别嘌醇片和TFS阳性药对照组及高剂量TFN组小鼠血清中UA、Cr和XOD水平均明显降低(P<0.01),低和中剂量TFN组小鼠血清中UA、Cr和XOD水平有降低趋势,但差异无统计学意义(P>0.05)。见表 1。
| (n=10, x±s) | ||||
| Group | Dose (mg·kg-1) |
Cr [cB/(μmol·L-1)] |
XOD [ρB/(ng·L-1)] |
UA [cB/ (μmol·L-1)] |
| Control | 0 | 55.53±11.43 | 11.53±1.89 | 61.13±7.17 |
| Model | 0 | 113.42±18.29* | 55.65±10.23* | 103.74±18.82* |
| Allopurinol | 50 | 68.91±6.65△ | 22.58±2.11△ | 76.47±13.75△ |
| TFS | 600 | 67.43±9.54△ | 23.81±1.38△ | 77.47±8.01△ |
| TFN | ||||
| Low dose | 200 | 98.11±8.53 | 51.46±3.84 | 91.82±11.14 |
| Medium dose | 400 | 94.91±15.13 | 46.33±7.59 | 89.95±6.74 |
| High dose | 800 | 70.26±12.25△ | 25.99±1.93△ | 80.77±8.60△ |
| *P<0.01 vs control group;△P<0.01 vs model group. | ||||
与对照组比较,模型组小鼠血清中BUN、MCP-1和TNF-α水平均明显升高(P<0.01)。与模型组比较,别嘌呤醇和TFS阳性药对照组及高剂量TFN组小鼠血清中BUN、MCP-1和TNF-α水平均明显降低(P<0.01),低和中剂量TFN组小鼠血清中BUN、MCP-1和TNF-α水平有降低趋势,但差异无统计学意义(P>0.05)。见表 2。
| (n=10, x±s) | ||||
| Group | Dose (mg·kg-1) |
MCP-1 [ρB/(ng·L-1)] |
TNF-α [ρB/(ng·L-1)] |
BUN [cB/(pmol·L-1)] |
| Control | 0 | 217.27±27.42 | 61.42±16.05 | 105.78±22.70 |
| Model | 0 | 300.75±28.74* | 125.04±14.27* | 194.26±19.75* |
| Allopurinol | 50 | 237.58±19.38△ | 75.43±4.76△ | 124.26±11.97△ |
| TFS | 600 | 241.99±16.84△ | 77.10±8.17△ | 123.17±18.99△ |
| TFN | ||||
| Low dose | 200 | 284.72±19.07 | 110.81±7.34 | 181.83±23.83 |
| Medium dose | 400 | 280.39±22.70 | 109.33±11.81 | 177.01±21.53 |
| High dose | 800 | 251.55±27.45△ | 86.71±6.49△ | 134.78±13.57△ |
| *P<0.01 vs control group;△P<0.01 vs model group. | ||||
与对照组比较,模型组小鼠肾组织匀浆上清液中COX-2活性明显升高(P<0.01)。与模型组比较,别嘌呤醇和TFS阳性药对照组及高剂量TFN组小鼠肾组织匀浆上清液中COX-2活性均明显降低(P<0.01),低和中剂量TFN组小鼠肾组织匀浆上清液中COX-2活性有降低趋势,但差异无统计学意义(P>0.05)。见表 3。
| [n=10, x±s, cB/(μmol·L-1)] | ||
| Group | Dose(mg·kg-1) | COX-2 |
| Control | 0 | 42.01±3.99 |
| Model | 0 | 92.10±18.77* |
| Allopurinol | 50 | 54.79±8.61△ |
| TFS | 600 | 55.32±10.89△ |
| TFN | ||
| Low dose | 200 | 82.71±13.15 |
| Medium dose | 400 | 78.51±10.28 |
| High dose | 800 | 66.50±8.18△ |
| *P<0.01 vs control group;△P<0.01 vs model group. | ||
对照组小鼠肾组织中肾小球、肾小管和肾间质形态均正常。与对照组比较,模型组小鼠肾组织中肾小球萎缩,肾小管水肿,肾小管和肾间质出现大量尿酸盐结晶。与模型组比较,别嘌呤醇和TFS阳性药对照组及高剂量TFN组小鼠肾脏组织病变明显改善,肾小球与肾间质可见少量的尿酸盐结晶, 低和中剂量TFN组小鼠肾脏组织病变无明显改变(图 1,见插页二)。
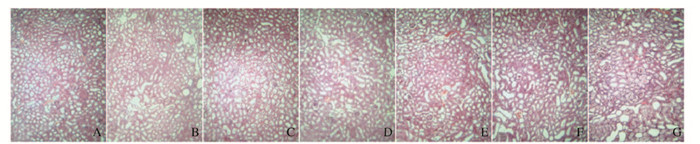
|
| A : Control group; B : Model group; C : Allopurinol group; D : TFS group; E : High dose of TFN group; F : Medium dose of TFN group; G : Low dose of TFN group. 图 1 各组小鼠肾组织病理形态表现(HE, ×100) Figure 1 Pathomorphology of kidney tissue of mice in various groups (HE, ×100) |
|
|
对照组小鼠胸腺分叶清楚,胸腺皮质细胞密集。与对照组比较,模型组小鼠胸腺皮质和髓质分界不清晰,细胞稀疏。与模型组比较,别嘌呤醇和TFS阳性药对照组及高剂量TFN组小鼠胸腺病理变化明显改善,低和中剂量TFN组小鼠胸腺病理变化有一定程度改善,但表现不明显(图 2,见插页二)
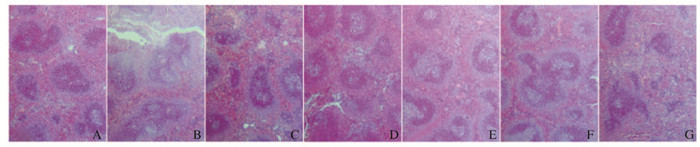
|
| A : Control group; B : Model group; C : Allopurinol group; D : TFS group; E : High dose of TFN group; F : Medium dose of TFN group; G : Low dose of TFN group. 图 2 各组小鼠胸腺组织病理形态表现(HE,×40) Figure 2 Pathomorphology of thymus tissue of mice in various groups(HE, ×40) |
|
|
对照组小鼠脾脏中红髓和白髓分界清晰,脾小结淋巴细胞密集,脾窦无充血现象。与对照组比较,模型组小鼠脾脏红髓和白髓分界不清晰,脾小结不同程度缩小,脾窦出现充血现象。与模型组比较,别嘌呤醇和TFS阳性药对照组及高剂量TFN组小鼠脾脏病理变化明显改善,脾脏红髓和白髓分界较清晰,脾脏充血现象得到改善,低和中剂量TFN组小鼠脾脏病理变化有一定程度改善,但不明显(图 3,见插页二)。
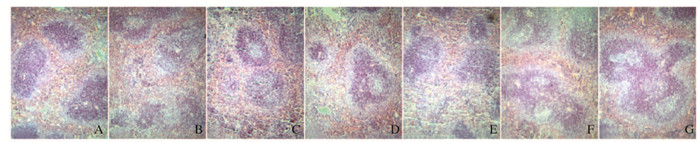
|
| A:Control group; B: Model group; C: Allopurinol group?D:TFS group; E: High dose of TFN group; F:Medium dose of TFN group; G:Low dose of TFN group. 图 3 各组小鼠脾脏组织病理形态表现(HE,×100) Figure 3 Pathomorphology of spleen tissue of mice in various groups (HE, ×100) |
|
|
治疗痛风的西药有较多的不良反应,如秋水仙碱具有恶心、腹泻等不良反应;非甾体抗炎药会导致肾损伤、胃肠道溃疡和出血等,IL-1β抑制剂有加重痛风症状的危险[18-19]。由于以上不良反应,临床上治疗痛风时会遇到对各种药物使用的限制问题。传统中医药在治疗痛风方面具有标本兼治的特点,且中药复方联合用药具有增效和减毒的优势[20-21]。
本研究结果显示:TFN可以较好地缓解痛风性肾病患者的各项病理变化,而且在实验过程中受试小鼠生长正常,无腹泻等不良反应。本研究中,高剂量TFN组小鼠血清中UA、Cr、BUN、MCP-1、TNF-α和XOD等生化指标水平明显降低,肾组织中COX-2水平明显降低;同时,高剂量TFN具有改善小鼠肾脏肾小球萎缩现象、清除肾小管与肾间质尿酸盐结晶和缓解胸腺及脾脏等脏器病理变化的效果,使脾脏脾窦充血现象得到缓解、胸腺皮质和髓质分界较清晰,而低和中低剂量TFN组小鼠上述病理改变不明显。
研究[22-25]显示:黄酮类化合物如槲皮素、山奈酚、木犀草素和桑色素等对于治疗痛风发挥着重要作用。本课题组前期研究显示:TFN组方中含有生物碱及黄酮类等化合物。本实验结果为进一步利用该组方治疗痛风性肾病提供了实验依据。
| [1] | 蓝伦礼. 肾茶对高尿酸血症及痛风性肾病肾损害的保护作用及机制研究[D]. 广州: 广州中医药大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10572-1017056228.htm |
| [2] | 刘磊, 薛愉, 朱小霞, 等. 国外痛风治疗指南演变及比较[J]. 中国实用内科杂志, 2017, 37(1): 21–23. |
| [3] | 陈敏庄, 方小林, 甘嘉亮, 等. 五苓散穴位敷贴治疗脾阳亏虚型痛风35例[J]. 河南中医, 2017, 37(10): 1712–1714. |
| [4] | 杨秀飞, 黄传兵, 徐慧敏, 等. 中医辨治痛风性肾病的研究现状[J]. 风湿病与关节炎, 2017, 6(3): 73–76. |
| [5] | 牟亮亮. 清热泄浊法治疗痛风性肾病临床及实验研究[D]. 济南: 山东中医药大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10441-1016320627.htm |
| [6] | 杨小花, 吴萍. 唐古特大黄对痛风性肾病模型大鼠eNOS、ET、6-Keto-PG F1α表达的影响[J]. 世界科学技术:中医药现代化, 2015, 17(4): 865–870. |
| [7] | 徐春宇. 中医药治疗痛风性肾病相关用药规律分析[D]. 沈阳: 辽宁中医药大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10162-1015647622.htm |
| [8] | 胡华. 中药辨证结肠灌肠治疗痛风性肾病62例临床疗效观察[J]. 四川中医, 2015, 33(11): 54–56. |
| [9] | 龚国琴, 张莉萍. 当归拈痛丸治疗痛风性肾病疗效及对血肌酐、尿素氮水平影响[J]. 中国生化药物杂志, 2017, 37(9): 62–64. |
| [10] | 霍河水. 丹参多酚酸盐联合激素治疗对痛风性关节炎患者血尿酸及骨代谢和血液高凝状态的影响[J]. 慢性病学杂志, 2017(7): 1–5. |
| [11] | 蓝伦礼, 江滨, 刘梦楚, 等. 不同剂量酵母和腺嘌呤诱导大鼠痛风性肾病模型的建立比较[J]. 中国比较医学杂志, 2017, 27(2): 33–43. |
| [12] | 张海波, 王德超. 痛风(痛风性关节炎)诊疗方案[EB/OL]. http://www.fengshi120.com/TongFeng/, 2017-10-24. |
| [13] | 张海波, 王德超. 痛风康复案例诊疗方案[EB/OL]. http://www.fengshi120.com/KangFuAnLi/, 2018-03-18. |
| [14] | 陈丽川, 张荒生, 喻志华. 痛风颗粒干预腺嘌呤、乙胺丁醇所致高尿酸性肾病模型大鼠肾脏形态学改变[J]. 中国组织工程研究, 2012, 16(28): 5260–5263. |
| [15] | 高双荣, 马卫国, 商学征, 等. 复方青秦对痛风性肾病大鼠肾组织病理学的影响[J]. 中国实验方剂学杂志, 2012, 18(10): 183–186. DOI:10.3969/j.issn.1005-9903.2012.10.051 |
| [16] | 黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004(9): 1069–1072. |
| [17] | 张扬. 复方中药组方对高尿酸血症影响的研究[J]. 中国医院用药评价与分析, 2016, 16(3): 360–363. |
| [18] | Lee HP, Huang SY, Lin YY, et al. Soft coral-derived lemnalol alleviates monosodium urate-induced gouty arthritis in rats by inhibiting leukocyte infiltration and iNOS, COX-2 and c-Fos protein expression[J]. Mar Drugs, 2013, 11(12): 99–113. DOI:10.3390/md11010099 |
| [19] | 马新路. 痛风的药物治疗新进展[J]. 继续医学教育, 2017, 31(9): 151–152. |
| [20] | 杨会军, 彭江云, 陈艳林, 等. 抗急性痛风性关节炎天然产物药理研究进展[J]. 中国实验方剂学杂志, 2016, 22(3): 225–230. |
| [21] | 朱俭, 王英丽, 魏江波. 痛风急性期中药的治疗优势[J]. 中华针灸电子杂志, 2016, 5(1): 42–44. |
| [22] | 廖光惠. 痛风的发病机制与治疗研究进展[J]. 中外医学研究, 2017, 15(8): 161–163. |
| [23] | 黄敬群, 王军, 尹中信, 等. 槲皮素、别嘌醇对高尿酸血症大鼠血清尿酸水平及肝、肾功能影响的对比研究[J]. 中国药科大学学报, 2015, 46(4): 458–463. DOI:10.11665/j.issn.1000-5048.20150412 |
| [24] | 周云. 金线莲的化学成分、药理活性及临床应用研究进展[J]. 继续医学教育, 2017, 31(8): 154–155. |
| [25] | 张勇, 温蕾. 滋阴健肾方联合西医治疗肝肾阴虚型痛风性关节炎的疗效[J]. 解放军医学杂志, 2017, 42(12): 1110–1111. DOI:10.11855/j.issn.0577-7402.2017.12.17 |
 2018, Vol. 44
2018, Vol. 44


