扩展功能
文章信息
- 李天柱, 王加茹, 张俊毅, 王洪权, 史铁伟, 周静, 白春英, 金成浩
- LI Tianzhu, WANG Jiaru, ZHANG Junyi, WANG Hongquan, SHI Tiewei, ZHOU Jing, BAI Chunying, JIN Chenghao
- ELK-3蛋白在肝癌组织中的表达及其对肝癌HepG2细胞迁移和侵袭能力的影响
- Expression of ELK-3 protein in hepatocellular carcinoma tissue and its effects on migration and invasion abilities of HepG2 cells
- 吉林大学学报(医学版), 2018, 44(04): 736-740
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 736-740
- 10.13481/j.1671-587x.20180408
-
文章历史
- 收稿日期: 2017-10-16
2. 黑龙江八一农垦大学生命科学技术学院生物化学与分子生物学教研室, 黑龙江 大庆 163319
2. Department of Biochemistry and Molecular Biology, College of Life Science & Technology, Heilongjiang Bayi Agricultural University, Daqing 163319, China
肝癌可分为原发性和继发性两大类,是世界病死率较高的疾病之一,病死率居全球恶性肿瘤第3位,具有恶性程度高、易复发和易转移的特点[1-3]。肝癌的转移是一个复杂的过程,涉及大量基因异常表达以及相关信号通路的异常[4]。而上皮-间质转化(epithelial-mesenchymal transition,EMT)在肝癌细胞的侵袭和转移中扮演重要的角色[5-6]。转录因子ELK-3(又称Net)是Ras-MAPK信号通路下游靶点,在生理和病理过程中起重要作用,如伤口愈合、细胞迁移及新血管生成等[7-8]。研究[9]显示:干扰ELK-3会导致p38基因表达水平降低,E-钙黏蛋白(E-cadherin)表达水平升高,波形蛋白(vimentin)表达水平降低,进而抑制人肝癌细胞的EMT过程。本文作者在前期研究[10]的基础上发现:干扰ELK-3对人肝癌细胞的EMT过程具有抑制作用,但其是否通过调控EMT的作用对肝癌细胞的侵袭和转移产生影响,目前尚未报道。本研究通过观察肝癌组织中ELK-3蛋白表达与肝癌患者临床病理特征的关系,探讨ELK-3在肝癌发生发展和转移过程中的作用以及干扰ELK-3对肝癌HepG2细胞迁移、侵袭能力的影响。
1 材料与方法 1.1 临床资料选取2013年3月—2016年5月在赤峰学院附属医院手术切除的原发性肝癌患者肿瘤及癌旁(肿瘤外5 cm)新鲜术后组织18例,其中男性10例,女性8例,年龄42~75岁,平均年龄(52.4±9.3)岁。标本取出后立即放置在-80℃冰箱中保存,以供Western blotting实验使用。所有患者术前均未接受放化疗,并签署知情同意书。石蜡组织标本选自赤峰学院附属医院病理库:肝癌组织80例,其中男性60例,女性20例,年龄42~75岁,平均年龄(53.6±8.7)岁;癌旁正常组织49例,其中男性31例,女性18例,年龄42~75岁,平均年龄(51.8±9.5)岁。石蜡组织标本供免疫组织化学染色实验使用。
1.2 细胞和主要试剂人肝癌细胞系HepG2(中科院上海细胞库)。DMEM培养基和胎牛血清(美国Gibco公司),LipofectamineTM 2000(美国Invitrogen公司),BCA-100蛋白质定量试剂盒(上海申能博彩生物科技有限公司),RIPA蛋白裂解液(上海碧云天生物技术有限公司),ECL化学发光检测试剂盒(北京康维世纪公司),0.25%胰蛋白酶(杭州吉诺生物公司),ELK-3 siRNA(美国Santa Cruz Biotechnology公司),ELK-3(美国Abcam公司),β-actin(美国Sigma公司),TranswellTM迁移小室(美国Becton Dickinson Labware公司)
1.3 细胞培养肝癌HepG2细胞,培养基为含10% FBS胎牛血清的DMEM,在饱和湿度、37℃、5% CO2培养箱中培养。
1.4 免疫组织化学染色切片经二甲苯脱水,梯度乙醇复水,柠檬酸钠缓冲液微波修复,3% H2O2阻断后PBS冲洗3次,加入兔抗人ELK-3抗体(1:500),4℃孵育过夜。二抗37℃孵育30 min,DAB显色,苏木精复染,脱水、透明,以PBS代替一抗作为阴性对照。切片在200倍显微镜下取5个视野,统计阳性细胞在每个视野中所占的比例。ELK-3蛋白阳性表达率=阳性细胞数/癌细胞总数×100%,5个视野的阳性表达率平均值为该张切片的阳性表达率。表达率≥10%以上为阳性,反之为阴性。
1.5 Western blotting法检测采用RIPA裂解缓冲液(强)冰上裂解肝癌组织,BCA法测定蛋白浓度,每个样品取30 μg上样,10% SDS-PAGE,将蛋白转移至PVDF膜上,用含5%脱脂乳封闭1 h,与ELK-3抗体(稀释比例1:1000)结合,4℃摇床孵育过夜。经TBST洗涤3次,加入HRP标记的相应二抗(稀释比例1:1000),37℃孵育1 h,TBST洗涤3次,加入ECL显色,采用化学发光成像仪检测目的蛋白的相对表达水平,内参采用β-actin。目的蛋白的表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.6 小干扰RNA(siRNA)转染实验设立对照组(control-siRNA)和ELK-3干扰组(ELK-3-siRNA)。转染前,将HepG2细胞以2×105/孔接种于6孔板中,并将细胞培养基换成不含血清和抗生素的新鲜培养基,再按LipofectamineTM 2000说明书进行操作。
1.7 划痕实验检测各组细胞迁移能力将成功转染ELK-3的ELK-3-siRNA组和对照组细胞进行重悬,分别接种于24孔板。细胞铺满单层后用小枪头于孔中央划1条线,在0和48 h对划痕情况进行观察并照相,采用Image J测量2组细胞迁移距离(单位:μm),实验重复3次。
1.8 Transwell小室检测各组细胞侵袭能力细胞重悬,上室加入100 μL各细胞悬液,细胞数为1×105个,下室加入600 μL DMEM完全培养液。48 h后弃去上下室培养基,棉签擦拭上室细胞。10%甲醛固定细胞30 s后,用苏木精染色3 min,用锋利刀片沿边缘将小室膜切下,采用倒置显微镜(×200)和细胞计数器,对5个视野的穿膜细胞进行计数,比较2组细胞的穿膜细胞数(单位:个),实验重复3次。
1.9 统计学分析采用Sigma Plot 2000软件进行统计学分析。ELK-3蛋白表达水平、细胞迁移距离和穿膜细胞数均以x±s表示,2组间比较采用t检验。不同临床病理特征肝癌患者肝癌组织中ELK-3蛋白阳性表达率以百分率表示,组间比较采用χ2检验。以P<0.05表示差异有统计学意义。
2 结果 2.1 不同临床病理特征肝癌患者肝癌组织中ELK-3蛋白阳性表达率ELK-3蛋白主要表达于肝癌组织和癌旁正常组织的细胞质中,呈褐色,且肝癌组织中ELK-3蛋白阳性表达率明显高于癌旁正常组织(P<0.05),见图 1(插页二)和表 1。ELK-3阳性表达率与肝癌患者肿瘤数、TNM分期、Edmondson分级和门静脉浸润有关联(P<0.05)。见表 2。
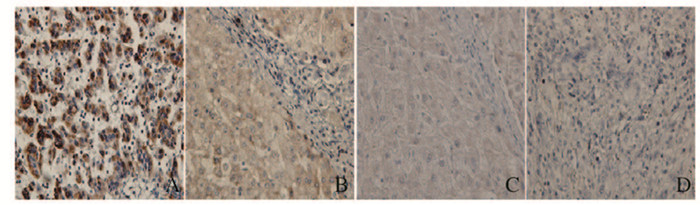
|
| A: High expression of ELK-3 in hepatocellular carcinoma tissue; B: Low expression of ELK-3 in hepatocellular carcinoma tissue; C: Low expression of ELK-3 in para-carcinoma tissue; D; Negative control. 图 1 免疫组织化学染色检测肝癌和癌旁组织中ELK-3蛋白表达(×400) Figure 1 Expressions of ELK-3 protein in hepatocellular carcinoma tissue and para-carcinoma tissue detected by immunohistochemistry staining(× 400) |
|
|
| [n(η/%)] | |||
| Group | n | Positive | Negative |
| Para-carcinoma tissue | 49 | 21(42.9) | 27(55.1) |
| HCC tissue | 80 | 56(70.0)* | 24(30.0) |
| *P<0.05 compared with para-carcinima tissue. | |||
| Clinicopathologic feature | n | Positive expression of ELK-3 | P | |
| Number | Rate (%) | |||
| Age (year) | ||||
| ≥50 | 52 | 40 | 76.9 | 0.875 |
| < 50 | 28 | 16 | 57.1 | |
| Sex | ||||
| Male | 60 | 41 | 68.3 | 0.721 |
| Female | 20 | 15 | 75.0 | |
| Tumor size | ||||
| ≥5 cm | 49 | 35 | 71.4 | 0.132 |
| < 5 cm | 31 | 21 | 67.7 | |
| Tumor number | ||||
| Solitary | 51 | 38 | 74.5 | 0.036 |
| Multiple | 29 | 18 | 62.1 | |
| Edmondson | ||||
| Ⅰ+Ⅱ | 27 | 22 | 81.5 | 0.015 |
| Ⅲ+Ⅳ | 53 | 34 | 64.2 | |
| TNM stage | ||||
| Ⅰ+Ⅰ | 56 | 40 | 71.4 | 0.023 |
| Ⅲ+Ⅳ | 24 | 16 | 66.7 | |
| Venous infiltration | ||||
| Present | 22 | 13 | 59.1 | 0.019 |
| Absent | 58 | 43 | 74.1 | |
| AFP | ||||
| ≥400 μg·L-1 | 47 | 33 | 70.2 | 0.562 |
| 400 μg·L-1 | 33 | 23 | 69.7 | |
| HBsAg | ||||
| Negative | 24 | 19 | 79.2 | 0.473 |
| Positive | 56 | 37 | 66.1 | |
采用Western blotting法对肝癌组织和癌旁正常组织中的ELK-3蛋白表达水平进行检测,肝癌患者肝癌组织中ELK-3蛋白表达水平(91.2±4.5)明显高于癌旁正常组织(48.7±2.4)(P<0.05)。见图 2。

|
| Lane 1: Para-carcinoma tissue; Lane 2: HCC tissue. 图 2 Western blotting法检测肝癌患者肝癌组织和癌旁组织中ELK-3蛋白表达电泳图 Figure 2 Electrophoregram of expressions of ELK-3 protein in HCC tissue and para-carcinoma tissue detected by Western blotting method |
|
|
细胞进行划痕处理48 h后,ELK-3-siRNA组细胞迁移距离为(40.0±5.6)μm,对照组细胞迁移距离为(210.0±5.6)μm。与对照组比较,ELK-3-siRNA组细胞迁移距离明显缩短(P<0.05)。见图 3。
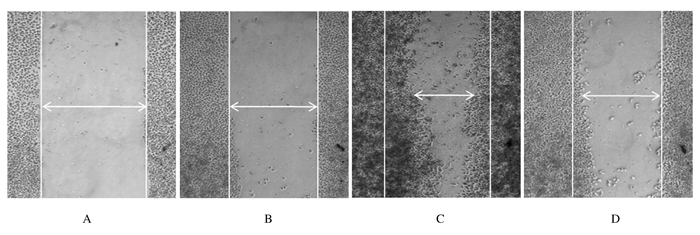
|
| A, B: 0 h; C, D: 48 h; A, C: Control-siRNA group; B, D: ELK-3-siRNA group. 图 3 划痕实验48 h后2组细胞的迁移情况(×100) Figure 3 Migration of cells 48 h after wound-healing assay in two groups (×100) |
|
|
细胞侵袭48 h后,ELK-3-siRNA组穿膜细胞数为(26±3)个,对照组穿膜细胞数为(58±5)个,ELK-3-siRNA组穿膜细胞数明显少于对照组(P<0.05)。见图 4(插页二)。
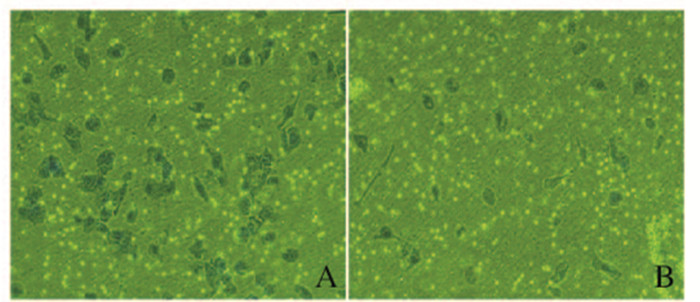
|
| A: Control-siRNA group; B: ELK-3-siRNA group. 图 4 Transwell侵袭实验检测2组细胞48 h穿膜细胞数(×200) Figure 4 Number of cells passing membrane in two group after 48 h detected by Trans well invasion assay(×200) |
|
|
系统研究肝癌的发生发展机制、寻找新的特异性肝癌分子标志物可以为肝癌的诊断和治疗提供新的思路和治疗策略[11]。研究[12]表明:EMT现象普遍存在于肝癌发生发展过程中,并与肝癌的侵袭和迁移有密切关联。肿瘤的转移是导致肿瘤患者死亡的重要原因之一,通过抑制EMT过程可改变肿瘤细胞的转移能力,发挥抗肿瘤作用[13-14]。
ELK-3、ELK-1和Sap-1形成三元复合物的转录因子家族(ternary complex transcription factor subfamily,TCF),在静止期细胞受到生长因子的刺激时参与早期反应[15]。本文作者前期研究[9]显示:ELK-3蛋白在人肝癌细胞中的表达高于正常肝细胞,干扰ELK-3通过下调P38蛋白表达水平抑制人肝癌细胞的EMT。上述结果同样出现在本实验中,ELK-3蛋白在肝癌组织中的表达水平明显高于癌旁组织,同样具有抑制EMT的作用,且ELK-3表达与肝癌患者肿瘤数、TNM分期、Edmondson分级和门静脉浸润有关联。
EMT作为肿瘤迁移过程中的重要阶段,尤其是在即将发生迁移现象的运动细胞的前缘出现频率最高[16-17]。划痕实验和Transwell小室实验[18-20]显示:柴胡皂苷D可以通过改变EMT抑制人成骨肉瘤细胞MG-63的迁移和侵袭,miR-34a也可以通过EMT转化调节肺癌细胞侵袭和迁移能力,同时ELK-3具有调节淋巴管内皮细胞的迁移和血管生成等生物学效应。结合上述研究结果,本文作者推测:干扰ELK-3也可以减弱细胞的EMT作用,从而抑制肝癌细胞的迁移和侵袭能力。本研究利用相同的实验方法检测结果显示:与对照组比较,ELK-3-siRNA组细胞的迁移距离变短,穿膜细胞数减少,侵袭能力降低,表明干扰ELK-3可以降低肝癌细胞的侵袭和迁移能力,从而抑制癌细胞的转移。
综上所述,ELK-3蛋白表达与肝癌患者病理特征有密切关联,在肝癌的发生发展和癌细胞的EMT过程中发挥重要作用,因此ELK-3可能成为新的肝癌分子标志物及生物治疗靶点。本研究结果为肝癌治疗提供了新的理论依据。
| [1] | Hernandez-Gea V, Toffanin S, Friedman SL, et al. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma[J]. Gastroenterology, 2013, 144(3): 512–527. DOI:10.1053/j.gastro.2013.01.002 |
| [2] | 吴军宜. 肝癌防治的临床研究进展[J]. 心理医生, 2018, 24(2): 7. |
| [3] | 崔银星, 孔菲, 赵旭, 等. O-GlcNAc转移酶在肝细胞癌组织中的表达及其临床意义[J]. 吉林大学学报:医学版, 2017, 43(5): 980–984. |
| [4] | 彭文婷, 孙妩弋, 孙家昌, 等. 人参皂苷CK对人肝癌细胞HepG2迁移及侵袭的影响[J]. 中国药理学通报, 2018, 34(1): 27–32. |
| [5] | Ding W, You H, Dang H, et al. Epithelial-to-mesenchymal transition of murine liver tumor cells promotes invasion[J]. Hepatology, 2010, 52(3): 945–953. DOI:10.1002/hep.23748 |
| [6] | Sun Y, Song GD, Sun N, et al. Slug overexpression induces stemness and promotes hepatocellular carcinoma cell invasion and metastasis[J]. Oncol Lett, 2014, 7(6): 1936–1940. DOI:10.3892/ol.2014.2037 |
| [7] | Wasylyk C, Zheng H, Castell C, et al. Inhibition of the Ras-Net (Elk-3) pathway by a novel pyrazole that affects microtubules[J]. Cancer Res, 2008, 68(5): 1275–1283. DOI:10.1158/0008-5472.CAN-07-2674 |
| [8] | Buchwalter G, Gross C, Wasylyk B. The ternary complex factor Net regulates cell migration through inhibition of PAI-1 expression[J]. Mol Cell Biol, 2005, 25(24): 10853–10862. DOI:10.1128/MCB.25.24.10853-10862.2005 |
| [9] | 李天柱, 史铁伟, 周静, 等. 干扰ELK-3抑制人肝癌细胞的上皮-间质转换[J]. 基础医学与临床, 2017, 37(2): 211–216. |
| [10] | 李天柱, 崔凤姬, 王文涛, 等. 索拉菲尼通过调控ELK-3抑制人肝癌细胞的上皮-间质转化[J]. 赤峰学院学报:自然科学版, 2017, 33(2): 135–137. |
| [11] | He J, Huang Y, Liu Z, et al. Hypomethylation of BORIS is a promising prognostic biomarker in hepatocellular carcinoma[J]. Gene, 2017, 629(5): 29–34. |
| [12] | 李海军, 孟宪飞, 董志意, 等. CCN5对肝癌细胞系HepG2增殖、迁移和侵袭能力的影响及其作用机制[J]. 基础医学与临床, 2014, 34(3): 376–380. |
| [13] | 赵燕颖, 王秀岩, 秦国涛, 等. 血管内皮生长因子165b对人肝癌HepG2细胞生物学特性的影响[J]. 吉林大学学报:医学版, 2018, 44(1): 101–105. |
| [14] | Mani SA, Guo W, Liao MJ, et al. The epithelial-mesenchymal transition generates cells with properties of stem cells[J]. Cell, 2008, 133(4): 704–715. DOI:10.1016/j.cell.2008.03.027 |
| [15] | Buchwalter G, Gross C, Wasylyk B. Ets ternary complex transcription factors[J]. Gene, 2004, 324: 1–14. DOI:10.1016/j.gene.2003.09.028 |
| [16] | 谭松红, 孙晓红. EMT与宫颈癌的相关性研究进展[J]. 蛇志, 2017, 29(1): 84–86. |
| [17] | 洪琼川, 唐绮玲, 迈进, 等. TNF-α诱导人肺鳞癌细胞发生EMT促进转移的机制研究[J]. 中国当代医药, 2017, 24(16): 13–16. DOI:10.3969/j.issn.1674-4721.2017.16.004 |
| [18] | 张平安, 王晓伟, 郭向好. 柴胡皂苷D通过逆转EMT抑制人成骨肉瘤细胞MG-63的迁移和侵袭[J]. 现代肿瘤医学, 2017, 25(16): 2561–2564. DOI:10.3969/j.issn.1672-4992.2017.16.009 |
| [19] | 刘行仁, 白义凤, 梁良, 等. miR-34a通过Snail诱导肺癌EMT及促进其转移的分子机制[J]. 中国免疫学杂志, 2017, 33(5): 646–651. |
| [20] | Park JI, Kim KS, Kong SY, et al. Novel function of E26 transformation-specific domain-containing protein ELK3 in lymphatic endothelial cells[J]. Oncol Lett, 2018, 15(1): 55–60. |
 2018, Vol. 44
2018, Vol. 44


