扩展功能
文章信息
- 王娟, 刘文龙, 赵苒, 范春
- WANG Juan, LIU Wenlong, ZHAO Ran, FAN Chun
- 双酚A联合己烯雌酚对未成年雌性SD大鼠的雌激素效应
- Estrogenic effects of bisphenol A combined with diethylstilbestrol in immature female SD rats
- 吉林大学学报(医学版), 2018, 44(04): 731-735
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 731-735
- 10.13481/j.1671-587x.20180407
-
文章历史
- 收稿日期: 2018-01-04
2. 福建省厦门市妇幼保健院儿童发育行为科, 福建 厦门 361003;
3. 厦门大学公共卫生学院 分子疫苗学和分子诊断学国家重点实验室, 福建 厦门 361102
2. Children Development and Behavior Department, Xiamen Maternity and Child Health Hospital, Xiamen 361003, China;
3. School of Public Health, State Key Laboratory of Molecular Vaccinology and Molecular Diagnostics, Xiamen University, Xiamen 361102, China
环境雌激素(environmental estrogens, EEs)是广泛存在于自然界并能影响人类健康的一大类外源性化学物的总称,主要来自塑料增塑剂、洗涤剂和阻燃剂等化学制品,按其化学结构差异分为双酚类、烷基酚类和邻苯二甲酸酯类等。雌激素样污染物进入环境后,造成人群多途径混合暴露,并在生态系统中通过食物链蓄积,最终损害人类健康[1-2]。由于环境污染的复杂性和多样性,仅就单一物质评价EEs的危害效应是远远不够的[3-4]。从人群实际暴露情况来看,联合作用的研究对于深入了解EEs危害程度及危害机制均具有重要的现实意义,但目前相关报道较少。本研究拟选择具有雌激素样作用的双酚A (bisphenol A,BPA)和己烯雌酚(diethylstilbestrol,DES)作为受试物,采用子宫增重实验评价BPA和DES的联合雌激素效应,为深入探讨EEs对机体健康影响的作用机制提供理论依据。
1 材料与方法 1.1 实验动物和分组70只未成年雌性SD大鼠(21d),体质量30~40g,购自四川抗生素工业研究所(合格证:川实动管质第15号)。按改良配方,饲以不含植物雌激素的饲料。整个实验过程中,动物自由摄食和饮水,室温20℃~23℃,相对湿度50%~70%,12h/12h明暗周期。动物按体质量采用区组随机分组,根据预实验结果,分为200、400和800 mg·kg-1 BPA组,15和150 μg·kg-1 DES组,BPA+DES联合组(100 mg·kg-1 BPA + 7.5 μg·kg-1 DES,200 mg·kg-1 BPA + 7.5 μg·kg-1 DES,400 mg·kg-1 BPA + 7.5 μg·kg-1 DES,400 mg·kg-1 BPA + 75.0 μg·kg-1 DES),同时设花生油溶剂对照组,每组7只。
1.2 主要试剂BPA购自上海试剂一厂,DES购自美国Sigma公司,以市售花生油作为溶剂。
1.3 染毒方法各组大鼠根据分组情况,按1 mL·100 g-1灌胃给药,每天1次,连续给药3 d。给药期间每天称大鼠体质量,并按体质量调整给药量,观察阴道开口情况。于末次给药后24 h股动脉放血处死动物,迅速剥离子宫,在电子天平上称湿质量(结果以mg表示),以15%甲醛固定。
1.4 取材制片大鼠子宫固定3 d后,将子宫分为3段:输卵管端、宫体端和阴道端,于同一水平面垂直石蜡包埋。连续切片,厚5 μm,共3片/侧子宫角。染色后镜检。
1.5 染色方法① HE染色:按常规HE染色操作;②凡氏染色:采用苦味酸酸性复红法进行平滑肌特殊染色。
1.6 各组大鼠子宫形态计量① 宫腔上皮厚度:每组切片随机选择5个视野,200倍镜下观察,测量宫腔上皮高度,取平均值,结果以μm表示;②宫腔平滑肌厚度:每组切片随机选择5个视野,200倍镜下观察,测量宫腔平滑肌厚度,取平均值,结果以μm表示;③宫腔腺体数量:每组切片随机选择5个视野,计算5个视野的总面积,并统计其中的子宫腺体总数,计算单位面积下的子宫腺体数量,以个/μm2表示;④成熟卵泡数量:每组切片随机选择5个视野,计算5个视野的总面积,并统计其中的成熟卵泡总数,计算单位面积下的成熟卵泡数量,以个/μm2表示。
1.7 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组大鼠子宫湿质量、子宫/体质量比、子宫腔内膜上皮高度、宫腔平滑肌厚度、宫腔腺体数量和成熟卵泡数量均以x±s表示,多组间样本均数比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结果 2.1 各组大鼠一般情况和体质量变化单独或联合给予DES和BPA染毒,大鼠均出现活动减少、精神萎靡和被毛蓬松无光泽等表现,各组大鼠体质量增加与对照组比较差异均无统计学意义(P>0.05),实验过程中无大鼠死亡。见表 1。
| (n=7, x±s, m/g) | |||
| Group | Body weight | Increased weight | |
| Before exposure | After exposure | ||
| Control | 32.07±5.64 | 35.42±7.68 | 3.35±2.06 |
| BPA (mg·kg-1) | |||
| 200 | 34.27±7.87 | 39.62±8.62 | 5.35±1.85 |
| 400 | 34.66±7.96 | 32.28±5.55 | 2.62±1.54 |
| 800 | 35.87±7.01 | 39.62±14.72 | 4.75±3.14 |
| DES (μg·kg-1) | |||
| 15 | 32.60±3.18 | 36.38±7.96 | 3.78±1.01 |
| 150 | 36.11±6.13 | 39.83±10.50 | 3.72±1.40 |
| BPA(mg·kg-1) + DES (μg·kg-1) | |||
| 100.0+7.5 | 33.82±5.62 | 37.02±4.23 | 3.20±1.89 |
| 200.0+7.5 | 33.88±4.04 | 36.90±4.86 | 3.02±1.62 |
| 400.0+7.5 | 32.10±4.71 | 37.16±4.63 | 5.06±0.96 |
| 400.0+75.0 | 34.23±4.07 | 39.58±5.75 | 5.35±4.33 |
与对照组比较,800 mg·kg-1 BPA组大鼠子宫湿质量和子宫/体质量比明显增加(P<0.05);与对照组比较,各剂量DES组大鼠子宫不仅明显增大,而且出现水肿现象,随着剂量的增加,各剂量DES组大鼠子宫湿质量和子宫/体质量比明显增加(P<0.05)。同时给予BPA和DES染毒,与对照组比较,各剂量联合组大鼠子宫明显增大,子宫湿质量和子宫/体质量比明显增加(P<0.05),但与各剂量DES组比较差异均无统计学意义(P>0.05)。见表 2和图 1(插页一)。
| (n=7, x±s) | ||
| Group | Uterine weight (m/mg) |
Ratio of uterine weight to body weight (η/‰) |
| Control | 23.55±9.46 | 0.66±0.20 |
| BPA (mg·kg-1) | ||
| 200 | 28.00±9.84 | 0.66±0.11 |
| 400 | 34.40±6.88 | 0.92±0.10 |
| 800 | 44.50±10.95* | 1.09±0.23* |
| DES (μg·kg-1) | ||
| 15 | 128.60±32.99* | 3.59±0.88* |
| 150 | 134.33±41.85* | 2.99±1.22* |
| BPA(mg·kg-1) + DES (μg·kg-1) | ||
| 100.0+7.5 | 141.60±32.39* | 3.80±0.57* |
| 200.0+7.5 | 147.80±17.41* | 4.05±0.60* |
| 400.0+7.5 | 124.60±21.66* | 3.42±0.89* |
| 400.0+75.0 | 138.17±42.62* | 3.58±1.33* |
| *P < 0.05 compared with control group. | ||
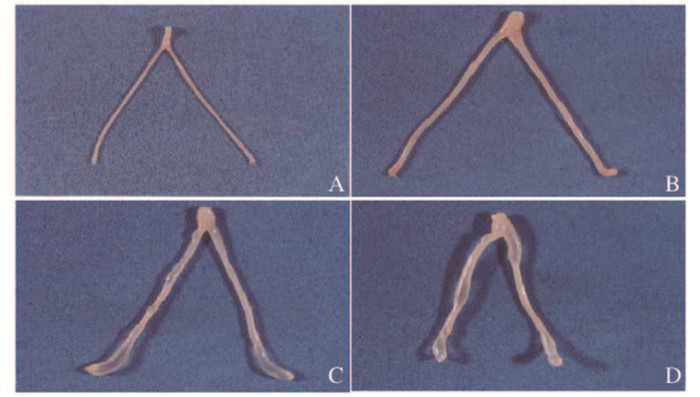
|
| A: Control group; B: 800 mg·kg-1 BP A group; C: 15 μg·kg-1 DES group; D: 400 mg·kg-1 BP A + 75 μg·kg-1 DES group. 图 1 各组大鼠子宫大体形态表现 Figure 1 Morphology of uterus of rats in various groups |
|
|
与对照组比较,800 mg·kg-1 BPA组大鼠子宫腔上皮高度增加,但仍为单层立方状上皮,宫腔平滑肌层变厚;各剂量DES组和各剂量联合组大鼠子宫腔上皮高度明显增加,表现为柱状上皮,子宫腔扩张,固有层和肌层分层好,平滑肌层明显增厚,平滑肌细胞特征明显,腺体数量增加(图 2,见插页一)。与对照组比较,800 mg·kg-1BPA组、各剂量DES组和各剂量联合组大鼠宫腔上皮高度、平滑肌层厚度和宫腔腺体数量均明显增加(P<0.05),但各剂量联合组与各剂量DES组比较差异均无统计学意义(P>0.05)。见表 3。
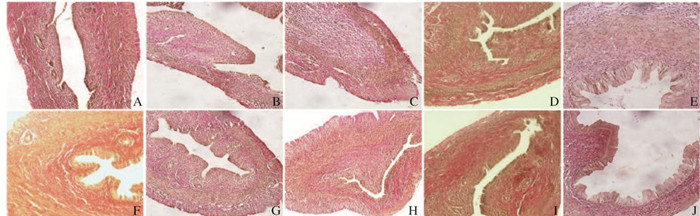
|
| A: Control group; B: 200 mg·kg-1 BPA group; C: 400 mg·kg-1 BP A group; D: 800 mg·kg-1 BPA group; E: 15 μg·kg-1 DES group; F; 150 μg·kg-1 DES group; G: 100 mg·kg-1 BPA + 7.5 μg·kg-1 DES group; H: 200 mg·kg-1 BP A + 7. 5 μg·kg-1 DES group; I: 400 mg·kg-1 BPA + 7.5 μg·kg-1 DES group; J: 400 mg·kg-1 BPA + 75 μg·kg-1 DES group. 图 2 各组大鼠子宫上皮组织病理形态表现(凡氏染色,×200) Figure 2 Pathomorphology of epithelium tissue of uterus of rats in various groups(V·G, ×200) |
|
|
| (n=7, x±s) | ||||
| Group | Height of luminal epithelium(l/μm) | Thickness of myometrium(l/μm) | Amount of uterine glands(μm-2) | Amount of mature follicle(μm-2) |
| Control | 11.76±3.08 | 49.87±6.12 | 1.33±0.58 | 1.33±0.58 |
| BPA (mg·kg-1) | ||||
| 200 | 14.40±4.21 | 55.39±14.88 | 1.00±0.52 | 1.33±1.16 |
| 400 | 14.86±2.21 | 58.52±2.49 | 1.33±0.53 | 1.67±0.58 |
| 800 | 21.33±3.56* | 85.78±10.41* | 3.33±0.58* | 2.67±0.58 |
| DES (μg·kg-1) | ||||
| 15 | 64.93±5.41* | 168.63±11.73* | 6.00±1.73* | 4.67±0.58* |
| 150 | 64.71±12.88* | 172.19±19.79* | 5.67±1.53* | 4.33±2.08* |
| BPA(mg·kg-1) + DES (μg·kg-1) | ||||
| 100.0+7.5 | 69.45±6.06* | 175.42±22.88* | 5.33±3.51* | 5.33±3.22* |
| 200.0+7.5 | 71.23±12.01* | 164.77±7.73* | 5.67±1.53* | 6.33±1.53* |
| 400.0+7.5 | 65.07±4.57* | 166.41±12.08* | 5.67±1.00* | 5.67±2.31* |
| 400.0+75.0 | 64.76±5.54* | 161.23±13.93* | 5.00±1.00* | 5.33±1.16* |
| *P < 0.05 compared with control group. | ||||
与对照组比较,各剂量BPA组大鼠成熟卵泡数量差异均无统计学意义(P>0.05),800mg·kg-1BPA组大鼠宫腔腺体数量增加(P<0.05),各剂量DES组大鼠宫腔腺体数量和成熟卵泡数量均明显增加(P<0.05)。与对照组比较,同时给予BPA和DES后,各联合组大鼠宫腔腺体数量和成熟卵泡数量明显增加(P<0.05),但与各剂量DES组比较差异均无统计学意义(P>0.05)。见表 3。
2.5 各组大鼠阴道开口情况单独或联合给予BPA和DES,各组大鼠阴道开口率均为0,说明实验过程中所有受试物均未使大鼠阴道开口提前,即所有受试物均未明显促进阴道的发育。
3 讨论子宫增重实验是筛检雌激素活性化合物体内试验的“金标准”。子宫含有丰富的雌激素受体,在未成年雌性大鼠子宫生长静止期(postnatal day, PND 17~26d)给予受试物即可以检测出雌激素样物质[5-6]。传统的子宫增重实验采用子宫湿(干)质量和子宫脏器系数作为检测终点。随着该方法的应用增多,人们发现雌激素除了能引起子宫质量增加外,还可以引起子宫组织和细胞水平的改变,故可通过测定宫腔上皮高度、宫腔平滑肌厚度和宫腔腺体数量等来评价外来化合物的雌激素样作用。本研究结果显示:单独给予800 mg·kg-1 BPA后,未成年雌性SD大鼠子宫增大,宫腔上皮高度和宫腔平滑肌厚度增加,宫腔腺体数量增加;单独给予DES染毒后,各剂量DES组大鼠子宫反应更为强烈,即使在15 μg·kg-1剂量组中,大鼠宫腔上皮也明显增高,上皮细胞从单层立方状变为柱状,平滑肌层厚度增加,出现了明显的平滑肌细胞特征,表明BPA和DES在本实验中均表现出了雌激素样作用,DES的雌激素活性远远大于BPA,至少为BPA雌激素活性的10 000倍,与国内外文献报道[7-8]一致。
随着EEs研究的逐渐深入,研究者发现某些物质在单独作用时雌激素活性很弱,但混合后却出现协同作用,尤其是“Something fromNothing”现象的出现引起了研究者对EEs联合毒性作用的关注[2, 9]。EEs种类繁多,造成人类处于混合暴露状态,由于联合作用机制尚不清楚,且研究结论[10-12]并不一致,因此加强EEs联合作用的研究十分必要。BPA是工业制造中一类重要的增塑剂,DES则是一种人工合成非甾体类雌激素,均可通过雌激素受体产生雌激素活性[13-14]。考虑到二者具有相似的作用机制,有学者[15-16]研究了低剂量BPA和DES的联合暴露效应,结果显示:BPA和DES的联合暴露对雄性大鼠睾丸及附睾有明显毒害作用,对大鼠精子活动能力及激素水平也有明显的影响,呈现出联合效应。为了进一步深入探讨BPA和DES的联合作用,本研究采用子宫增重实验对BPA和DES的联合雌激素效应进行了评价,结果显示:各剂量联合组大鼠子宫湿质量、子宫/体质量比、子宫腔内膜上皮高度和平滑肌厚度与单独应用DES组比较差异无统计学意义,说明在本实验条件下BPA和DES联合后并未出现协同或拮抗效应,仅为简单的相加作用。如果2种毒物作用机制相同,联合后常表现为协同作用;若作用机制不同,其联合作用常表现为相加作用。BPA和DES可通过相同途径产生作用,其相加作用可能由于DES在单独作用时已表现出很强的雌激素活性,子宫均出现水肿现象,即DES在15 μg·kg-1剂量时其活性已达到最大值,活性不会再随着剂量的增加而增大,甚至达到某一剂量时反而出现抑制,故可能DES完全掩盖BPA的效应,联合后表现为相加作用。
由于EEs作用途径众多,作用机制复杂,要了解环境化合物的雌激素效应及其与疾病发生的关系,应结合更多的体内外实验研究和流行病学调查资料才能作出正确评价。
| [1] | Maqbool F, Mostafalou S, Bahadar H, et al. Review of endocrine disorders associated with environmental toxicants and possible involved mechanisms[J]. Life Sci, 2016, 145(2): 265–273. |
| [2] | 季晓亚, 李娜, 袁圣武, 等. 环境雌激素生物效应的作用机制研究进展[J]. 生态毒理学报, 2017, 12(1): 38–51. |
| [3] | Yang R, Li N, Ma M, et al. Combined effects of estrogenic chemicals with the same mode of action using an estrogen receptor binding bioassay[J]. Environ Toxicol Pharmacol, 2014, 38(3): 829–837. DOI:10.1016/j.etap.2014.10.001 |
| [4] | Samardzija Nenadov D, Pogrmic-Majkic K, Fa S, et al. Environmental mixture with estrogenic activity increases Hsd3b1 expression through estrogen receptors in immature rat granulosa cells[J]. J Appl Toxicol, 2018. DOI:10.1002/jat.3596 |
| [5] | Kanji Y, Masahino T, Yoshikuni Y, et al. Comparison of the reporter gene assay for ER-alpha antagonists with the immature rat uterotrophic assay of 10 chemicals[J]. Toxicol Lett, 2003, 142(1): 119–131. |
| [6] | Clode SA. Assessment of in vivo assays for endocrine disruption[J]. Best Pract Res Clin Endocrinol Metab, 2006, 20(1): 35–43. DOI:10.1016/j.beem.2005.09.011 |
| [7] | Srivastava S, Gupta P, Chandolia A, et al. Bisphenol A:a threat to human health[J]. J Environ Health, 2015, 77(6): 20–26. |
| [8] | Chen MJ, Zhang J, Pang SC, et al. Evaluating estrogenic and anti-estrogenic effect of endocrine disrupting chemicals (EDCs) by zebrafish (Danio rerio) embryo-based vitellogenin 1(vtg1) mRNA expression[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2018, 204: 45–50. DOI:10.1016/j.cbpc.2017.11.010 |
| [9] | Silva E, Rajapakse N, Kortenkamp A. Something from "nothing"-eight weak estrogenic chemicals combined at concentrations below NOECs produce significant mixture effects[J]. Environ Sci Technol, 2002, 36(8): 1751–1756. DOI:10.1021/es0101227 |
| [10] | Rajapakse N, Silva E, Kortenkamp A. Combining xenoestrogens at levels below individual no-observed-effect concentration dramatically enhances steroid hormone action[J]. Environ Health Perspect, 2002, 110(9): 917–921. DOI:10.1289/ehp.02110917 |
| [11] | 郑丽舒, 金一和, 靳翠红, 等. 双酚A和β-六氯环己烷对小鼠雌激素活性的实验研究[J]. 中国公共卫生, 2002, 18(8): 922–924. DOI:10.11847/zgggws2002-18-08-14 |
| [12] | 何颖, 张晖, 甄士琪, 等. 邻苯二甲酸酯类雌激素活性联合作用模型分析[J]. 生态毒理学报, 2017, 12(3): 739–746. |
| [13] | Kolatorova L, Vitku J, Hampl R, et al. Exposure to bisphenols and parabens during pregnancy and relations to steroid changes[J]. Environ Res, 2018, 163: 115–122. DOI:10.1016/j.envres.2018.01.031 |
| [14] | 郝兴霞, 张东泽, 于泊洋, 等. 双酚A对成年雄性小鼠的生殖毒性及其作用机制[J]. 吉林大学学报:医学版, 2016, 42(2): 195–199. |
| [15] | 陈洪强, 姜晓, 刘文斌, 等. BPA、DES及联合暴露对雄性大鼠生殖毒性的研究[J]. 毒理学杂志, 2015, 29(4): 270–273. |
| [16] | Jiang X, Chen HQ, Cui ZH, et al. Low-dose and combined effects of oral exposure to bisphenol A and diethylstilbestrol on the male reproductive system in adult Sprague-Dawley rats[J]. Environ Toxicol Pharmacol, 2016, 43: 94–102. DOI:10.1016/j.etap.2016.02.014 |
 2018, Vol. 44
2018, Vol. 44


