扩展功能
文章信息
- 李鑫, 马云飞, 唐庚, 韦麒, 纪红池, 田嘉安, 申延男, 王志成
- LI Xin, MA Yunfei, TANG Geng, WEI Qi, JI Hongchi, TIAN Jiaan, SHEN Yannan, WANG Zhicheng
- 线粒体靶向KillerRed诱导的ROS增强辐射对HeLa细胞的增殖抑制作用
- Enhancement of ROS induced by mitochondria-targeted KillerRed in proliferation inhibition of radiation on HeLa cells
- 吉林大学学报(医学版), 2018, 44(04): 718-723
- Journal of Jilin University (Medicine Edition), 2018, 44(04): 718-723
- 10.13481/j.1671-587x.20180405
-
文章历史
- 收稿日期: 2017-12-04
宫颈癌是严重威胁健康与生命的最常见的妇科恶性肿瘤,发展中国家宫颈癌病例数约占全球宫颈癌的85% [1-2]。放射治疗(简称放疗)是宫颈癌常用的治疗手段之一,通过诱导宫颈癌细胞凋亡可以增强其放疗效果。活性氧(reative oxygen species,ROS)是一组高活性的氧分子及其衍生物,在生理条件下,低水平ROS的生成被认为是信号分子,但过量ROS则会诱导氧化损伤,导致肿瘤细胞凋亡或坏死[3-5]。线粒体既是ROS的产生部位,也是ROS的作用靶点。ROS作用线粒体后,可以诱导线粒体损伤,进而导致细胞凋亡。KillerRed(KR)蛋白是一种能够产生红色荧光以二聚体形式存在的蛋白,在540 ~ 580 nm光照时可以产生致细胞损伤的ROS,同时使蛋白失去活性[6-7]。本文作者利用线粒体靶向蛋白选择性雄激素受体调节剂1(selective androgen receptor modulator 1,Sarm1)的线粒体定位序列与KR形成融合蛋白序列,实现线粒体的靶向性,进而诱导ROS大量产生,探讨其联合电离辐射后对HeLa细胞的增殖抑制作用,为宫颈癌的放疗增敏提供新思路。
1 材料与方法 1.1 细胞、主要试剂和仪器人宫颈癌HeLa细胞(本实验室保存),MEM完全培养基(Gibico公司,美国),Hieff TransTM脂质体核酸转染试剂(上海翊圣生物科技有限公司),青霉素和链霉素(ThermoFisher Scientific公司,美国),ROS测试盒(南京建成生物工程研究所);CCK-8检测试剂盒(MedChemExpress公司,美国),Q5 PCR扩增试剂盒(NEB公司,美国),引物和DNA连接酶(TaKaRa公司,大连),细胞色素C氧化酶Ⅳ(COX Ⅳ)兔多克隆一抗和抗兔二抗(绿色荧光)(Santa Cruz公司,美国),其他试剂均为国产分析纯。细胞成像微孔板检测仪Cytation3(Biotek公司,美国),X射线辐照仪X-RAD 320iX(Precision X-ray Inc公司,美国)。
1.2 质粒构建在GenBank中查阅小鼠Sarm1基因的线粒体定位序列并设计引物,同时设计KR和mCherry引物(下划线部分为酶切位点),因KR蛋白光照后失去活性,不适用于荧光观察,因此以mCherry红色荧光代替KR进行线粒体靶向鉴定。Sarm1引物:F (Not Ⅰ) 5′-AAGGAAAAAAGCGGCCGCAATGGTCCTGACGCTG-3′,R (EcoR Ⅰ) 5′-CGGAATTCCCGATCGGCGCCCGGCCGTG-3′;mCherry引物:F (EcoRⅠ) 5′-GGAATTCGCCACCATGGTGAGCAAGGG,R(BamHⅠ)5′-CGGGATCCTTACTTGTACAGCTCGTCCATG-3′;KR引物:F(EcoRⅠ) 5′-GGAATTCATGGGTTCAGAGGGC-3′,R (BamHⅠ) 5′-CGGGATCCCTAGATCTCGTCG-3′。分别以pGw1-myc-Sarm1质粒、plxsp-TetA-mCherry和plxsp-TetA-KR质粒为模板PCR扩增Sarm1、mCherry和KR片段,plxsp-flag空载体行EcoRⅠ和BamHⅠ双酶切,将mCherry插入后构建plxsp-flag-mCherry载体, 测序鉴定正确后,再进行NotⅠ和EcoRⅠ双酶切,将Sarm1序列插入后构建plxsp-flag-sarm1-mCherry,测序鉴定正确后进行EcoRⅠ和BamHⅠ双酶切,将KR序列插入后构建plxsp-flag-Sarm1-KR载体,测序进行鉴定。
1.3 实验分组HeLa细胞分为对照组、plxsp-flag组、plxsp-flag-Sarm1-KR组、4 Gy组、plxsp-flag+4 Gy组和plxsp-flag-Sarm1-KR+4 Gy组。无菌条件下避光采用可见光源照射细胞,时间为10、30和60 min;X射线照射条件:电压180 kV,电流12.0 mA,靶皮距70 cm,剂量率1.0 Gy·min-1,单次照射剂量为4 Gy。
1.4 融合蛋白线粒体靶向性鉴定因KR蛋白光照后即丧失活性,产生ROS,不适于进行荧光显微镜观察,以与其氨基酸序列基本一致的红色荧光蛋白mCherry进行线粒体靶向性鉴定。将HeLa细胞按照每孔2×105个细胞接种于铺有盖玻片的6孔板中,待细胞80%融合后将plxsp-flag-Sarm1-mCherry质粒转染HeLa细胞,36 h后取出载玻片进行免疫荧光染色,以COX Ⅳ一抗作为线粒体定位标记(mito-track),荧光显微镜照相并进行分析。
1.5 ROS生成水平检测HeLa细胞达到80%融合后,0.25%胰酶消化,加入含有10% FBS无抗生素的MEM稀释,按照每孔0.8×104个细胞接种到96孔板中,每孔加入质粒0.2 μg、转染试剂0.2 μL,转染结束后用锡纸包裹96孔板,避光在37℃、5% CO2条件下培养24 h,转染结束后加入完全培养基100 μL,进行可见光照射,分别于照射后10、30和60 min加入DCFH-DA探针标记,并上机检测,以平均荧光强度(mean fluoresencence intensity,MFI)表示ROS生成水平,实验设6复孔。
1.6 酶标仪检测细胞增殖活性按照每孔0.8×104个细胞接种于96孔板,避光培养于培养箱内,质粒转染后24 h进行可见光照射,12 h后进行4 Gy X射线照射,计为0 h,分别于4、10、24和48 h后,每孔加入10 μL CCK-8试剂,继续培养1.5 h,轻轻震荡后采用酶标仪在450 nm处检测各孔吸光度[A(450)]值,以A值表示各组细胞增殖活性,实验设6复孔。
1.7 统计学分析采用SPSS24.0统计软件进行统计学分析。各组细胞MFI和增殖活性以x±s表示,符合正态分布,两两比较采用Student’ s t检验。以P<0.05表示差异有统计学意义。
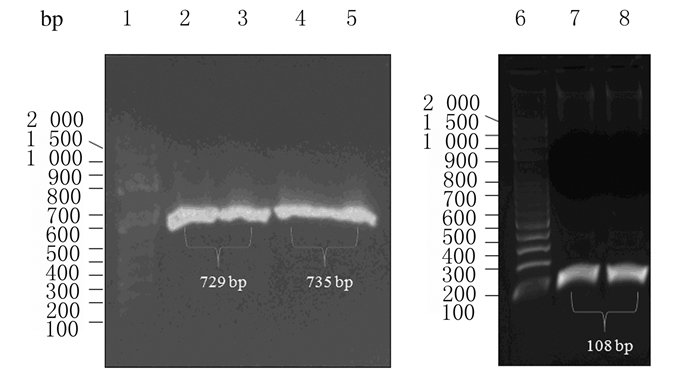
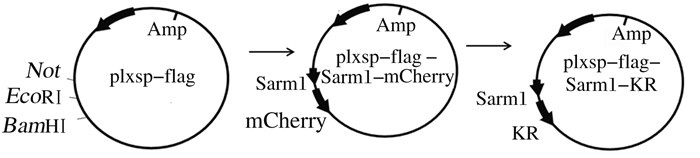
2 结果 2.1 plxsp-flag-KR载体构建PCR扩增获得mCherry、KR和Sarm1产物,长度分别为729、735和108 bp(图 1),经过酶切、DNA连接、产物转化、单克隆挑取、质粒小提和测序(美国Macrogen公司)后,将测序结果与GenBank中序列进行比对,序列完全一致,表明成功构建plxsp-flag-Sarm1-mCherry和plxsp-flag-Sarm1-KR质粒。构建过程见图 2。
|
| Lane 1, 6: 100 bp DNA marker; Lane 2, 3: mCherry PCR products; Lane4, 5: KR PCR product; Lane 7, 8: Sarm1 PCR product. 图 1 mCherry、KR和Sarm1 PCR扩增产物电泳图 Figure 1 Electrophoregram of PCR products of mCherry, KR and Sarm1 |
|
|
|
| 图 2 plxsp-flag-Sarm1-mCherry和plxsp-flag-Sarm1-KR质粒构建示意图 Figure 2 Diagram of construction plxsp-flag-Sarm1-mCherry and plxsp-flag-Sarm1-KR |
|
|
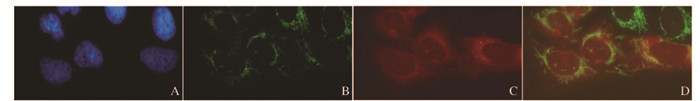
构建的plxsp-flag-Sarm1-mCherry载体转染HeLa细胞后,在细胞核(DAPI染蓝色)外线粒体部位可见COX Ⅳ蛋白表达(绿色荧光),而在相同位置可见mCherry蛋白表达(红色荧光),说明构建的载体能够成功定位于线粒体。见图 3(插页一)。
|
| A : DAPI; B : COX Ⅳ; C : mCherry; D : Merge. 图 3 荧光显微镜观察mCherry蛋白和线粒体示踪蛋白COX Ⅳ的表达(×400) Figure 3 Expressions of mCherry and mito-track COX Ⅳ proteins detected with fluorescent microscope (×400) |
|
|
质粒转染后避光培养24 h,对照组和plxsp-flag组可见光照射10、30和60 min后掺入探针,探针掺入10、30和60 min后细胞MFI无明显变化(P>0.05)。可见光照射10和30 min后掺入探针,plxsp-flag-Sarm1-KR组细胞MFI呈时间依赖性增加;与对照组比较,掺入探针60 min后plxsp-flag-Sarm1-KR组细胞MFI明显增加(P<0.05);可见光照射60 min后掺入探针,与对照组比较,掺入探针30和60 min后plxsp-flag-Sarm1-KR组细胞MFI明显降低(P<0.05)。见表 1。
| (n=6, x±s) | ||||
| Groups | Probe incorporation (t/min) |
MFI | ||
| Visble right exposure(t/min) 10 |
30 | 60 | ||
| Control | ||||
| 10 | 862.9±153.8 | 841.8±131.7 | 1 062.5±99.6 | |
| 30 | 810.3±184.2 | 985.5±10.2 | 1 031.9±143.5 | |
| 60 | 892.2±87.7 | 983.7±31.8 | 685.8±148.9 | |
| Plxsp-flag | ||||
| 10 | 891.8±146.1 | 874.0±164.9 | 1 001.8±179.9 | |
| 30 | 804.5±430.3 | 1 020.3±13.3 | 1 068.0±56.0 | |
| 60 | 807.2±58.4 | 985.9±23.1 | 703.2±170.6 | |
| Plxsp-flag-Sarm1-KR | ||||
| 10 | 496.3±235.0 | 975.4±33.5* | 785.8±156.4 | |
| 30 | 1 007.9±197.8 | 1 383.8±197.8 | 971.2±107.7* | |
| 60 | 1 354.3±276.2* | 1 058.3±27.5 | 574.4±36.1* | |
| *P<0.05 vs control group. | ||||
可见光照射30 min,12 h后行4 Gy X射线照射,与对照组比较,plxsp-flag组细胞增殖活性无明显变化(P>0.05);plxsp-flag-Sarm1-KR组细胞增殖活性在10和24 h时明显降低(P<0.05),4 Gy和plxsp-flag+4 Gy组细胞增殖活性在10 h时明显降低(P<0.01),plxsp-flag-Sarm1-KR+4 Gy组细胞增殖活性在10、24和48 h时明显降低(P<0.05或P<0.01)。与plxsp-flag-Sarm1-KR组和4 Gy组比较,plxsp-flag-Sarm1-KR +4 Gy组细胞增殖活性均明显降低(P<0.05)。见表 2。
| (n=6, x±s) | ||||
| Group | Proliferation activity | |||
| (t/h) 4 | 10 | 24 | 48 | |
| Control | 1.000±0.140 | 1.158±0.201 | 1.468±0.038 | 1.550±0.086 |
| Plxsp-flag | 1.027±0.064 | 1.014±0.090 | 1.461±0.192 | 1.560±0.247 |
| Plxsp-flag-Sarm1-KR | 0.706±0.111 | 0.982±0.053* | 1.341±0.147* | 1.491±0.269 |
| 4 Gy | 0.989±0.057 | 0.926±0.201** | 1.263±0.141 | 1.257±0.060 |
| Plxsp-flag+4 Gy | 0.843±0.095 | 0.818±0.093** | 1.143±0.130 | 1.235±0.146 |
| Plxsp-flag-Sarm1-KR+4 Gy | 0.867±0.135 | 0.879±0.013*# | 0.942±0.054**△# | 1.118±0.039**△# |
| *P < 0.05, * *P < 0.01 vs control group;△P < 0.05 vs plxsp-flag-Sarm1-KR group;#P < 0.05 vs 4 Gy group. | ||||
目前,肿瘤常规的治疗手段包含手术、放疗和化疗。放疗是中晚期宫颈癌患者主要治疗方法,但由于肿瘤对放疗的抵抗和耐受的存在,其效果并不尽如人意。为缓解放疗抵抗,提高放疗效果,放疗增敏剂应运而生,临床医生为增强放射线对肿瘤细胞的杀伤效应,常在放疗时合并使用一些化学药物或采用一些物理方法等,包括化学药物、靶向基因或者传统中药等。基于ROS作用线粒体后可以诱导细胞发生凋亡、自噬和线粒体DNA损伤,外源性ROS也可以作为放疗增敏剂,通过一定的策略增加其产量,诱导肿瘤细胞凋亡,更有效地提高放疗的疗效[8-12]。诱导ROS产生也是肿瘤光动力治疗(photodymamic therapy,PDT)的基本原理,即利用光敏剂在可见光的照射下,导致ROS的产生,继而作用于细胞,产生细胞杀伤。因此,肿瘤的PDT与放疗联合应用将具有良好的前景。
ROS是一类化学性质活泼,具有较高氧化活性的分子或离子,过量的ROS会对蛋白质、核酸和脂质等生物大分子造成损伤,从而影响其正常生理生化功能。ROS作用于线粒体后,损害线粒体的完整性,诱使蛋白修饰,引起脂质过氧化和线粒体DNA(mtDNA)的损伤,可能导致膜去极化,电位耗散,引起细胞线粒体内细胞色素c(Cyt c)、凋亡诱导因子(AIF)和Smac等促凋亡蛋白释放,诱导细胞凋亡[13]。同时,线粒体激酶Pink(PTEN-induced putative kinase)将帕金蛋白(parkin)募集到线粒体外膜上,启动线粒体自噬,引发选择性自噬途径[14-15]。这是ROS诱导细胞死亡的重要机制。
红色荧光蛋白KR以二聚体形式存在,最大激发/发射波长为585/610 nm,既可以直接在靶细胞内单独表达,也可以与靶蛋白融合表达,其蛋白中存在一个长的水通道结构,在540 ~ 580 nm的光照时可以产生致细胞损伤的ROS,一般为超氧阴离子和过氧化氢(H2O2),同时蛋白失去活性[7, 16]。利用红色荧光蛋白KR进行相关ROS诱导的研究中,主要利用其在激光照射下可以产生1 000倍于GFP照射产生的ROS,具有“爆发式”特点,使其发挥足量的作用。Sun等[17]用KR成功地靶向定标制造基因损伤(DART系统),这种在特定基因位点引入损伤的系统,近年来为相关领域发展起到了助推作用。基于此理论,本文作者设想将线粒体靶向蛋白Sarm1序列克隆到KR蛋白序列的前面,构建融合蛋白表达载体,结果显示:构建的融合表达载体具有线粒体靶向特性。本研究同时显示:利用可见光照射可以诱导HeLa细胞内ROS产生,在可见光照射30 min后为ROS产生提供比较理想的条件。
本研究在上述诱导ROS产生的基础上,进一步给予4 Gy X射线照射,观察其对细胞增殖的影响,结果显示:转染了plxsp-flag-Sarm1-KR质粒的HeLa细胞在可见光照射后细胞增殖活性较对照组明显降低,各组细胞经4 Gy X射线照射后增殖活性也明显降低,且plxsp-flag-Sarm1-KR + 4 Gy组较plxsp-flag-Sarm1-KR组和4 Gy组细胞增殖活性进一步降低,说明可见光诱导ROS导致了细胞死亡,细胞增殖活性降低,且增强辐射诱导的细胞增殖抑制作用。本研究基于Sarm1线粒体靶向信号序列能够实现线粒体基质靶向,而KR蛋白在光照下能够失活,且诱导ROS“爆发式”产生,ROS的质和量都得到了保障[18]。因此,将融合表达质粒转染肿瘤细胞,使线粒体靶向的融合蛋白既能实现线粒体靶向,又能光照后产生大量ROS,使得肿瘤细胞在进行放疗前部分细胞死亡,再进行放射治疗,增进放疗对肿瘤细胞的杀伤效果。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69–90. DOI:10.3322/caac.v61:2 |
| [3] | Finkel T. Oxidant signals and oxidative stress[J]. Curr Opin Cell Biol, 2003, 15(2): 247–254. DOI:10.1016/S0955-0674(03)00002-4 |
| [4] | Hekimi S, Wang Y, Noë A. Mitochondrial ROS and the effectors of the intrinsic apoptotic pathway in aging cells:the discerning killers![J]. Front Genet, 2016, 7: 161. |
| [5] | Chio ⅡC, Tuveson DA. ROS in cancer:the burning question[J]. Trends Mol Med, 2017, 23(5): 411–429. DOI:10.1016/j.molmed.2017.03.004 |
| [6] | Liao ZX, Li YC, Lu HM, et al. A genetically-encoded KillerRed protein as an intrinsically generated photosensitizer for photodynamic therapy[J]. Biomaterials, 2014, 35(1): 500–508. DOI:10.1016/j.biomaterials.2013.09.075 |
| [7] | Williams DC, Bejjani RE, Ramirez PM, et al. Rapid and permanent neuronal inactivation in vivo via subcellular generation of reactive oxygen with the use of KillerRed[J]. Cell Rep, 2013, 5(2): 553–563. DOI:10.1016/j.celrep.2013.09.023 |
| [8] | Yang N, Weinfeld M, Lemieux H, et al. Photo-activation of the delocalized lipophilic cation D112 potentiates cancer selective ROS production and apoptosis[J]. Cell Death Dis, 2017, 8(2): e2587. DOI:10.1038/cddis.2017.19 |
| [9] | Esmaeili MA, Abagheri-Mahabadi N, Hashempour H, et al. Viola plant cyclotide vigno 5 induces mitochondria-mediated apoptosis via cytochrome C release and caspases activation in cervical cancer cells[J]. Fitoterapia, 2016, 109: 162–168. DOI:10.1016/j.fitote.2015.12.021 |
| [10] | Wu T, Geng J, Guo W, et al. Asiatic acid inhibits lung cancer cell growth in vitro and in vivo by destroying mitochondria[J]. Acta Pharm Sin B, 2017, 7(1): 65–72. DOI:10.1016/j.apsb.2016.04.003 |
| [11] | Yang C, Yang QO, Kong QJ, et al. Parthenolide induces reactive oxygen species-mediated autophagic cell death in human osteosarcoma cells[J]. Cell Physiol Biochem, 2016, 40(1/2): 146–154. |
| [12] | Pokrzywinski KL, Biel TG, Kryndushkin D, et al. Therapeutic targeting of the mitochondria initiates excessive superoxide production and mitochondrial depolarization causing decreased mtDNA integrity[J]. PLoS One, 2016, 11(12): e0168283. DOI:10.1371/journal.pone.0168283 |
| [13] | Gyulkhandanyan AV, Mutlu A, Freedman J, et al. Mitochondrial permeability transition pore (MPTP)-dependent and-independent pathways of mitochondrial membrane depolarization, cell shrinkage and microparticle formation during platelet apoptosis[J]. Br J Haematol, 2015, 169(1): 142–145. DOI:10.1111/bjh.2015.169.issue-1 |
| [14] | Coto-Montes A, Boga JA, Rosales-Corral S, et al. Role of melatonin in the regulation of autophagy and mitophagy:a review[J]. Mol Cell Endocrinol, 2012, 361(1/2): 12–23. |
| [15] | Heo JM, Ordureau A, Paulo JA, et al. The PINK1-PARKIN mitochondrial ubiquitylation pathway drives a program of OPTN/NDP52 recruitment and TBK1 activation to promote mitophagy[J]. Mol Cell, 2015, 60(1): 7–20. DOI:10.1016/j.molcel.2015.08.016 |
| [16] | Liao ZX, Li YC, Lu HM, et al. A genetically-encoded KillerRed protein as an intrinsically generated photosensitizer for photodynamic therapy[J]. Biomaterials, 2014, 35(1): 500–508. DOI:10.1016/j.biomaterials.2013.09.075 |
| [17] | Sun L, Tan R, Xu J, et al. Targeted DNA damage at individual telomeres disrupts their integrity and triggers cell death[J]. Nucleic Acids Res, 2015, 43(13): 6334–6347. DOI:10.1093/nar/gkv598 |
| [18] | 张威, 郭文涛, 曾宪旭, 等. RUNX2在宫颈鳞癌组织中的表达及其siRNA对HeLa229细胞RUNX2表达及细胞增殖与凋亡的影响[J]. 郑州大学学报:医学版, 2017, 52(6): 718–721. |
 2018, Vol. 44
2018, Vol. 44


