扩展功能
文章信息
- 刘亚芳, 刘继轩, 董欣洁, 陈晓帅, 倪劲松
- LIU Yafang, LIU Jixuan, DONG Xinjie, CHEN Xiaoshuai, NI Jinsong
- 大网膜胰腺实性-假乳头瘤1例报告及文献复习
- Solid pseudopapillary neoplasm of pancreas arising from majus omentum: A case report and literature review
- 吉林大学学报(医学版), 2018, 44(03): 631-634
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 631-634
- 10.13481/j.1671-587x.20180333
-
文章历史
- 收稿日期: 2017-11-13
胰腺实性-假乳头瘤(solid pseudopapillary neoplasm,SPN)占全部胰腺肿瘤的1%,主要发生于20~40岁女性,临床表现主要为瘤体增大和压迫腹部引起不适、恶心、呕吐及腹痛,尽管5%~15%的患者在肿瘤完全切除后仍可发生复发和转移,但是大部分肿瘤转移患者仍可长期无病存活,因此胰腺SPN被认为是低度恶性肿瘤[1-2],Tang等[3]报道了2例临床上具有侵袭性的发生于胰腺的SPN,该2例患者均在肿瘤首次发现后的2个月内死于该肿瘤。发生于胰腺的SPN已属少见肿瘤,发生于胰腺外者则更为少见,目前有胰腺SPN发生于肠系膜[4]、腹膜后[5]、肝脏[6]、卵巢[7]及大网膜[8]的报道,回顾1990年以来的文献显示:共4例SPN发生于大网膜的报道,这4例患者胰腺中均无肿瘤,其中2例肿瘤周围可见异位的胰腺组织,另外2例不详[8]。本例患者为术中偶然发现的大网膜肿瘤,其形态表现及免疫组织化学染色结果提示为胰腺SPN,周围未见异位胰腺组织,腹部超声和CT检查结果可排除胰腺肿瘤转移,诊断为大网膜原发胰腺SPN。发生于大网膜的胰腺SPN,周围未见明确异位胰腺组织尚未见报道。本文作者通过对该患者临床资料和病理特点进行总结,探讨发生于大网膜的胰腺SPN的诊断思路。
1 临床资料 1.1 一般资料患者,女性,43岁,因腹部包块20 d于本院就诊,妇科彩超提示多发性子宫肌瘤,腹部超声未见明显异常,无明显不适,于2014年6月28日行子宫次全切术,术中发现大网膜有1个1.5 cm×1.0 cm的肿物,行子宫及网膜肿物切除术。
1.2 大体检查次全切子宫标本,体积:10.0 cm× 7.0 cm×5.5 cm,肌壁厚2.5 cm,肌壁间见灰白结节3枚,直径0.3~3.5 cm,切面灰白、质韧,编织状,内膜尚光滑,厚0.3 cm(诊断为子宫多发性平滑肌瘤), 分泌期子宫内膜。大网膜肿物,灰褐近圆形肿物1个,体积:1.2 cm×1.0 cm×0.6 cm,肿物边界尚清,部分包膜,边缘附脂肪,切面灰白、质略硬。
1.3 大网膜肿瘤的显微镜下表现子宫为多发性平滑肌瘤;大网膜肿瘤细胞呈实性片状,或假乳头状排列,细胞形态较一致,中等大小,胞质嗜酸或透明呈空泡状,少部分完全透明,细胞核呈卵圆形,可见核沟及小核仁,核分裂相罕见,局灶区可见“室管膜样”的菊形团结构,部分区可见“血湖”结构,并可见“透明小体”。间质可见透明变性和黏液样变。见图 1(封三)。
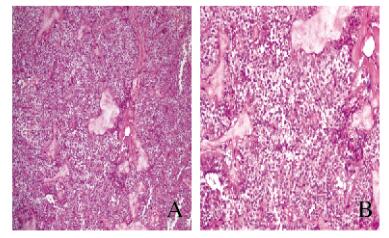
|
| A: ×100, B:×200. 图 1 HE染色检测大网膜胰腺SPN组织形态表现 Figure 1 Morphology of SPN tissue arising from majus omentum detected by HE staining |
|
|
CK-pan(+), AACT(+), AAT(+), NSE(+), PR(+), Vimentin(+), CD10(核旁点状+), CD56(+), β-Catenin(+), S-100(-), Syn(-), WT-1(-), α-inhibin(-), CA19-9(-), CEA(-), CK8(+), CK18(+), Galectin-3(-)。见图 2(封三)。
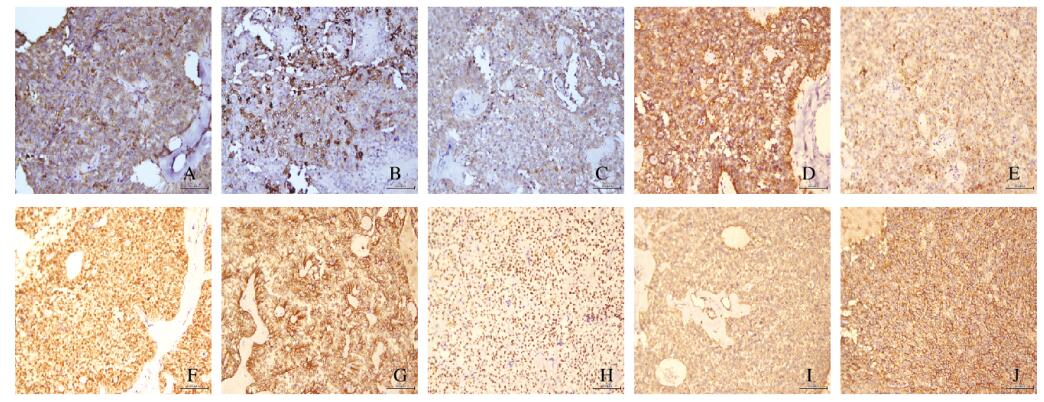
|
| A: AACT; B: AAT; C: NSE; D: CK-pan; E: CD10;F: β-Catenin; G: CK8; H: PR; I: Vimentin; J: CD56. 图 2 免疫组织化学染色检测大网膜胰腺SPN组织形态表现(×200) Figure 2 Morphology of SPN tissue arising from majus omentum detected by immunohistochemistry staining(×200) |
|
|
该患者病理诊断为大网膜胰腺SPN。术后超声和CT检查未见胰腺及其他占位性病变,至今规律随访3年未见胰腺及其他部位有占位性病变,网膜无肿瘤复发。
2 讨论胰腺SPN是由形态一致的上皮细胞构成的低度恶性肿瘤[1]。1996年WHO将其命名为胰腺SPN,在这之前曾使用的名称包括:实性假乳头状肿瘤、实性-囊性肿瘤、乳头状-囊性肿瘤和实性及乳头状上皮性肿瘤等。胰腺SPN是十分少见的肿瘤,占全部胰腺肿瘤的1%,主要发生于20~40岁女性,主要症状是瘤体增大和压迫腹部引起不适、恶心、呕吐及腹痛。肿瘤标志物正常。肿瘤主要发生于胰腺,可以发生于胰腺的任何部位,以胰尾部最多见,亦有个别发生于腹膜及肠系膜的报道[4-8]。肿瘤很少侵及邻近结构及发生转移[9-10]。
胰腺SPN通常为巨大、圆形肿物,平均直径为8.0~10.0 cm,多有包膜,与周围组织界限清,多为单发,偶见多发。肿物切面呈分叶状,实性区呈淡棕色或黄色,可见出血、坏死及充满坏死的囊性区域。区域的种类在不同肿瘤中差异较大。偶有病例几乎全部为出血及囊性变,肿瘤壁可有钙化。胰腺SPN组织形态表现较具特征性,其生长方式较为多样,可表现为实性、假乳头状、出血、坏死及假囊状区呈不同比例存在。实性区域由形态一致的黏附性差的肿瘤细胞组成,其间质常有不同程度的透明变及黏液变,其内可见薄壁的小血管。远离血管的肿瘤细胞可出现退变、甚至脱落,使得小血管周围的细胞围绕小血管形成所谓的假乳头状结构。假乳头状区域可有血湖;透明变性的结缔组织间质内可有灶性钙化或骨化;虽然大多数肿瘤大体上与周围组织界限清,可有纤维包膜,但在镜下,局灶区可以见到小团肿瘤细胞浸润周围组织。肿瘤细胞形态较一致,具有嗜酸性或是透明的空泡状胞质,部分肿瘤细胞内可见到大小不等的淀粉酶消化后PAS阳性的嗜酸性小球。肿瘤细胞核圆形或卵圆形,染色质细腻,可有核沟或凹陷。有时可表现为奇异核。核分裂相罕见。发生转移时,转移灶的肿瘤细胞异型性相对明显,核分裂相相对增多[3]。几乎所有的胰腺SPN均可强表达AAT和AACT,这是该肿瘤的特征之一,肿瘤通常弥漫表达NSE、Vimentin及PR,而ER阴性,这可能与肿瘤主要发生于年轻女性有关,CD10及CD56呈阳性表达,β-Catenin在胰腺SPN中表现为核或浆阳性,而在胰腺非肿瘤细胞中为膜阳性,这也是该肿瘤的特征之一,另外30%~70%的SPN可有CK-pan阳性表达,E-cadherin、CgA及胰腺外分泌酶等一般呈阴性表达[11-12]。
SPN被认为是低度恶性潜能的肿瘤[13],但是15%的SPN可以发生转移,如转移至肝及卵巢等部位[14-15],Tang等[3]认为肿瘤的浸润性边缘、核的不典型性、核分裂的增多和坏死的出现可能提示肿瘤的不良预后。SPN具有一定的形态表现及免疫组织化学特征,发生于胰腺的SPN一般不难做出诊断,但早在1990年就有胰腺SPN发生于肠系膜的报道[16],之后有SPN发生腹膜后、大网膜、肝脏及卵巢的报道[4-8],这些报道[4-5, 16]显示:在部分肿瘤内或肿瘤边缘可以见到异位的胰腺组织,因此推测该肿瘤起源于异位的胰腺组织,但部分肿瘤组织内及其边缘未见明确异位的胰腺组织[6, 8],因此认为发生于胰腺外的胰腺SPN起源于异位的胰腺这一推测缺乏足够的依据,Kosmahl等[17]的研究显示:发生于腹膜后的胰腺SPN可能与胚胎形成过程中生殖嵴的位置有关,并且推测胰腺SPN可能起源于生殖脊相关细胞。发生于胰腺外的SPN应与可发生于该部位的其他肿瘤相鉴别。
本例患者为中年女性,肿物位于大网膜,肿物内及周边未见胰腺成分,术前及术后超声、CT均未发现胰腺有病变,可排除胰腺原发SPN转移,但需与以下恶性肿瘤转移相鉴别:①神经内分泌肿瘤转移至网膜,神经内分泌肿瘤一般排列成巢状、带状及小梁状,肿瘤细胞小,细胞形态较一致,排列紧密,Syn及CgA呈阳性,Vimentin呈阴性,形态表现结合免疫组织化学染色结果,本例患者可排除神经内分泌肿瘤转移;②卵巢的性索间质肿瘤转移至网膜,如颗粒细胞瘤,细胞亦为椭圆形,可有核沟,支持-间质细胞瘤,支持细胞胞浆嗜酸,排列多样,卵巢的性索间质肿瘤α-inhibin阳性,本例患者呈阴性;③卵巢浆液性癌转移至卵巢,本例患者缺乏浆液性癌核的异型性和较多的核分裂相,卵巢浆液性癌CA19-9、CEA及WT-1呈阳性,而本例患者均为阴性,可鉴别。
综上所述,SPN好发于年轻女性,肿瘤大多界限清楚,具有典型的形态及免疫组织化学特点,可发生于胰腺组织外。熟练掌握其临床、病理及免疫组织化学染色特征是对其做出正确诊断及鉴别诊断的关键,SPN有复发和转移潜能,因此对该肿瘤术后的定期复查十分必要。
| [1] | Papavramidis T, Papavramidis S. Solid pseudopapillary tumors of the pancreas:review of 718 patients reported in English literature[J]. J Am Coll Surg, 2005, 200(6): 965–972. DOI:10.1016/j.jamcollsurg.2005.02.011 |
| [2] | Kim CW, Han DJ, Kim J, et al. Solid pseudopapillary tumor of the pancreas:can malignancy be predicted?[J]. Surgery, 2011, 149(5): 625–634. DOI:10.1016/j.surg.2010.11.005 |
| [3] | Tang LH, Aydin H, Brennan MF, et al. Clinically aggressive solid pseudopapillary tumors of the pancreas:a report of two cases with components of undifferentiated carcinoma and a comparative clinicopathologic analysis of 34 conventional cases[J]. Am J Surg Pathol, 2005, 29(4): 512–519. DOI:10.1097/01.pas.0000155159.28530.88 |
| [4] | Elorza Orue JL, Ruiz Diaz I, Tubia-Landaberea J, et al. Solid and papillary tumor on ectopic pancreas in transversal mesocolon[J]. Rev Esp Enferm Dig, 1991, 79(6): 429–431. |
| [5] | Deshpande V, Oliva E, Young RH. Solid pseudopapillary neoplasm of the ovary:a report of 3 primary ovarian tumors resembling those of the pancreas[J]. Am J Surg Pathol, 2010, 34(10): 1514–1520. DOI:10.1097/PAS.0b013e3181f133e9 |
| [6] | Cheuk W, Beavon I, Chui DT, et al. Extrapancreatic solid pseudopapillary neoplasm:report of a case of primary ovarian origin and review of the literature[J]. Int J Gynecol Pathol, 2011, 30(6): 539–543. DOI:10.1097/PGP.0b013e31821724fb |
| [7] | Stoll LM, Parvataneni R, Johnson MW, et al. Solid pseudopapillary neoplasm, pancreas type, presenting as a primary ovarian neoplasm[J]. Hum Pathol, 2012, 43(8): 1339–1343. DOI:10.1016/j.humpath.2011.12.018 |
| [8] | Zhu H, Xia D, Wang B, et al. Extrapancreatic solid pseudopapillary neoplasm:Report of a case of primary retroperitoneal origin and review of the literature[J]. Oncol Lett, 2013, 5(5): 1501–1504. DOI:10.3892/ol.2013.1242 |
| [9] | Stowik-Moczydtowska Z, Gogolewski M, Yaqoub S, et al. Solid pseudopapillary tumor of the pancreas (Frantz's tumor):two case reports and a review of the literature[J]. J Med Case Rep, 2015, 20(9): 268. |
| [10] | Sperti C, Berselli M, Pasquali C, et al. Aggressive behaviour of solid-pseudopapillary tumor of the pancreas in adults:a case report and review of the literature[J]. World J Gastroenterol, 2008, 14(6): 960–965. DOI:10.3748/wjg.14.960 |
| [11] | Yu PF, Hu ZH, Wang XB. Solid pseudopapillary tumor of the pancreas:a review of 553 cases in Chinese literature[J]. World J Gastroenterol, 2010, 16(10): 1209–1214. DOI:10.3748/wjg.v16.i10.1209 |
| [12] | Kominami A, Fujino M, Murakami H, et al. β-catenin mutation in ovarian solid pseudopapillary neoplasm[J]. Pathol Int, 2014, 64(9): 460–464. DOI:10.1111/pin.12194 |
| [13] | Limaiem F, Mestiri H, Mejri S, et al. Solid pseudopapillary neoplasm of the pancreas in two male patients:gender does not matter[J]. Pan Afr Med J, 2017, 27: 283. |
| [14] | Jung MJ, Kim HK, Choi SY, et al. Solid pseudopapillary neoplasm of the pancreas with liver metastasis initially misinterpreted as benign haemorrhagic cyst[J]. Malays J Pathol, 2017, 39(3): 327–330. |
| [15] | Wu H, Huang YF, Liu XH, et al. Extrapancreatic solid pseudopapillary neoplasm followed by multiple metastases:Case report[J]. World J Gastrointest Oncol, 2017, 9(12): 497–501. DOI:10.4251/wjgo.v9.i12.497 |
| [16] | Ishikawa O, Ishiguro S, Ohhigashi H, et al. Solid and papillary neoplasm arising from an ectopic pancreas in the mesocolon[J]. Am J Gastroenterol, 1990, 85(5): 597–601. |
| [17] | Kosmahl M, Seada LS, Janig U, et al. Solid-pseudopapillary tumor of the pancreas:its origin revisited[J]. Virchows Arch, 2000, 436(5): 473–480. DOI:10.1007/s004280050475 |
 2018, Vol. 44
2018, Vol. 44


