扩展功能
文章信息
- 全晓月, 刘百龙, 刘敏, 董丽华
- QUAN Xiaoyue, LIU Bailong, LIU Min, DONG Lihua
- 阿帕替尼治疗无法耐受化疗的肺鳞状细胞癌1例报告及文献复习
- Treatment of lung squamous cell carcinoma with apatinib in patient who couldn't tolerate chemotherapy: A case report and literature review
- 吉林大学学报(医学版), 2018, 44(03): 624-627
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 624-627
- 10.13481/j.1671-587x.20180331
-
文章历史
- 收稿日期: 2017-10-02
肺癌已经成为世界范围内死亡率最高的恶性肿瘤[1],在我国,肺癌也位于恶性肿瘤死亡率的第1位[2]。非小细胞肺癌(non-small cell lung cancer, NSCLC)约占肺癌的80%[3-4], NSCLC患者5年生存率仅为15.6%,约2/3患者就诊时已经发生区域或远处转移[5]。对于可手术切除的NSCLC,目前首选的治疗方式是手术切除,必要时行术前和术后辅助放化疗。对于晚期NSCLC,2015年我国肺癌诊疗指南推荐Ⅳ期患者在治疗之前,依据患者的临床特征先行基因检测,根据基因突变情况制订相应的治疗策略[2]。然而,肺鳞状细胞癌(肺鳞癌)患者少有基因突变,对于该类患者,首选含铂两药联合方案化疗,但其总体客观缓解率小于50%[6],且部分患者无法耐受化疗不良反应,故大部分肺鳞癌患者尚无有效的治疗方案。因此亟待寻找新的治疗策略。阿帕替尼作为国产高效血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR-2)酪氨酸激酶抑制剂,主要通过抑制VEGFR-2发挥抗血管生成作用以治疗恶性肿瘤,其在肺鳞癌中的应用少有报道。本研究报道1例无法耐受化疗的晚期肺鳞癌患者,使用阿帕替尼治疗后获得了5个月的无进展生存期(progression free survival, PFS),并进行相关文献回顾,探讨阿帕替尼治疗肺鳞癌的临床疗效,为不能耐受化疗或化疗失败晚期肺鳞癌患者的治疗提供新思路。
1 临床资料 1.1 一般资料患者,女性,65岁,既往无吸烟史,2016年3月因“咳嗽咳痰2个月余”行肺部CT检查,结果显示:右肺中叶、左肺舌叶和双肺下叶见散在少许条片状和结节状高密度影,大小0.2~0.6 cm,纵隔内见明显肿大淋巴结。支气管镜:左主支气管内侧壁黏膜充血肿胀,表面不规则增生,管腔略狭窄,右主支气管内侧面黏膜充血肿胀。支气管镜病理回报(左前隆突及右后隆突):送检标本内见异形细胞,形态考虑为异形细胞(低分化癌可能性大)。肿瘤标志物:神经元特异性烯醇化酶55.80 μg·L-1,细胞角蛋白片段:11.43 μg·L-1。诊断为肺部恶性肿瘤(低分化癌Ⅳ期)。
1.2 化疗2016年3—5月患者于本院肿瘤中心行3个疗程“依托泊苷+顺铂”方案化疗,复查肺部CT,肺部病灶较化疗前未见明显变化。后经吉林大学中日联谊医院病理科会诊:病理倾向于鳞状细胞癌。行1个疗程“吉西他滨+顺铂”方案化疗,患者因化疗不良反应大无法耐受而终止治疗。化疗后患者最初刺激性咳嗽症状消失,影像学评价为稳定(stable disease, SD)。
1.3 放疗2016年6月患者行双肺门病变及相应淋巴结引流区50 Gy/25 f/5 w放疗, 放疗结束后病灶较放疗前明显缩小(图 1)。2016年11月患者因“右侧上肢抬举受限10余天,头痛、右眼视力下降1周”行头部MRI检查,结果显示:左侧小脑半球、左侧丘脑和右侧眼球内可见类圆形异常强化。CT可见:右侧肱骨上段髓腔内占位,双侧腋下淋巴结肿大,右侧前臂骨皮质不连续,右侧膝关节骨质破坏。给予颅内转移灶55.2 Gy/23 f放疗,全脑和右侧眼球给予41.4 Gy/23 f放疗。后因发现全身多发转移,相继给予右侧肱骨上段及双侧腋窝45 Gy/15 f放疗,右侧前臂20 Gy/4 f放疗,右侧膝关节20 Gy/4 f放疗。
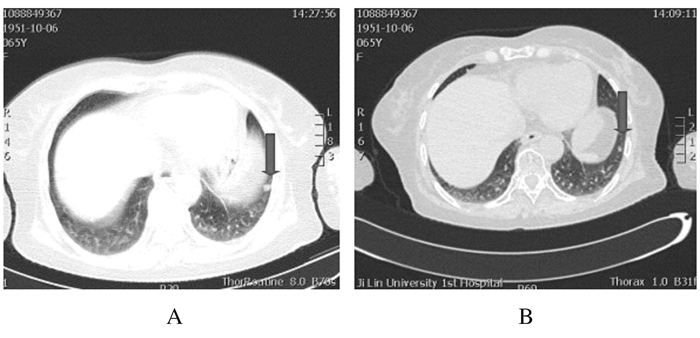
|
| A:Before treatment; B:After treatment. 图 1 肺鳞癌患者巨大原发病灶放疗(50 Gy/25 f/5 w)前后CT图像 Figure 1 CT images of huge primary lesion of patient with lung squamous cell carcinoma before and after irradiation (50 Gy/25 f/5 w) |
|
|
2016年12月患者发现左侧季肋部皮下结节1周之内由黄豆粒大小增大至1.5 cm×1.0 cm。2016年12月26日起口服阿帕替尼500 mg·d-1,2017年2月4日因出现Ⅲ度骨髓抑制而停用阿帕替尼(WBC:0.84×10-9 L-1,PLT:31×10-9 L-1, HGB:76 g·L-1)。应用阿帕替尼约40 d时患者左侧季肋区体表包块缩小至黄豆粒大小(图 2),复查肺部CT显示肺内结节较之前缩小(图 3)。停用阿帕替尼后患者左侧季肋部皮下结节复又增大至鸡蛋黄大小。2017年3月15日复查血常规血小板恢复至80×10-9 L-1以上,开始口服阿帕替尼250 mg·d-1,左侧季肋部结节较用药前稳定,未见明显肿大或缩小。
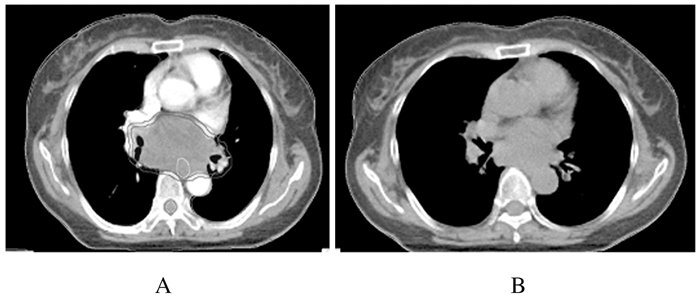
|
| A:Before treatment; B:After treatment. 图 2 肺鳞癌患者应用阿帕替尼治疗前后胸壁病灶CT图像 Figure 2 CT images of chest wall lesion of patient with lung squamous cell carcinoma before and after treated with apatinib |
|
|
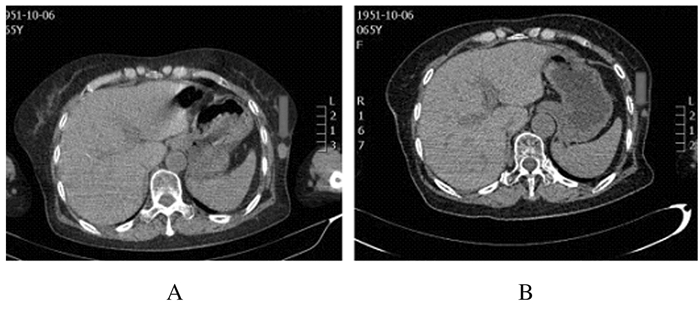
|
| A:Before treatment; B:After treatment. 图 3 肺鳞癌患者应用阿帕替尼治疗前后肺内病灶CT图像 Figure 3 CT images of lung lesion of patient with lung squamous cell carcinoma before and after treated with apatinib |
|
|
2017年5月患者因状态差停用阿帕替尼,季肋部肿块进行性增大,2017年6月14日因多器官功能衰竭死亡,季肋部肿块已增大至鹅蛋大小。
2 讨论肺鳞癌占NSCLC的30%,具有独特的流行病学、分子生物学和病理学特征。大多数肺癌患者确诊时已为局部进展或转移,而Ⅳ期NSCLC患者的5年生存率仅为1%[7]。近年来,靶向治疗的进展引领了Ⅳ期NSCLC治疗策略的重大变革。但肺癌发生发展的主要驱动基因如EGFR突变或ALK突变均存在于肺鳞癌中,而肺鳞癌治疗尚未取得突破性进展,治疗策略相对局限。
化疗是肺鳞癌患者的首选治疗方案。研究[8]显示:吉西他滨联合顺铂的治疗方案能获得较好的PFS(4.4个月)和总生存期(OS)(9.4个月);白蛋白结合型紫杉醇(nab-PC)联合卡铂一线治疗客观反应率(ORR)为41%,疗效优于紫杉醇联合卡铂(ORR为24%),nab-PC用于晚期肺鳞癌一线化疗有效[9]; 但日本的LETS研究[10]证实:在肺鳞癌患者中,与紫杉醇/卡铂方案比较,S-1/卡铂方案作用后OS有升高的优势(14.0个月vs10.6个月)。但相当比例的患者年龄大、基础疾病多、卡氏功能状态(Karnofsky Performance Status,KPS)评分低,难以耐受高强度化疗,亟待寻求新的治疗方法。对于不能耐受化疗或化疗失败晚期肺鳞癌患者,只能依靠靶向治疗等系统治疗策略。
2004年一项随机Ⅱ期临床试验[11]比较了PC方案联用贝伐单抗同单用PC方案治疗晚期NSCLC的疗效:采用贝伐单抗组有6例患者出现大咯血,4例有致命性,均发生于肺鳞癌。因而基于安全性考虑禁止贝伐单抗运用于肺鳞癌的治疗。而PC化疗联合重组人血管内皮抑素可明显提高患者的临床获益率和缓解率,且在肺鳞癌患者中安全性良好[12]。REVEL的Ⅲ期研究[13]显示:1 253例顺铂类一线化疗失败的NSCLC患者随机分为多西他赛组或多西他赛联合雷莫芦单抗组,化疗基础上联合雷莫芦单抗明显提高了患者的PFS和OS,且对于鳞癌与非鳞癌患者保持一致的获益。因此,FDA批准雷莫芦单抗二线运用于肺鳞癌的治疗中。但恩度和雷莫芦单抗价格昂贵、性价比较低。探索疗效好、不良反应小和耐受性好的新药是科研工作者亟待解决的问题。甲磺酸阿帕替尼片是2014年10月上市的VEGFR-2抑制剂,通过高度选择性竞争细胞内VEGFR-2的ATP结合位点,阻断下游信号传导,从而强效抑制肿瘤血管生成,发挥抗肿瘤作用[14]。目前阿帕替尼的适应证为至少接受过2种系统化疗后复发或进展的晚期胃腺癌或胃-食管结合部腺癌患者。临床对于晚期肺鳞癌患者应用阿帕替尼的报道较少。
Song等[15]回顾性分析了2014—2015年共42例NSCLC患者(腺癌30例、鳞癌12例)应用阿帕替尼作为二线或三线治疗失败后的挽救治疗药物,评价阿帕替尼作为晚期NSCLC挽救治疗的疗效和安全性。42例患者中4例达到PR,22例达到SD,缓解率为9.5%,疾病控制率为61.9%。中位PFS和中位OS分别为4.2和6.0个月。毒性可接受,3/4级不良反应率为50%,常见的不良反应包括手足综合征、高血压、蛋白尿、肝损伤和乏力等。曹恒等[16]关于阿帕替尼治疗晚期NSCLC临床观察中,共纳入40例NSCLC患者(腺癌28例、鳞癌12例),应用阿帕替尼后患者PFS为1~13个月,中位PFS为3.6个月,其中腺癌与鳞癌的ORR分别为46.4%与33.3%。Ding等[17]报道1例经三线化疗均无效的肺鳞癌患者,应用阿帕替尼后患者PFS超过6个月。阿帕替尼对肺鳞癌的疗效尚不明确。本例患者为肺鳞癌Ⅳ期患者,经放化疗治疗后效果不佳,短时间内疾病迅速进展,全身多发转移,提示预后不佳。身体耐受性差,无法继续化疗,应用阿帕替尼后,病情得到控制,影像学显示肺部病灶较治疗前缩小,皮下包块较治疗前明显减小。Li等[18]报道阿帕替尼常见的不良反应为顽固性高血压、手足综合征和蛋白尿等,血液系统毒性较其他化疗药物小。本例患者间断服药5月余未发生阿帕替尼常见不良反应,但骨髓抑制比较严重,需引起临床医生的重视。患者服用阿帕替尼后总PFS达5个月。
晚期肺鳞癌患者的一线治疗仍为含铂双药方案化疗,对于多线化疗失败或无法耐受化疗患者,阿帕替尼具有较好的疗效和安全性[19],为晚期肺鳞癌患者提供了新的治疗机会,延长了患者的生存时间。
| [1] | Bepler G, Begum M, Simon GR. Molecular analysis-based treatment strategies for non-small cell lung cancer[J]. Cancer Control, 2008, 15(2): 130–139. DOI:10.1177/107327480801500205 |
| [2] | 陆舜, 虞永峰, 纪文翔. 2015年肺癌诊疗指南:共识和争议[J]. 解放军医学杂志, 2016, 41(1): 1–6. DOI:10.11855/j.issn.0577-7402.2016.01.01 |
| [3] | Bach PB, Silvestri GA, Hanger M, et al. Screening for lung cancer:ACCP evidence based clinical practice guidelines (2nd edition)[J]. Chest, 2007, 132(3 Suppl): 69S–77S. |
| [4] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(5): 283–298. DOI:10.3322/caac.21153 |
| [5] | Poonacha TK, Go RS. Level of scientific evidence underlying recommendations arising from the National Comprehensive Cancer Network clinical practice guidelines[J]. J Clin Oncol, 2011, 29(2): 186–191. DOI:10.1200/JCO.2010.31.6414 |
| [6] | 薛慧, 王文武, 欧阳学农. S-1治疗晚期非小细胞肺癌的临床新进展[J]. 实用临床药学杂志, 2011, 15(3): 125–128. |
| [7] | Carnio S, Novello S, Mele T, et al. Extending survival of stage Ⅳ non-small cell lung cancer[J]. Semin Oncol, 2014, 41(1): 69–92. DOI:10.1053/j.seminoncol.2013.12.013 |
| [8] | Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J]. New England J Med, 2002, 346(2): 92–98. DOI:10.1056/NEJMoa011954 |
| [9] | Socinski MA, Bondarenko I, Karaseva NA, et al. Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer:final results of a phase Ⅲ trial[J]. J Clin Oncol, 2012, 30(17): 2055–2062. DOI:10.1200/JCO.2011.39.5848 |
| [10] | Yoshioka H, Okamoto I, Morita S, et al. Efficacy and safety analysis according to histology for S-1 in combination with carboplatin as first-line chemotherapy in patients with advanced non-small-cell lung cancer:updated results of the West Japan Oncology Group LETS study[J]. Ann Oncol, 2013, 24(5): 1326–1331. DOI:10.1093/annonc/mds629 |
| [11] | Johnson DH, Fehrenbacher L, Novotny WF, et al. Randomized phase Ⅱ trial comparing bevacizumab plus carboplatin and paclitaxel with carboplatin and paclitaxel alone in previously untreated locally advanced or metastatic non-small-cell lung cancer[J]. JClin Oncol, 2004, 22(11): 2184–2191. DOI:10.1200/JCO.2004.11.022 |
| [12] | Han B, Xiu Q, Wang H, et al. A multicenter, randomized, double-blind, placebo-controlled study to evaluate the efficacy of paclitaxel-carboplatin alone or with endostar for advanced non-small cell lung cancer[J]. J Clin Oncol, 2011, 6(6): 1104–1109. |
| [13] | Garon EB, Ciuleanu TE, Arrieta O, et al. Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage Ⅳ non-small-cell lung cancer after disease progression on platinum-based therapy (REVEL):a multicentre, double-blind, randomised phase 3 trial[J]. Lancet, 2014, 384(9944): 665–673. DOI:10.1016/S0140-6736(14)60845-X |
| [14] | Kim KL, Suh W. Apatinib, an inhibitor of vascular endothelial growth factor receptor 2, suppresses pathologic ocular neovascularization in mice[J]. Invest Ophthalmol Visual Sci, 2017, 58(9): 3592–3599. DOI:10.1167/iovs.17-21416 |
| [15] | Song Z, Yu X, Lou G, et al. Salvage treatment with apatinib for advanced non-small-cell lung cancer[J]. Onco Targets Ther, 2017, 10: 1821–1825. DOI:10.2147/OTT |
| [16] | Cao H, Wang J. Observation of herapeutic effect about advanced non-small cell lung cancer treated with apatinib mesylate tablets[J]. Chin J Cancer Prevent Treatment, 2017, 24(7): 468–470. |
| [17] | Ding L, Li QJ, You KY, et al. The use of apatinib in treating nonsmall-cell lung cancer:case report and review of literature[J]. Medicine(Baltimore), 2016, 95(20): e3598. |
| [18] | Li J, Qin S, Xu J, Guo W, et al. Apatinib for chemotherapy-refractory advanced metastatic gastric cancer:results from a randomized, placebo-controlled, parallel-arm, phase Ⅱ trial[J]. J Clin Oncol, 2013, 31(26): 3219–3225. DOI:10.1200/JCO.2013.48.8585 |
| [19] | 李媛. 晚期非小细胞肺癌患者放疗前后肿瘤标志物变化与近期疗效的临床分析[J]. 中国实验诊断学, 2017, 21(8): 1335–1337. |
 2018, Vol. 44
2018, Vol. 44


