扩展功能
文章信息
- 王明睿, 翟秀宇, 王钢, 张文岚, 高宝山, 周洪澜, 傅耀文
- WANG Mingrui, ZHAI Xiuyu, WANG Gang, ZHANG Wenlan, GAO Baoshan, ZHOU Honglan, FU Yaowen
- CYP3A5基因多态性对肾移植术后患者他克莫司代谢的影响
- Effects of CYP3A5 genetic polymorphisms on metabolism of tacrolimus in patients after kidney transplantation
- 吉林大学学报(医学版), 2018, 44(03): 537-542
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 537-542
- 10.13481/j.1671-587x.20180315
-
文章历史
- 收稿日期: 2017-05-04
2. 运城市中心医院泌尿外科, 山西 运城 044000
2. Department of Urinary Surgery, Yuncheng Central Hospital, Yuncheng 044000, China
他克莫司作为肾移植术后抗排异反应的一线免疫抑制剂广泛应用于国内外肾移植术后患者, 其属大环内酯类抗生素, 可较好地预防和治疗肾移植术后急性排异反应。但该药物的吸收存在个体差异, 且安全范围较窄, 因此提倡个体化治疗[1]。近年来的多项研究[2-6]表明:细胞色素P450 3A(CYP3A)酶系中CYP3A5的基因多态性是影响他克莫司药物代谢的重要因素。研究CYP3A5基因多态性对肾移植术后他克莫司药物代谢的影响, 指导肾移植术后他克莫司个体化治疗方案很有必要。有学者[3, 6]发现:CYP3A5基因多态性对肾移植术后早期他克莫司的药物代谢有明显影响。但绝大多数研究随访时间限制于术后3个月之内, 少有随访时间超过术后1年的研究。本研究回顾性分析吉林大学第一医院115例肾移植术后患者的临床资料, 纳入患者均完整随访2年, 为揭示CYP3A5基因多态性对肾移植术后患者他克莫司药物代谢的中远期影响提供依据。
1 资料与方法 1.1 一般资料选择2012年6月—2014年10月吉林大学第一医院收治的453例肾移植术后患者, 筛选出115例符合条件的患者, 其中男性76例(66.09%), 女性39例(33.91%), 年龄(37.90± 10.80)岁, 体质量指数(BMI) (21.78±3.66) kg·m-2。按照CYP3A5基因型分为野生纯合子组(CYP3A5*1/*1型, 11例)、突变杂合子组(CYP3A5*1/*3型, 46例)和突变纯合子组(CYP3A5*3/*3型, 58例), CYP3A5*3型基因突变率为70.43%。记录3组患者术后不同时间点(7d、1个月、3个月、6个月、1年和2年)有效的血他克莫司浓度/剂量(C0/D)值, C0为他克莫司谷浓度(ng·mL-1), D为患者每日每公斤体质量所服用他克莫司毫克数(mg·kg-1·d-1), C0/D值单位为ng·mL-1·d·kg。将3组患者同一时间点的C0/D值进行两两比较, 分析CYP3A5基因多态性对C0/D值的影响; 将同一基因型患者不同时间点的C0/D值进行两两比较, 分析同一基因型患者不同时间点C0/D值的差异。
1.2 纳入标准① 首次行肾脏移植手术; ②年龄18~66岁; ③采用他克莫司+吗替麦考酚酯/麦考酚钠+泼尼松三联免疫抑制方案且维持该方案至少2年, 且随访数据完整。
1.3 排除标准① 合并使用CYP3A5酶诱导剂或抑制剂的患者; ②术后发生移植肾功能延迟恢复(DGF)和失访的患者; ③合并使用肾毒性药物的患者; ④术后肾功能异常的患者(血清肌酐>300 μmol·L-1); ⑤在检测药物浓度前1周内出现腹泻症状的患者; ⑥既往患有糖尿病的患者; ⑦术后肝功能异常的患者; ⑧术后发生急慢性排斥反应、急性感染的患者; ⑨既往患有严重心血管、肝脏、造血系统、神经系统及精神病等相关的疾病(如乙型肝炎、丙型肝炎和原发性高血压等)以及患有贫血、低蛋白血症和精神性厌食症或胃肠切除术后等影响药物吸收的患者; ⑩多器官联合移植的患者。
1.4 诱导和免疫抑制方案于手术当日及术后第4天分别给予巴利昔单抗(Basiliximab, 诺华制药有限公司)20 mg; 于手术当日及术后第14天分别给予达利珠单抗(Daclizumab, 罗氏制药有限公司)1 mg·kg-1; 自手术当日起每日给予抗胸腺细胞免疫球蛋白(ATG, 安斯泰来制药有限公司)200 mg, 连续给药5~7d(当患者体质量小于50 kg时, 药物剂量减至100 mg)。手术当日及术后第1天、第2天分别给予甲基强的松龙(辉瑞制药有限公司)500 mg静点; 术后第3天起口服醋酸泼尼松片(华中药业股份有限公司)120 mg·d-1, 此后每日递减20 mg至20 mg·d-1维持(应用ATG的患者, 术后第3天起口服醋酸泼尼松片20 mg·d-1维持)。术后第1天口服吗替麦考酚酯(罗氏制药有限公司)/麦考酚钠(诺华制药有限公司), 依据体质量给药(体质量 < 50 kg, 500/360 mg, 每日2次; 50 kg < 体质量 < 80 kg, 750/540 mg, 每日2次; 体质量>80 kg, 1 000/720 mg, 每日2次)。当血清肌酐低于300 μmol·L-1时给予他克莫司(安斯泰来制药有限公司), 初始剂量:他克莫司0.1 mg·kg-1·d-1。此后根据血药浓度及生化指标调整用药剂量。
1.5 他克莫司血药样本的采集及其浓度的测定患者于20:00口服FK506, 于次日8:00服药前空腹采取静脉血2 mL, 并置于EDTA抗凝管中。采用EMIT法检测其浓度谷值(EMIT 2000 tacrolimus assay, SIEMENS公司)。
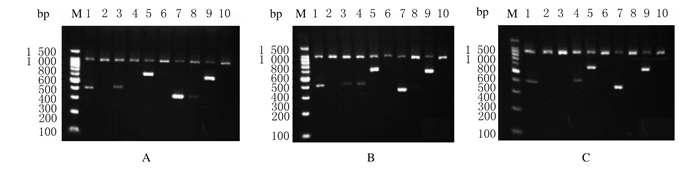
1.6 CYP3A5基因多态性分析采用常规方法提取外周血白细胞基因组DNA, 并使用CYP3A5基因分型测定试剂盒(天津市秀鹏生物技术开发有限公司)检测CYP3A5基因*1/*3多态性。依据产品说明书, 将Buffer-Taq-DNA样本混合液加入试剂盒提供的1-10号引物孔, PCR扩增反应条件:96℃、2 min, 1个循环; 96℃、20 s, 68℃、1 min, 5个循环; 96℃、20 s, 65℃、50 s, 72℃、45 s, 10个循环; 96℃、20 s, 63℃、50 s, 72℃、45 s, 15个循环; 72℃、3 min, 1个循环。取1~10号PCR扩增产物各10 μL, 行2.5%聚丙烯酰胺凝胶电泳。电极缓冲液为1×TBE。电泳后银染显色, 紫外灯下判读结果。根据试剂盒内提供的基因型结果分型表判断患者基因分型。CYP3A5*1/*1基因分别于第1、3、5、7和9孔位产生396、412、612、335及580 bp条带, CYP3A5*1/*3基因分别于第1、3、4、5、7和9孔位产生396、412、412、612、335及580bp条带, CYP3A5*3/*3基因分别于第1、4、5、7和9孔位产生396、412、612、335及580bp条带。见图 1。
|
| A:CYP3A5 *1/*1;B:CYP3A5 *1/*3;A:CYP3A5 *3/*3;Lane 1-10:PCR product. 图 1 3种CYP3A5基因型多态性分析的电泳图 Figure 1 Electrophoregram of analysis polymorphism of three CYP3A5 genotypes |
|
|
采用SPSS 20.0统计软件进行统计学分析。各组患者年龄、BMI、术后不同时间点患者的他克莫司C0/D值均以x±s表示, 不同基因型患者年龄和性别构成比比较采用χ2检验, 不同基因型患者BMI、C0/D值及同一基因型患者不同时间点他克莫司C0/D值比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 肾移植术后患者基本情况野生纯合子组、突变杂合子组和突变纯合子组患者BIM分别为(22.68±2.62)、(21.96±4.15)和(21.46±3.42) kg·m-2, 3组患者中男性占比分别为72.7%、60.9%和69.0%, 3组患者中18~30岁者占比分别为18.2%、32.6%和34.5%, 3组患者中31~42岁者占比分别为36.4%、37.0%和29.3%, 3组患者中43~54岁者占比分别为27.3%、23.9%和31.0%, 3组患者中55~66岁者占比分别为18.2%、6.5%和5.2%。3组患者BMI、年龄构成比和性别构成比比较差异均无统计学意义(P>0.05)。
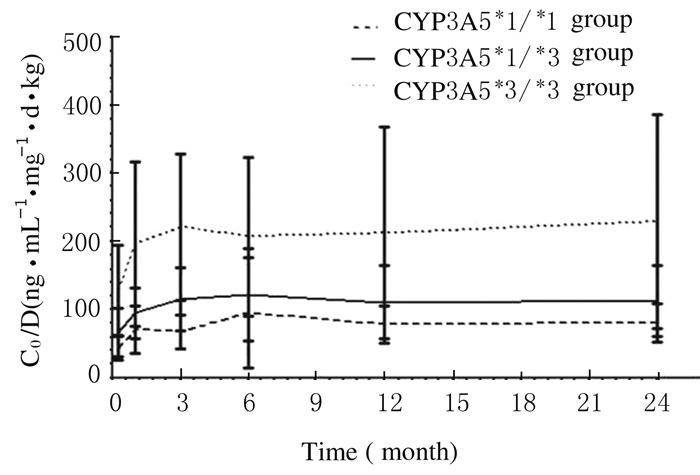
2.2 各组患者不同时间点他克莫司C0/D值在术后7d、3个月、1年和2年时, 野生纯合子组患者的C0/D值明显低于突变杂合子组(P=0.011, P < 0.01, P=0.022, P=0.024);在术后1和6个月时, 野生纯合子组与突变杂合子组患者他克莫司C0/D值比较差异无统计学意义(P=0.159, P=0.719);在术后各时间点, 野生纯合子组和突变杂合子组患者他克莫司C0/D值均明显低于突变纯合子组(P < 0.01)。见表 1和图 2。
| (x±s) | |||||||
| Group | n | C0/D(ng·mL-1·mg-1·d·kg) | |||||
| 7 d | 1 month | 3 months | 6 months | 1 year | 2 years | ||
| CYP3A5*1/*1 | 11 | 42.89±17.20 | 70.88±34.26 | 67.46±24.47 | 95.26±81.33 | 78.20±26.91 | 80.64±27.74 |
| CYP3A5*1/*3 | 46 | 66.08±35.80* | 94.98±37.45 | 115.15±46.67* | 121.17±67.83 | 110.74±54.13* | 112.79±51.42* |
| CYP3A5*3/*3 | 58 | 125.60±66.24**△ | 195.56±118.80**△ | 219.18±103.43**△ | 207.74±114.22**△ | 218.97±157.60**△ | 231.59±156.43**△ |
| * P < 0.05, * * P < 0.01 vs CYP3A5*1/*1 group; △ P < 0.01 vs CYP3A5*1/*3 group. | |||||||
|
| 图 2 各组患者不同时间点他克莫司C0/D值折线图 Figure 2 Line chart of C0/D values of tacrolimus of patients in various groups at different time points |
|
|
野生纯合子组术后7d患者他克莫司C0/D值明显低于术后6个月、1年和2年(P=0.004, P=0.049, P=0.036), 其余各时间点的C0/D值比较差异无统计学意义(P>0.05);突变杂合子组术后7d患者他克莫司C0/D值明显低于术后1个月、3个月、6个月、1年和2年(P=0.006, P < 0.01, P < 0.01, P < 0.01, P < 0.01), 术后1个月患者C0/D值明显低于术后6个月(P=0.013), 其余各时间点C0/D值比较差异无统计学意义(P>0.05);突变纯合子组术后7d患者他克莫司C0/D值明显低于术后1个月、3个月、6个月、1年和2年(P=0.002, P < 0.01, P < 0.01, P < 0.01, P < 0.01), 其余各时间点他克莫司C0/D值比较差异无统计学意义(P>0.05)。见表 1。
3 讨论他克莫司属大环内酯类抗生素, 可较好地预防及治疗肾移植术后患者的急性排异反应。近年, 其已成为实体器官移植术后患者中使用最广泛的免疫抑制剂[7]。但其吸收存在明显的个体差异, 安全范围较窄, 因此, 国内外各中心均提倡他克莫司的个体化治疗, 通过定期对移植术后患者进行血药物浓度监测, 以确保既达到良好的免疫抑制效果, 又能避免药物过量带来的毒副作用。
细胞色素P450 3A(CYP3A)酶系中CYP3A5的基因多态性是影响他克莫司药物代谢的重要因素, 因此探讨CYP3A5基因多态性对肾移植术后患者他克莫司药物代谢的影响很有必要。CYP3A5基因位于7号染色体上, 拥有多个单核苷酸多态性, 其中CYP3A5*3位点最受关注, 在中国汉族人群中, 其突变率高达72.17%, 其突变是发生在3号内含子上, 由6 986位的A突变为G, 野生纯合子型为CYP3A5*1/*1, 突变杂合子为CYP3A5*1/*3, 突变纯合子型为CYP3A5*3/*3[8-12]。
CYP3A5基因多态性对肾移植术后患者早期他克莫司药物代谢具有明显的影响, 然而绝大多数研究[13-14]随访时间限制于术后3个月之内, 少有随访时间超过术后1年的研究, 因此, 探讨CYP3A5基因多态性对肾移植术后患者中长期他克莫司药物代谢的影响具有重要的意义。本研究采取较为严格的纳入标准, 且患者完整随访2年, 以期尽可能减少影响本研究准确性的因素。
本研究结果显示:CYP3A5基因多态性对肾移植术后患者他克莫司药物代谢有重要的影响, 且这种影响不仅限于此前研究所认为的术后前3个月, 而且术后2年时其对他克莫司药物代谢的影响仍较明显, 因此CYP3A5基因多态性分析不能仅限于指导移植术后早期他克莫司用药方案, 也推荐用于指导移植术后稳定期的他克莫司用药方案。本研究结果显示:CYP3A5不同基因型者之间C0/D值表现为:野生纯合子型 < 突变杂合子型 < 突变纯合子型, 因此建议对于CYP3A5基因型为野生纯合子型(*1/*1)的患者, 适当增加其他克莫司的初始剂量, 并适当提高监测血药物浓度的频率, 以期更快地达到目标浓度, 且避免药物过量带来的毒副作用。同时对于他克莫司无法达到目标浓度的野生纯合子型患者, 建议及时更换免疫抑制方案, 如环孢素(CSA)。研究[15-17]显示:CSA的药物代谢与CYP3A5基因多态性的关系并不明显。因此本课题组针对部分CYP3A5基因型为*1/*1的患者, 术后即开始采用CSA+吗替麦考酚酯/麦考酚钠+泼尼松三联免疫抑制方案, 据本中心临床经验, 该部分患者的术后不良事件发生率并未增多, 且患者能较早地达到CSA的目标血药物浓度, 但因该类患者病例数较少, 尚需进一步扩大样本量以评估该治疗方案的优劣。
本研究结果显示:无论何种基因型, 均不同程度存在随时间延长C0/D值逐渐升高并趋于稳定的现象。研究[18]证实:在移植术后的恢复期, 患者他克莫司的药物动力学会有所改变。Hu等[19]发现:红细胞比容(HCT)和血红蛋白浓度(HGB)均与血中他克莫司的浓度有关联。Hamim等[20]研究证实:HCT和HGB水平越高, 他克莫司的清除率越低, 这与他克莫司在血液中与红细胞广泛结合有关联, 而HCT或HGB水平升高使进入红细胞的他克莫司随之增加, 进而导致肝脏对药物的清除减慢, 同时红细胞中大量结合的药物亦可使全血中他克莫司的浓度升高。器官移植术后恢复期患者上述指标多与稳定期有较大差异, 因此当患者的临床状况改善时, 他克莫司在体内的药物动力学会有相应改变。移植术后早期患者胃肠功能尚未完全恢复, 肠道转运时间延长, 使少量的他克莫司转运至低表达CYP3A的回肠而引起药物浓度降低。张关敏等[21]研究发现:术后随着时间延长, 他克莫司的清除率呈缓慢降低趋势。张鑫等[22]研究发现:在术后早期激素用量与C0/D值呈明显的负相关关系, 这可能是因为术后早期较大量的激素应用可以诱导CYP3A酶系的表达而加速了他克莫司的代谢清除。他克莫司与红细胞的结合是非线性的[23-24], 当他克莫司剂量减低时, 其清除率可能也随之降低。因此, 随着肾移植术后时间的延长, 其激素与免疫抑制剂用量逐渐减少, HGB和HCT水平逐渐升高, 胃肠道功能逐渐恢复, 体内他克莫司的清除率和(或)生物利用率的改变亦可部分解释上述现象, 但有无其他因素参与其中及其具体机制仍有待进一步研究。除遗传背景外, 上述因素也应该作为他克莫司个体化治疗的参考因素。
本研究为回顾性单中心研究, 样本量有限, 未来有必要行前瞻性研究或多中心的联合研究以期得到更准确的结论。
| [1] | 戴立波, 杨宏昕, 韩晓芳, 等. 他克莫司治疗药物监测与合理用药分析[J]. 世界最新医学信息文摘, 2017, 17(57): 109, 112. |
| [2] | Chen JS, Li LS, Cheng DR, et al. Effect of CYP3A5 genotype on renal allograft recipients treated with tacrolimus[J]. Transplant Proc, 2009, 41(5): 1557–1561. DOI:10.1016/j.transproceed.2009.01.097 |
| [3] | 付生军, 刘静, 李涛, 等. CYP3A5基因型与肾移植患者他克莫司血药浓度关系的系统评价[J]. 中国循证医学杂志, 2013, 13(12): 1440–1445. DOI:10.7507/1672-2531.20130247 |
| [4] | Hirano K, Naito T, Mino Y, et al. Impact of CYP3A5 genetic polymorphism on cross-reactivity in tacrolimus chemiluminescent immunoassay in kidney transplant recipients[J]. Clin Chim Acta, 2012, 414: S120–S124. DOI:10.1016/j.cca.2012.07.018 |
| [5] | Coto E, Tavira B. Pharmacogenetics of calcineurin inhibitors in renal transplantation[J]. Transplantation, 2009, 88(3 Suppl): S62–S67. |
| [6] | 赵富磊, 李骞, 张峻. 基因多态性对肾移植患者他克莫司药代动力学影响的研究现状[J]. 中国临床药理学杂志, 2017, 33(23): 2489–2491. |
| [7] | Meier-Kriesche HU, Li S, Gruessner RW, et al. Immunosuppression:evolution in practice and trends, 1994-2004[J]. Am J Transplant, 2006, 6(5pt2): 1111–1131. |
| [8] | 中华人民共和国国家卫生和计划生育委员会. 药物代谢酶和药物作用靶点基因检测技术指南(试行)概要[J]. 实用器官移植电子杂志, 2015, 3(5): 257–267. |
| [9] | Li D, Zhang GL, Lou YQ, et al. Genetic polymorphisms in MDR1 and CYP3A5 and MDR1 haplotype in mainland Chinese Han, Uygur and Kazakh ethnic groups[J]. Clin Pharm Ther, 2007, 32(1): 89–95. DOI:10.1111/jcp.2007.32.issue-1 |
| [10] | 李敏, 李峰, 高鑫. 基因多态性对他克莫司血药浓度影响的研究进展[J]. 实用医药杂志, 2017, 34(2): 162–164. |
| [11] | 丁晴, 冯端浩. CYP3A5基因多态性与临床合理用药[J]. 解放军药学学报, 2015, 31(5): 435–438. |
| [12] | 陈晨, 张晏洁, 贺小露, 等. 他克莫司个体化用药指南解读[J]. 医学研究生学报, 2017, 30(4): 342–347. |
| [13] | 张小东, 张际青, 尹航, 等. CYP3A5基因型对肾移植受者术后早期血他克莫司浓度的影响[J]. 中华器官移植杂志, 2009, 30(12): 717–721. DOI:10.3760/cma.j.issn.0254-1785.2009.12.003 |
| [14] | 林玲, 宋文利, 沈中阳, 等. 肾移植受者C YP3A5*3和CYP3A4*18B对他克莫司药动学的影响[J]. 中华器官移植杂志, 2012, 33(4): 220–224. |
| [15] | 潘晓东, 陈文伟, 倪晓洁, 等. 药物代谢酶CYP3A5基因多态性与肾移植术后他克莫司和环孢素A早期临床疗效的相关性[J]. 中国药理学与毒理学杂志, 2014, 28(6): 892–897. |
| [16] | 程晓莉, 李志荣, 颜学滔. CYP3A5*3基因多态性对环孢素药动学的影响[J]. 中国医院药学杂志, 2010, 30(8): 636–639. |
| [17] | 孙搏, 郭彦琨, 高君伟, 等. CYP3A基因多态性与肾移植术后不同时期环孢素浓度剂量个体差异的相关性研究[J]. 中国药师, 2017, 20(1): 91–93. |
| [18] | 何霞, 童荣生, 肖开春, 等. 他克莫司血药浓度影响因素的研究进展[J]. 中国药业, 2011, 20(11): 80. DOI:10.3969/j.issn.1006-4931.2011.11.058 |
| [19] | Hu RH, Lee PH, Tsai MK. Clinical influencing factors for daily dose, trough level, and relative clearance of tacrolimus in renal transplant recipients[J]. Transplant Proc, 2000, 32(7): 1689–1692. DOI:10.1016/S0041-1345(00)01413-5 |
| [20] | Zahir H, McLachlan AJ, Nelson A, et al. Population pharmacokinetic estimation of tacrolimus apparent clearance in adult liver transplant recipients[J]. Ther Drug Monit, 2005, 27(4): 422–430. DOI:10.1097/01.ftd.0000170029.36573.a0 |
| [21] | 张关敏, 李良, 陈文倩, 等. 他克莫司在中国肾移植患者中的群体药物动力学研究[J]. 药学学报, 2008, 43(7): 695–701. |
| [22] | 张鑫, 刘志红, 郑敬民, 等. 肾移植患者他克莫司血药浓度的影响因素[J]. 肾脏病与透析肾移植杂志, 2005, 14(4): 333–338. |
| [23] | Chow FS, Piekoszewski W, Jusko WJ. Effect of hematocrit and albumin concentration on hepatic clearance of tacrolimus (FK 506) during rabbit liver perfusion[J]. Drug Metab Dispos, 1997, 25(5): 610–616. |
| [24] | 张大伟, 许亮, 徐俊楠, 等. 肾移植受者术前甘油三酯代谢对移植肾早期功能恢复的影响[J]. 解放军医学杂志, 2017, 42(5): 427–431. DOI:10.11855/j.issn.0577-7402.2017.05.12 |
 2018, Vol. 44
2018, Vol. 44


