扩展功能
文章信息
- 杨文延, 刘强, 孙志娟, 杜利清, 徐畅, 王彦, 柳杨, 王芹
- YANG Wenyan, LIU Qiang, SUN Zhijuan, DU Liqing, XU Chang, WANG Yan, LIU Yang, WANG Qin
- 褪黑素对人非小细胞肺癌H1299细胞辐射敏感性的影响
- Effect of melatonin on radiosensitivity of non-small cell lung cancer H1299 cells
- 吉林大学学报(医学版), 2018, 44(03): 532-536
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 532-536
- 10.13481/j.1671-587x.20180314
-
文章历史
- 收稿日期: 2017-12-29
非小细胞肺癌(non-small cell lung cancer,NSCLC)是临床上最为常见的肺癌类型,其构成比占肺癌80%。NSCLC的主要治疗方式是放射治疗,但其较强的辐射抗性限制了放疗的疗效[1-2]。因此,增加NSCLC细胞的辐射敏感性,提高放疗效果显得尤为重要[3]。利用药物提高放射线对肿瘤细胞的杀伤率以增强放疗效果在临床上应用越来越普遍。褪黑素(melatonin, MLT)是松果体主要在夜间合成与分泌的一种具有多种生物活性的吲哚类物质。MLT可通过外界的光变化向机体传达昼夜节律的信息,进而调节并控制生物节律。此外,MLT还具有抗氧化、抗增殖、免疫调节以及调节内分泌的功能[4-6]。MLT与肿瘤的发生发展及治疗有密切的关系。研究[7-11]显示:在胃癌、结肠癌、肺癌、乳腺癌、胰腺癌以及肝癌中,MLT可以通过抑制肿瘤细胞的增殖诱导肿瘤细胞的凋亡,从而达到抗肿瘤的效果。研究[12]显示:MLT可导致NSCLC细胞凋亡。但MLT联合放疗对NSCLC细胞的影响目前尚未清楚。本研究旨在通过观察MLT联合放疗对NSCLC H1299细胞增殖和凋亡的影响以及细胞中核转录因子κB(nuclear factor kappa B, NF-κB)蛋白的磷酸化水平,探讨MLT在调节NSCLC细胞放射敏感性中的作用。
1 材料与方法 1.1 细胞培养人肺癌H1299细胞(本实验室保存)采用含10%胎牛血清的DMEM培养液在5% CO2、37℃恒温培养箱中培养,待细胞生长密度约为80%时进行传代培养。选择处于对数生长期的H1299细胞用于后续实验。
1.2 细胞分组和给药方式将细胞分为对照组、MLT组、照射组和照射+MLT组。其中,照射组和照射+ MLT组的照射条件:采用137Cs γ射线照射源(Autocell40,加拿大原子能有限公司)进行一次性照射,照射剂量为6 Gy,剂量率为1 Gy·min-1。MLT组和照射+ MLT组细胞给予MLT,在细胞克隆形成实验和细胞凋亡率检测实验中给予100 μmol·L-1MLT。
1.3 细胞克隆形成实验检测各组细胞克隆形成数将H1299细胞以毎皿800个细胞的浓度铺至60 mm培养皿中,待细胞贴壁后,按实验分组(对照组、MLT组、照射组和照射+MLT组)给予相应处理,继续培养10 d,出现肉眼可见的克隆。弃掉培养基,采用吉姆萨染液染色。计数肉眼可见的克隆,采用Image J软件统计各组细胞克隆形成数。
1.4 流式细胞术检测各组细胞凋亡率分别于照射后24和48 h弃掉培养液,采用不含EDTA的胰酶消化细胞,1 000 r·min-1离心5 min后收集悬浮细胞,采用预冷的PBS缓冲液洗涤细胞,调整每管细胞浓度为1×106mL-1,依次加入Annexin Ⅴ-FITC和PI试剂,室温避光15 min,流式细胞仪(BD Accuri C6型,美国BD公司)检测细胞凋亡率。Annexin-Ⅴ和PI双染色流式检测图分为4个象限:左下象限为活细胞,左上象限为坏死细胞,而右象限均为凋亡细胞,其中右上象限为晚期凋亡细胞,右下象限为早期凋亡细胞,计算细胞总凋亡率。细胞总凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%。
1.5 蛋白免疫印迹法检测H1299细胞中NF-κB蛋白磷酸化水平于照射后6 h收集对照组、MLT组、照射组和照射+MLT组(MLT给药浓度分别为100和500 μmol·L-1)的H1299细胞,采用RIPA裂解液(康为世纪生物科技有限公司)裂解细胞, 提取总蛋白,采用BCA蛋白浓度测定试剂盒(上海碧云天生物技术公司)测定其总蛋白浓度。取10 μg总蛋白上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,采用半干转移法将蛋白转移到聚偏二氟乙烯膜上,用含5%脱脂奶粉的封闭液室温封闭1 h, 采用兔抗小鼠NF-κB抗体(美国Abcam公司,抗体稀释浓度1:500)4℃孵育过夜,洗膜,室温孵育兔免疫原性辣根过氧化物酶标记的小鼠抗兔二抗(美国Proteintech公司,抗体稀释浓度1:5 000)1 h,洗膜后采用增强化学发光法检测NF-κB蛋白磷酸化水平。肉眼观察NF-κB蛋白条带的深浅程度,比较各组H1299细胞中NF-κB蛋白磷酸化水平。
1.6 统计学分析采用GraphPad Prism 5.0统计软件对数据进行统计学分析。各组细胞克隆形成数和细胞凋亡率均以x±s表示,组间比较采用t检验。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组H1299细胞克隆形成数与对照组(336.00±10.58)比较,MLT组H1299细胞克隆形成数(316.67±35.12)差异无统计学意义(t=0.913,P>0.05),照射组克隆形成数(260.00±10.00)明显减少(t=9.041,P < 0.01);与照射组比较,照射+ MLT组H1299细胞克隆形成数(184.67±15.01)明显减少(t=7.234,P < 0.01)。见图 1。
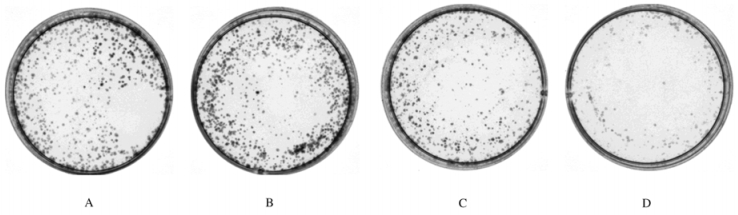
|
| A: Control group; B: MLT group; C: IR group; D: IR+ MLT group. 图 1 各组H1299细胞克隆形成数 Figure 1 Clone numbers of H1299 cells in various groups |
|
|
照射后24 h,与对照组(5.09%±0.34%)比较,照射组(10.15%± 1.71%)和MLT组(18.13%±1.64%)细胞凋亡率均升高,差异有统计学意义(t=5.020,t=13.525,P < 0.01);照射+ MLT组细胞凋亡率(25.71%±1.20%)明显高于照射组,差异有统计学意义(t=12.884,P < 0.01)。照射后48 h,与对照组(5.05%±0.37%)比较,照射组(16.54%±0.97%)和MLT组(11.59%±0.74%)细胞凋亡率均升高,差异有统计学意义(t=19.182,t=13.704,P < 0.01);照射+ MLT组细胞凋亡率(16.27%±0.69%)与照射组比较差异无统计学意义(t=0.394,P>0.05)。见图 2。
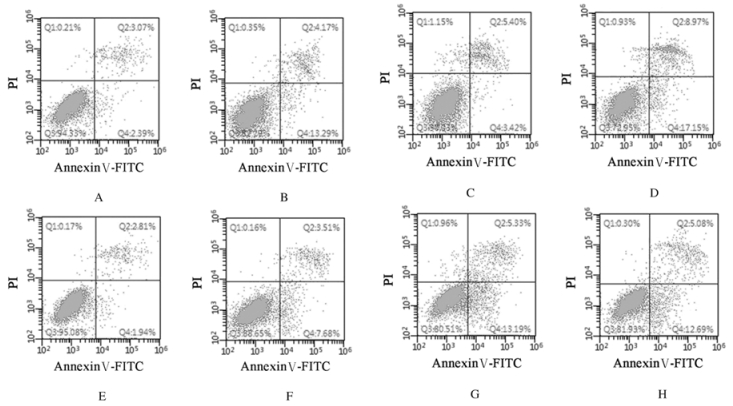
|
| 图 2 流式细胞术检测各组H1299细胞凋亡率 Figure 2 Apoptotic rates of H1299 cells in various groups detected by FCM |
|
|
与对照组比较,照射组H1299细胞中NF-κB蛋白磷酸化水平升高,MLT组H1299细胞中NF-κB蛋白磷酸化水平无明显差异;与照射组比较,照射+ MLT组(100和500 μmol·L-1)H1299细胞中NF-κB蛋白磷酸化水平降低。见图 3。
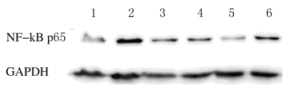
|
| Lane 1: Control group; Lane 2: IR group; Lane 3: MLT group (500 μmol·L-1MLT); Lane 4: MLT group (100 μmol·L-1MLT); Lane 5: IR+ MLT group (500 μmol·L-1MLT); Lane 6: IR+ MLT group (100 μmol·L-1MLT). 图 3 各组H1299细胞中NF-κB蛋白磷酸化水平电泳图 Figure 3 Electrophoregram of phosphorylation levels of NF-κB protein in H1299 cells in various groups |
|
|
肿瘤辐射耐受是肿瘤在接受放疗过程中逐渐适应理化环境的变化、产生放疗抵抗的现象。了解肿瘤细胞产生辐射耐受的机制和寻找具有辐射增敏作用的药物,对肿瘤的放射治疗具有重要意义[13]。NSCLC具有较强的辐射耐受性,这是临床放疗的一大障碍,因此如何利用药物增加NSCLC细胞的辐射敏感性非常重要。
近年来,MLT具有抗肿瘤的作用已被证实[7, 14]。研究[14]显示:在MLT作用下胰腺癌细胞凋亡率随着药物作用时间(72 h内)的延长逐渐升高,肿瘤细胞克隆形成数随着MLT给药浓度的增加而逐渐减少。为评价MLT联合放疗对NSCLC H1299细胞的抑瘤效应,本研究观察MLT联合放疗后H1299细胞增殖和凋亡变化的结果显示:MLT或放疗均能抑制肺癌H1299细胞的增殖,促进其凋亡,与上述文献[14]结论一致;而MLT联合放疗具有更好的抑瘤效应,提示MLT可增强H1299细胞的辐射敏感性,进而提高肿瘤放疗的疗效。
NF-κB是1986年由Sen和Baltimore 2位科学家从B淋巴细胞核提取物中检测到的核蛋白因子,能与免疫球蛋白κ轻链基因增强子κB序列特异性结合。NF-κB广泛存在于细胞中,当细胞受到外源性刺激时,NF-κB活化(即磷酸化),随后与基因启动子区域的核苷酸序列结合,启动基因转录,参与多种调节反应[15]。NF-κB参与细胞增殖、凋亡、生长分化、细胞周期以及免疫应答等生理过程,还参与肿瘤的发生发展。NF-κB在肿瘤细胞中持续性高表达,并调控其抗凋亡、促存活的靶基因及促进肿瘤细胞的生长增殖[16]。电离辐射可诱导肿瘤细胞中NF-κB进一步高表达,这可能是NSCLC具有辐射抵抗性的原因之一[17-18]。研究[19-20]显示:MLT对肿瘤细胞增殖的抑制作用可能与NF-κB的负调控有关。本研究结果显示:照射组H1299细胞中NF-κB蛋白磷酸化水平升高,这与文献报道的电离辐射可激活NF-κB的表达一致,而单纯MLT处理或MLT联合放疗均能降低H1299细胞中NF-κB蛋白磷酸化水平,提示MLT可能是通过负调控H1299细胞中NF-κB磷酸化水平进而提高H1299细胞的辐射敏感性。
本研究初步揭示了MLT提高H1299细胞辐射敏感性的机制。肿瘤产生辐射耐受的原因错综复杂,细胞周期阻滞、肿瘤微环境、自噬调节及肿瘤干细胞等均有助于增强肿瘤的辐射抵抗性[21]。未来期待从以上4个方面入手进行深入研究,阐明MLT增强H1299细胞辐射敏感性的分子机制,为解决NSCLC辐射抵抗性的难题奠定基础。
| [1] | 刘景涛, 邓垒, 张文珏, 等. 广泛期小细胞肺癌胸部IMRT后发生放射性肺炎的危险因素分析[J]. 国际放射医学核医学杂志, 2016, 40(2): 100–105. |
| [2] | Gomez-Casal R, Bhattacharya C, Ganesh N, et al. Non-small cell lung cancer cells survived ionizing radiation treatment display cancer stem cell and epithelial-mesenchymal transition phenotypes[J]. Mol Cancer, 2013, 12(1): 94. DOI:10.1186/1476-4598-12-94 |
| [3] | Ma W, Ma CN, Li XD, et al. Examining the effect of gene reduction in miR-95 and enhanced radiosensitivity in non-small cell lung cancer[J]. Cancer Gene Ther, 2016, 23(2/3): 66–71. |
| [4] | 王萍, 周伟. 褪黑素的生物学作用及研究进展[J]. 国际儿科学杂志, 2007, 34(1): 69–72. |
| [5] | Reiter RJ, Mayo JC, Tan DX, et al. Melatonin as an antioxidant:under promises but over delivers[J]. J Pineal Res, 2016, 61(3): 253–278. DOI:10.1111/jpi.12360 |
| [6] | Cardinali DP, Esquifino AI, Srinivasan V, et al. Melatonin and the immune system in aging[J]. Neuroimmunomodulation, 2008, 15(4-6): 272–278. DOI:10.1159/000156470 |
| [7] | Xin Z, Jiang S, Jiang P, et al. Melatonin as a treatment for gastrointestinal cancer:a review[J]. J Pineal Res, 2015, 58(4): 375–387. DOI:10.1111/jpi.2015.58.issue-4 |
| [8] | Hill SM, Belancio VP, Dauchy RT, et al. Melatonin:an inhibitor of breast cancer[J]. Endocr Relat Cancer, 2015, 22(3): R183–R204. DOI:10.1530/ERC-15-0030 |
| [9] | Alonso-Gonzalez C, Gonzalez A, Martinez-Campa C, et al. Melatonin sensitizes human breast cancer cells to ionizing radiation by downregulating proteins involved in double-strand DNA break repair[J]. J Pineal Res, 2015, 58(2): 189–197. DOI:10.1111/jpi.12205 |
| [10] | Jardim-Perassi BV, Lourenco MR, Doho GM, et al. Melatonin regulates angiogenic factors under hypoxia in breast cancer cell lines[J]. Anticancer Agents Med Chem, 2016, 16(3): 347–358. DOI:10.2174/1871520615666150511094201 |
| [11] | Borin TF, Arbab AS, Gelaleti GB, et al. Melatonin decreases breast cancer metastasis by modulating Rho-associated kinase protein-1 expression[J]. J Pineal Res, 2016, 60(1): 3–15. DOI:10.1111/jpi.12270 |
| [12] | Kim W, Jeong JW, Kim JE. CCAR2 deficiency augments genotoxic stress-induced apoptosis in the presence of melatonin in non-small cell lung cancer cells[J]. Tumour Biol, 2014, 35(11): 10919–10929. DOI:10.1007/s13277-014-2370-6 |
| [13] | 霍小东, 王慧星, 阎卫亮, 等. 血管内皮抑制素对125I近距离照射裸鼠肺癌移植瘤的增敏效应研究[J]. 国际放射医学核医学杂志, 2016, 40(5): 357–362. |
| [14] | Li W, Wu J, Li Z, et al. Melatonin induces cell apoptosis in Mia PaCa-2 cells via the suppression of nuclear factor-κB and activation of ERK and JNK:A novel therapeutic implication for pancreatic cancer[J]. Oncol Rep, 2016, 36(5): 2861–2867. DOI:10.3892/or.2016.5100 |
| [15] | 赵蔚然, 许峰. NF-κB与肿瘤生成[J]. 西部医学, 2010, 22(9): 1729–1731. |
| [16] | 王宁, 陈海滨. NF-κB及其在肿瘤发生发展中的作用[J]. 解剖学研究, 2008, 30(2): 141–144. |
| [17] | Jung M, Dritschilo A. NF-kappa B signaling pathway as a target for human tumor radiosensitization[J]. Semin Radiat Oncol, 2001, 11(4): 346–351. DOI:10.1053/srao.2001.26034 |
| [18] | Baldwin AS. Control of oncogenesis and cancer therapy resistance by the transcription factor NF-kappaB[J]. J Clin Invest, 2001, 107(3): 241–246. DOI:10.1172/JCI11991 |
| [19] | Li W, Fan M, Chen Y, et al. Melatonin induces cell apoptosis in AGS cells through the activation of JNK and P38 MAPK and the suppression of nuclear factor-kappa B:anovel therapeutic implication for gastric cancer[J]. Cell Physiol Biochem, 2015, 37(6): 2323–2338. DOI:10.1159/000438587 |
| [20] | León J, Casado J, Jiménez Ruiz SM, et al. Melatonin reduces endothelin-1 expression and secretion in colon cancer cells through the inactivation of FoxO-1 and NF-κβ[J]. J Pineal Res, 2014, 56(4): 415–426. DOI:10.1111/jpi.2014.56.issue-4 |
| [21] | 刘珊, 蒋永新, 熊伟, 等. 肿瘤放疗抵抗机制研究进展[J]. 国际肿瘤学杂志, 2014, 41(10): 747–749. DOI:10.3760/cma.j.issn.1673-422X.2014.10.009 |
 2018, Vol. 44
2018, Vol. 44


