扩展功能
文章信息
- 张蕾, 张琨, 王德利, 任小红, 崔娜, 刘洋, 赵庭勋
- ZHANG Lei, ZHANG Kun, WANG Deli, REN Xiaohong, CUI Na, LIU Yang, ZHAO Tingxun
- 桦褐孔菌皂苷的优化提取及其对HepG2细胞脂肪堆积的清除作用
- Optimal extraction of Phaeoporus obliquus saponins and its scavengingeffect on fat accumulation in HepG2 cells
- 吉林大学学报(医学版), 2018, 44(03): 526-531
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 526-531
- 10.13481/j.1671-587x.20180313
-
文章历史
- 收稿日期: 2017-09-18
2. 吉林大学第二医院研究中心, 吉林 长春 130041;
3. 吉林大学生命科学学院生物实验示范中心, 吉林 长春 130012;
4. 中国科学院上海药物研究所药物制剂中心, 上海 201210
2. Research Center, Second Hospital, Jilin University, Changchun 130041, China;
3. Domonstration Center for Biological Experiments, School of Life Sciences, Jilin University, Changchun 130012, China;
4. Center of Pharmaceutical Preparations, Chinese Academy of Sciences, Shanghai Institute of Materia Medica, Shanghai 201210, China
非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)经常伴随中心性肥胖、高血脂症、胰岛素抵抗以及糖耐量异常等代谢综合征,严重危害人类健康[1-4]。近年来,对NAFLD的研究很多,但其发病机制尚不清楚。因此,寻找有效的治疗NAFLD药物非常重要。桦褐孔菌(Phaeoporus obliquus)又称白桦茸,其化学成分包括多糖类化合物、芳香物质、多酚类化合物和三萜类化合物等物质[5-8],具有重要的药用价值。从16世纪至今,桦褐孔菌一直被作为一种民间药物,在防治糖尿病、高血压、艾滋病以及抗癌和抗衰老等方面具有显著的效果,但不良反应较多[9-10],目前有关桦褐孔菌对NAFLD的治疗作用尚未见相关研究报道。本实验模拟临床上NAFLD的病理特点,优化提取桦褐孔菌皂苷提取物,并将其作用于HepG2细胞,从细胞水平评价桦褐孔菌皂苷提取物对细胞脂质堆积的作用以及对细胞中甘油三酯(TG)水平的影响,从而探讨其在防治NAFLD方面的药用价值,为开发预防和治疗NAFLD的药物提供理论依据。
1 材料与方法 1.1 细胞、主要试剂和仪器HepG2细胞由哈尔滨工业大学赠送,为实验室传代保存。桦褐孔菌购于黑龙江省绥芬河市。MTT溶液、TG试剂盒、油酸、油红O公司和细胞裂解液购于上海源叶生物科技有限公司,DMEM细胞培养基、血清和胰蛋白酶购于美国Hylone公司,乙醇和异丙醇购于北京化工厂。粉碎机(戴声设备有限公司),超声波清洗机(杭州法兰特超声波科技有限公司),电子天平(QUINTIX224-1CN Sartorius,R210,德国赛多利斯公司),旋转蒸发仪(R300,瑞士BUCHI有限公司),电子显微成像系统(CX31,日本Olympus公司),酶标仪(美国Synergy HTX BioTek公司),静音混合器(MT-360,中国其林贝尔仪器制造有限公司)。
1.2 桦褐孔菌皂苷的提取和总皂苷水平测定将桦褐孔菌粉末过筛,取更细腻的粉末后准确称取5 g,采用30%乙醇将其溶解,根据设定的时间、温度、料液比和超声波功率处理,用80%乙醇沉淀多糖,4 000 r·min-1离心5 min,取上清液,减压浓缩至浸膏后水浴蒸干,30 mL去离子水溶解,依次用等体积正丁醇溶液萃取3~5次,利用旋转蒸发仪将提取的正丁醇层萃取液进行减压浓缩并蒸干处理后,得粗品桦褐孔菌总皂苷。参照文献[11-12]测定皂苷标准曲线法测定总皂苷水平。
1.3 单因素试验检测桦褐孔菌皂苷提取量的影响因素设计桦褐孔菌皂苷提取物单因素实验的变量条件分别为提取时间、提取温度、料液比和超声频率,从而确定正交实验中各因素的水平。
1.4 正交试验优化提取工艺在单因素试验基础上,利用正交试验表L9(34)进行四因素三水平正交实验,各因素和水平见表 1。
| Level | Factor | |||
| Time (t/min) |
Solid-liquid ratio |
Extraction temperature (θ/℃) |
Ultrasonic power(η/%) |
|
| 1 | 20 | 1:10 | 30 | 40 |
| 2 | 30 | 1:15 | 40 | 50 |
| 3 | 40 | 1:20 | 50 | 60 |
复苏HepG2细胞,将实验室冻存的HepG2细胞从液氮罐中取出,迅速置于37 ℃水浴锅中融化,用PBS清洗后,1 000 r·min-1离心去上清后将其置于含10% FBS的DMEM培养基中,培养条件:37 ℃、5% CO2和饱和湿度。将培养好的HepG2细胞每隔1d进行传代培养,并将处于对数生长期细胞转移至含10% FBS的高糖型DMEM培养基备用。
将处于对数生长期HepG2细胞接种于96孔细胞培养板中,利用细胞计数板计数,使每孔细胞的接种量达到104个,置于37 ℃、5% CO2培养箱中孵育24 h。设对照组和给药组,给药组桦褐孔菌皂苷提取物终浓度分别为60.000、6.000、0.600、0.060和0.006 g·L-1,每组设置3个平行孔,继续培养24 h后,每孔加入5 g·L-1MTT溶液10 μL,继续在37 ℃、5% CO2培养箱中培养4 h后取出,缓慢吸去培养液,每孔加入100 μL DMSO,振荡5~10 min,于酶标仪490 nm处测定吸光度(A)值。根据测得的A值计算细胞存活率,选择细胞存活率达到70%以上时的桦褐孔菌皂苷浓度为安全浓度。细胞存活率=给药组A值/对照组A值×100%。
1.6 细胞中TG清除率的检测给药组桦褐孔菌皂苷提取物终浓度分别为0.006、0.060和0.600 g·L-1,不给药无细胞的空白孔为对照组,不给药含HepG2细胞孔为模型组。细胞中TG水平检测参照文献[13-15]对细胞中TG水平的测量法。TG清除率= (不给药组A值-给药组A值) /不给药组A值×100%,A值为酶标仪在500nm处的读数。
1.7 油红O染色检测各组细胞形态表现油红O工作液配制:首先配制0.5%油红O储备液,将油红O粉末溶于异丙醇中,储备液用蒸馏水稀释后过滤2次,至液体澄清为止[16-17]。
将HepG2细胞接种于24孔板,置于37 ℃、5% CO2培养箱中孵育24 h后取出,分为对照组,模型组,低、中和高浓度(0.600、0.060和0.006 g·L-1)桦褐孔菌皂苷组,各组所加培养基同“1.6”中所述。孵育24 h后用油红O工作液染色30 min,蒸馏水反复吹洗2次后,在倒置显微镜下观察染色效果。
1.8 统计学分析采用SPSS13.0统计软件对数据进行统计学分析。各组HepG2细胞的存活率和细胞中TG清除率以x±s表示,多组间均数比较采用LSD法。以P < 0.05为差异有统计学意义。
2 结果 2.1 桦褐孔菌皂苷类物质提取的单因素实验 2.1.1 桦褐孔菌皂苷的标准曲线配制人参皂苷标准品浓度分别为10、20、30、40、50、60和70 mg·L-1,标准曲线方程为y=0.006x+0.013,R2=0.999。
2.1.2 提取时间、超声功率、提取温度和料液比时桦褐孔菌皂苷类物质的提取率提取时间为30 min、超声功率为30%、提取温度为40℃、料液比达到1:20时桦褐孔菌皂苷提取率最大(图 1)。因此,选择提取时间为20~40 min、超声功率为30%~50%、提取温度为30℃~50℃、料液比为1:10~1:20为进一步优化条件。

|
| A:Extraction time; B: Ultrasonic power; C:Extraction temperature; D:Solid-liquid ratio. 图 1 不同条件时桦褐孔菌皂苷的提取率 Figure 1 Extraction rates of Phaeoporus obliquus saponins under different conditions |
|
|
通过正交实验确定桦褐孔菌皂苷的最佳提取工艺。正交实验结果表明:影响桦褐孔菌皂苷类物质提取量的因素主次顺序为超声功率>提取温度>提取时间>料液比(D>C>A>B),即超声功率和超声温度对桦褐孔菌皂苷提取效果影响相对较大,最佳超声功率和提取温度时桦褐孔菌皂苷提取率最大;与提取时间和料液比比较,最佳超声功率和提取温度时桦褐孔菌总皂苷提取率达到最大(P < 0.05)。综合以上条件,桦褐孔菌皂苷的最佳提取条件为:A2B2C1D2,即按1:15的料液比在温度30℃下提取30 min,超声功率为50%,乙醇浓度为30%。见表 2。
| (n=3) | |||||
| Factor number | Extraction time (t/min) |
Solid-liquid ratio |
Extraction temperature(θ/℃) |
Ultrasonic power (η/%) |
Avalue |
| 1 | 20 | 1:10 | 30 | 40 | 0.567 |
| 2 | 20 | 1:15 | 40 | 50 | 0.583 |
| 3 | 20 | 1:20 | 50 | 60 | 0.563 |
| 4 | 30 | 1:10 | 40 | 60 | 0.650 |
| 5 | 30 | 1:15 | 50 | 40 | 0.610 |
| 6 | 30 | 1:20 | 30 | 50 | 0.688 |
| 7 | 40 | 1:10 | 50 | 50 | 0.623 |
| 8 | 40 | 1:15 | 30 | 60 | 0.660 |
| 9 | 40 | 1:20 | 40 | 40 | 0.391 |
| K1 | 0.571 | 0.613 | 0.638 | 0.523 | |
| K2 | 0.649 | 0.618 | 0.541 | 0.631 | |
| K3 | 0.558 | 0.547 | 0.599 | 0.623 | |
| Range | 0.091 | 0.071 | 0.097 | 0.108 | |
对正交实验结果进行方差分析,各因素对皂苷提取率影响的结果表明:提取时间、超声功率、提取温度和料液比对提取率有影响。见表 2。
2.3 各组HepG2细胞存活率随着桦褐孔菌皂苷浓度的增加,HepG2细胞存活率降低,说明桦褐孔菌皂苷对细胞有一定的毒害作用。当浓度小于0.600 g·L-1时,细胞存活率>70%,对细胞毒害作用相对较小,为了研究桦褐孔菌皂苷对细胞脂肪堆积的影响,将桦褐孔菌皂苷给药浓度设定为0.006~0.600 g·L-1。见表 3。
| Group | Concentration (g·L-1) |
A(490) | Survival rate (η/%) |
| Control | 0 | 1.232±0.013 | 100.00 |
| Treatment | 0.006 | 1.135±0.635 | 92.12 |
| 0.060 | 1.041±0.479 | 84.49 | |
| 0.600 | 0.882±0.398 | 71.59 | |
| 6.000 | 0.659±1.013 | 53.49 | |
| 60.000 | 0.467±1.271 | 37.90 |
为减少高浓度桦褐孔菌皂苷对细胞的毒性作用,选择小于0.600g·L-1浓度作为实验浓度。与对照组比较,模型组HepG2细胞中TG水平明显升高(P < 0. 05),表明HepG2细胞脂肪堆积模型成功建立[14]。与模型组比较,0.060 g·L1桦褐孔菌皂苷组HepG2细胞中TG水平升高(P < 0.05);与模型组比较,0.600 g·L-1桦褐孔菌皂苷组HepG2细胞中TG水平升高(P < 0.01),并随着桦褐孔菌皂苷浓度升高,TG清除率也逐渐升高,具有剂量依赖性,其中0.600 g·L-1桦褐孔菌皂苷组细胞中TG清除率最高,达到32.22%。见表 4。
| (n=6, x±s) | |||
| Group | Concentration (g·L-1) |
Level of TG (m/mg) |
Clearance rate of TG(η/%) |
| Control | 0 | 0.462±0.563 | 0 |
| Model | 0 | 1.746±0.631* | 0 |
| Treatment | 0.006 | 1.663±0.480 | 4.70 |
| 0.060 | 1.482±0.437△ | 15.12 | |
| 0.600 | 1.189±0.546△△ | 32.22 | |
| * P < 0.05 compared with control group; △ P < 0.05, △△ P < 0.01 compared with model group. | |||
与对照组比较,模型组细胞中出现大量的红色脂滴,同时伴随相互融合现象,说明成功地建立细胞脂肪堆积模型,并随着桦褐孔菌皂苷浓度的升高,HepG2细胞中红色脂滴数目逐渐减少,且脂滴体积变小。在各浓度桦褐孔菌皂苷组中,0.006 g·L-1桦褐孔菌皂苷组的作用效果不明显; 与模型组比较,0.060 g·L-1桦褐孔菌皂苷组细胞中脂质堆积情况稍有改善,细胞中脂质相互融合的现象明显减轻; 0.600 g·L-1桦褐孔菌皂苷组细胞中脂质堆积现象明显减轻,并发现脂滴数目明显减少。见图 3(插页四)。
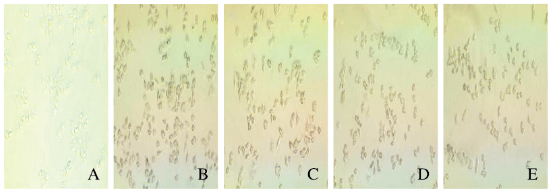
|
| A:Control group; B:Model group; C-E:Treatment groups(0.006, 0.060 and 0.600 mg·L-1 Phaeoporus obliquus saponins). 图 3 各组HepG2细胞中脂质堆积情况(×10) Figure 3 Lipid accumulation in HepG2 cells in various groups(×10)(seen on page 530in paragraph) |
|
|
NAFLD发病率呈现逐年升高的趋势,已经成为一种严重危害人类健康的世界性疾病。NAFLD是导致肝功能异常的主要原因,肝脏脂肪积聚是其典型特征,但并不能采用单一机制解释其发病的机制。TG是NAFLD患者肝脏中蓄积的主要脂质,是体内TG合成与转化失衡的结果[18]。
因为游离脂肪酸中含油酸水平最高,所以选择油酸来诱导建立肝细胞脂肪堆积模型,符合NAFLD形成的病理生理过程,杨林辉等[19]采用1 mmol·L-1油酸诱导细胞24 h后,成功建立肝细胞脂肪堆积模型。采用上述诱导方法建立HepG2细胞脂肪堆积模型,可使细胞中TG大量堆积,但细胞损伤不严重,细胞状态良好。因此,本课题组选取1 mmol·L-1油酸诱导HepG2细胞的脂肪堆积,并可产生氧化应激状态。在单因素实验的基础上通过正交实验得到桦褐孔菌皂苷的最佳提取条件(A2B2C1D2),将提取的桦褐孔菌皂苷提取物作用于HepG2细胞,并选择NAFLD常规检测指标评价桦褐孔菌皂苷对细胞中脂肪堆积的作用效果。本研究结果显示:桦褐孔菌皂苷提取物在质量浓度0.600 g·L-1时均对HepG2细胞增殖无明显影响,0.600 g·L-1桦褐孔菌皂苷对油酸诱导的HepG2细胞脂肪累积具有促进作用,随着浓度的增加可明显降低细胞中TG的累积,量效关系明显。与模型组比较,0.600 g·L-1桦褐孔菌皂苷组HepG2细胞中TG水平降低,细胞中TG清除率可达32.22%,并且具有剂量依赖性。油红O染色实验结果显示:3个浓度桦褐孔菌皂苷提取物均可以改善细胞内脂质堆积的现象,其中0.600 g·L-1桦褐孔菌皂苷组中脂滴数目明显减少,说明细胞中脂质堆积现象明显减轻,研究者[17, 20-21]在探讨泽泻汤对油酸诱导HepG2细胞脂肪堆积的抑制作用实验中也发现泽泻汤可以改善细胞中脂质堆积现象,这与本研究结果一致。本研究结果表明:桦褐孔菌皂苷提取物具有一定的清除细胞中脂肪堆积的作用,本文作者推测其在脂肪肝治疗方面也具有潜在的药用价值,但目前桦褐孔菌皂苷的降脂机制尚未明确,具体的降脂机制还有待于进一步研究。
| [1] | Abdelmalek MF, Diehl AM. Nonalcoholic fatty liver disease as a complication of insulin resistance[J]. Med Clin North Am, 2007, 91(6): 1125–1149. DOI:10.1016/j.mcna.2007.06.001 |
| [2] | Chow WC, Tai ES, Lian SC, et al. Significant non-alcoholic fatty liver disease is found in non-diabetic, pre-obese Chinese in Singapore[J]. Singapore Med J, 2007, 48(8): 752–757. |
| [3] | Samuel VT, Liu ZX, Qu X, et al. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease[J]. J Biol Chem, 2004, 279(31): 32345–32353. DOI:10.1074/jbc.M313478200 |
| [4] | 侯晓琳, 周培, 杨小林, 等. 竹节参皂苷Ⅴ对油酸诱导HepG2细胞脂肪堆积的影响作用[J]. 海峡药学, 2017, 29(3): 38–40. |
| [5] | Shin Y, Tamai Y, Terazawa M. Chemical constituents of Inonotus boliquus, a new triterpene, 21, 24-cyclopentalanosta-3β, 21, 25-triol-8-ene from sclera-tium[J]. Wood Res Soc, 2001, 47(9): 313–316. |
| [6] | Cui Y, Kim DS, Park KC. Antioxidant effect of Inonotus obliquus[J]. Eth Pha, 2005, 96(1/2): 79–85. |
| [7] | Kim YO, Park HW, Kim JH, et al. Anti-cancer effect and sructural characterization ofendo-polysacchride from cultivated mycelia of Inonotusobliquus[J]. Life Sci, 2006, 79(1): 72–80. DOI:10.1016/j.lfs.2005.12.047 |
| [8] | Song HS, Lee YJ, Kim SK, et al. Down regulatory effect of AGI-1120(α-glucosidase inhibitor)and Chagamushoom(Inonotus obliquus)on cellular NF-kB acti-vation and their antioxidant activity[J]. Kor Jph, 2004, 35(9): 92–97. |
| [9] | 杜秀菊, 徐伟, 穆红梅, 等. 桦褐孔菌多糖的药理活性与化学结构研究进展[J]. 食用菌学报, 2012, 19(1): 100–104. |
| [10] | 李宏. 桦褐孔菌多糖的提取工艺优化及其对小鼠免疫功能的影响[J]. 赤峰学院学报:自然科学版, 2012, 28(2): 128–130. |
| [11] | 计红芳, 张令文, 孙科祥, 等. 玉米须总皂苷的微波辅助提取及抑菌活性研究[J]. 中国食品添加剂试验研究, 2012, 11(3): 103–107. |
| [12] | 陈勋, 于海宁, 唐德松, 等. 苦瓜皂甙快速分离纯化方法研究[J]. 食品科学, 2004, 25(2): 114–117. |
| [13] | Cousin SP, Hugl SR, Wrede CE, et al. Free fatty acid -induced inhibition of glucose and insulin-like growth factor I-induced deoxyribonucleic acid synthesis in the pancreatic beta-cell line INS-1[J]. Endocrinology, 2001, 142(1): 229–240. DOI:10.1210/endo.142.1.7863 |
| [14] | 陈静, 祁东利, 张春风, 等. 人参皂苷Rb1对油酸诱导HepG2细胞脂肪堆积的影响作用[J]. 中国野生植物资源, 2013, 32(2): 20–23. |
| [15] | 孙丽娜, 杨中林. 川续断皂苷对油酸诱导细胞脂肪堆积的干预作用[J]. 药学与临床研究, 2014, 22(4): 326–328. |
| [16] | 丁晓东, 范建高. 非酒精性肝脂肪变性和脂肪性肝炎的发生机制[J]. 现代消化及介入诊疗, 2009, 14(4): 237–242. |
| [17] | 李甜, 廖茂梁, 郑雅楠, 等. 泽泻汤对油酸诱导HepG2细胞脂肪堆积的抑制作用[J]. 现在药物与临床, 2017, 32(5): 772–775. |
| [18] | Sonia MN, Rexford SA. Metabolic basis of obesity[J]. Springer New York, 2011(10): 219–227. |
| [19] | 杨林辉, 陈东风. 油酸诱导培养肝细胞脂肪变性模型的建立[J]. 重庆医学, 2007, 36(8): 698–700. |
| [20] | 魏颖, 鲁军, 刘艳, 等. 玉米低聚肽对Hep G2细胞脂肪堆积和抗氧化活性的影响[J]. 食品科技, 2013, 38(10): 190–193. |
| [21] | 李明辉, 刘洋, 陈冲, 等. 自体脂肪源性干细胞联合无菌生物护创膜对慢性创面愈合的影响[J]. 解放军医学杂志, 2016, 41(12): 1025–1030. DOI:10.11855/j.issn.0577-7402.2016.12.11 |
 2018, Vol. 44
2018, Vol. 44


