扩展功能
文章信息
- 周刘祥, 林琳, 胡鑫敏, 王晓春
- ZHOU Liuxiang, LIN Lin, HU Xinmin, WANG Xiaochun
- 内分泌腺性血管内皮生长因子对结肠癌LoVo细胞增殖和迁移的促进作用
- Promotion effect of endocrine gland-derived vascular endothelial growth factor on proliferation and migration of colon cancer LoVo cells
- 吉林大学学报(医学版), 2018, 44(03): 516-520
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 516-520
- 10.13481/j.1671-587x.20180311
-
文章历史
- 收稿日期: 2017-09-06
结直肠癌是消化系统常见恶性肿瘤,其在中国居肿瘤发病率的第5位,居肿瘤死亡率的第3位,特别是晚期结直肠癌患者生存率较低,需要进行深入研究[1-2]。2001年研究者[3]发现一种可以特异性促进内分泌腺源毛细血管生长的内分泌腺性血管内皮生长因子(endocrine gland-derived vascular endothelial growth factor, EG-VEGF),与已知的血管内皮生长因子(VEGF)有相似作用,还可特异性地促进胃肠道平滑肌收缩,因此也命名为前动力蛋白1(prokineticin1,PROK1)。EG-VEGF在结肠癌组织中表达,在结肠癌组织的增殖和血管形成中扮演重要角色;EG-VEGF可通过丝裂原活化蛋白激酶和蛋白激酶B等信号通路影响肿瘤细胞的增殖、周期及迁移[4-6]。董延琥等[7]发现:EG-VEGF在结肠癌组织中呈阳性表达, 且与结肠癌的转移有关联;Goi等[8]发现:VEGF和EG-VEGF在结肠癌组织中共表达时患者预后差,但VEGF和EG-VEGF是结肠癌预后的独立影响因子。EG-VEGF对结肠癌的作用使其成为结肠癌免疫治疗的潜力因子。干扰EG-VEGF基因,或者加入EG-VEGF抗体可探讨其与结肠癌细胞增殖和迁移的关系。本研究首次采用逆向思维将EG-VEGF与结肠癌LoVo细胞共培养,探讨EG-VEGF对结肠癌细胞增殖、周期及迁移的影响,为结肠癌的免疫治疗提供依据。
1 材料与方法 1.1 细胞、主要试剂和仪器结肠癌LoVo细胞购于中南大学高等研究中心细胞库。RPMI 1640、2.5 g·L-1胰酶、不含EDTA的2.5 g·L-1胰酶和胎牛血清(美国Gibico公司),二甲基亚砜(DMSO)和噻唑蓝(美国Sigma公司),EG-VEGF(美国Peprotech公司),结晶紫和4%多聚甲醛(中国Biosharp公司)。超净工作台和酶标仪(美国伯乐公司),荧光显微镜(日本Olympus公司),CO2培养箱(美国Thermo Scientific公司),普通离心机、高速离心机和-80 ℃冰箱(美国Eppendorf公司)。
1.2 细胞培养和传代结肠癌LoVo细胞采用含10%胎牛血清的RPMI1640培养基,常规培养于37℃、5%CO2培养箱中。待细胞融合率达90%以上时,以2.5 g·L-1胰蛋白酶消化,按照1:2传代,加入含10%FBS的RPMI1640培养基吹打成细胞悬液,进行细胞计数,调整细胞浓度铺板后置于37℃、5%CO2饱和湿度培养箱中培养,用于后续实验。
1.3 细胞分组和处理培养结肠癌LoVo细胞,选择对数生长期细胞并随机分为对照组(吸取原有培养基,加入含10% FBS的RPMI1640培养基或无血清RPMI1640培养基)和EG-VEGF组(吸取原有培养基,加入含有50、100和200μg·L-1 EG-VEGF的培养基),在培养箱中培养12、24、48和72 h,然后分别根据相应的实验需求,测定各组LoVo细胞的增殖活性、细胞周期和细胞迁移率。
1.4 MTT增殖实验检测各组LoVo细胞的增殖活性采用50、100和200 μg·L-1 EG-VEGF分别处理结肠癌LoVo细胞作为50、100和200μg·L-1 EG-VEGF组,不加入EG-VEGF的LoVo细胞为对照组,每组设6个复孔。取对数生长期细胞,PBS洗涤3次,采用2.5 g·L-1胰蛋白酶消化,采用含10%FBS的培养基终止消化反应,于37℃、1 000 r·min-1离心5 min后弃上清,加入含10%FBS的RPMI1640培养基吹打混匀,调整细胞浓度为20 000mL-1,取96孔细胞培养板每孔接种200μL细胞悬液,置于37℃、5%CO2培养箱继续培养过夜,第2天加入含有EG-VEGF的细胞培养液,并在24、48、72和96 h(即EG-VEGF处理24、48、72和96 h)4个时间点时每孔加入20μL MTT试剂,置于37℃、5%CO2培养箱温育4h后,吸去每孔中培养基后加入100 μL DMSO充分溶解。采用酶标仪于波长490 nm处检测吸光度(A)值,实验重复3次。以A值表示细胞增殖活性。
1.5 流式细胞术检测各组不同细胞周期结肠癌LoVo细胞百分率结肠癌LoVo细胞接种于6孔板中(2×105 mL-1),贴壁12 h后分组,对照组不加EG-VEGF培养液,实验组加入100μg·L-1 EG-VEGF于培养液中继续培养。于37 ℃、5%CO2培养箱中培养。24 h后收集细胞并制成单细胞悬液,每个样本细胞浓度为(1 ~ 2)×106mL-1,1 000 r·min-1离心5 min,弃上清,采用70%乙醇于-20℃冰箱过夜固定,次日送至北京鼎国昌盛生物技术公司流式细胞周期检测。采用NovoExpress 1.1.0软件分析计算细胞周期中各期细胞百分率。实验重复3次。
1.6 细胞划痕实验检测结肠癌LoVo细胞迁移率采用Marker笔在24孔板背后均匀地划横线,横穿过孔,每孔2条线。首先在孔中加入约5×105mL-1对数生长期的LoVo细胞;第2天采用枪头比对直尺尽量垂至于背后的横线划痕,枪头不能倾斜,并采用PBS轻轻冲洗3次,洗去漂浮的细胞,照相,此刻测量1个距离后,对照组只加无血清培养液(不加入EG-VEGF),实验组加入100μg·L-1 EG-VEGF于无血清培养液中继续培养,置入37 ℃、5%CO2培养箱培养;24 h后照相并再次测量细胞爬行距离,在倒置显微镜下观测划痕宽度,计算细胞迁移率。细胞迁移率=(初始划痕宽度-实验时间点划痕宽度)/初始划痕宽度×100%。实验重复3次。
1.7 Transwell实验检测各组结肠癌LoVo细胞迁移数选择不同浓度(50、100和200μg·L-1)EG-VEGF处理的结肠癌LoVo细胞为50、100和200μg·L-1 EG-VEGF组,不加EG-VEGF的LoVo细胞为对照组,每组设3个复孔。取对数生长期细胞采用PBS洗涤3次,2.5 g·L-1胰蛋白酶消化反应,含10%FBS的RPMI1640培养基终止消化,1 000 r·min-1离心5 min,弃上清,加入无血清的RPMI1640培养基吹打混匀,调整细胞浓度为5×105 mL-1,在Transwell小室的下室加入600μL含不同浓度(50、100和200μg·L-1)EG-VEGF的培养基,在上室加入100μL混匀的细胞悬液,置于37℃、5%CO2培养箱培养24 h弃去培养基,PBS洗涤3次,4%多聚甲醛固定10 min,0.1%结晶紫染色15 min,采用棉签小心擦去膜上面的细胞,PBS洗涤3次后晾干,采用显微图像采集系统进行观察并照相,随机选取6个低倍视野(×100)进行细胞计数。实验重复3次。
1.8 统计学分析采用SPSS17.0统计软件进行统计学分析。各组结肠癌LoVo细胞增殖活性、各细胞周期百分率、细胞迁移率和迁移细胞数以x ±s表示,结肠癌LoVo细胞增殖活性和迁移细胞数组间比较采用两样本均数t检验,细胞周期百分率和细胞迁移率组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 各组结肠癌LoVo细胞增殖活性3种不同浓度(50、100和200 μg·L-1)EG-VEGF培养液处理结肠癌LoVo细胞12、24和72 h时,与对照组比较,各浓度EG-VEGF组LoVo细胞增殖活性(A值)虽升高但不明显;而在48 h时EG-VEGF组细胞增殖活性(0.567±0.004、0.676±0.006、0.732±0.007)明显高于对照组(0.481±0.003),差异有统计学意义(P < 0.05)。随着EG-VEGF浓度的升高,细胞增殖活性升高,但100和200μg·L-1 EG-VEGF组细胞增殖活性比较差异无统计学意义(P>0.05)。因此本研究选择100μg·L-1作为实验浓度进行细胞周期实验。见图 1。
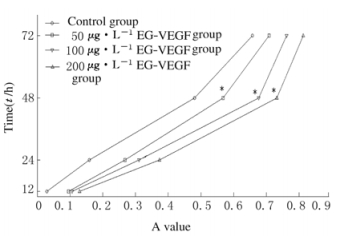
|
| *P < 0.05 control group. 图 1 各组结肠癌LoVo细胞的增殖活性 Figure 1 Proliferation activities of colon cancer LoVo cells in various groups |
|
|
与对照组比较,100μg·L-1 EG-VEGF组G0/G1期LoVo细胞百分率降低(P < 0.05),S期LoVo细胞百分率升高(P < 0.05),G2+M期LoVo细胞百分率变化不明显。见图 2(插页三)和表 1。
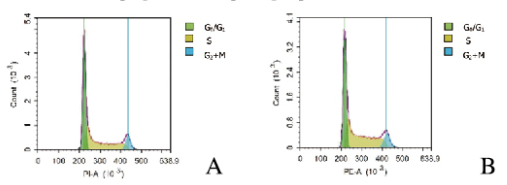
|
| A:Control group; B:100 μg·L-1 EG-VEGF group. 图 2 2组结肠癌LoVo细胞周期 Figure 2 Cell cycles of colon cancer LoVo cells in two groups(seen on page 519in paragraph) |
|
|
| (x±s, η/%) | |||
| Group | Percentage of LoVo cells | ||
| G0/G1 | S | G2+M | |
| Control | 44.28±0.28 | 41.68±0.37 | 14.04±0.25 |
| 100μg·L-1 EG-VEGF |
38.85±0.17* | 51.05±0.57* | 10.10±0.14 |
| * P < 0.05 vs control group. | |||
24 h时与对照组细胞迁移率(37.71%±0.63%)比较,100μg·L-1 EG-VEGF组LoVo细胞迁移率(18.97%±0.23%)明显升高(P < 0.05)。见图 3(插页三)。

|
| A, B:0h; C, D:24h;A, C:Control group; B, D: 100 μg·L-1 EG-VEGF group. 图 3 细胞划痕实验检测2组结肠癌LoVo细胞迁移率(×40) Figure 3 Migration rate of colon cancer LoVo cells in two groups detected by wound scratch assay(×40)(seen on page 519in paragraph) |
|
|
结肠癌LoVo细胞处理24 h后,与对照组(232.00±3.51)比较,50、100和200μg·L-1 EG-VEGF组迁移细胞数(282.00±4.00、376.00±6.08、426.00±6.55)明显增多,差异有统计学意义(P<0.05或P<0.01)。见图 4(插页三)。
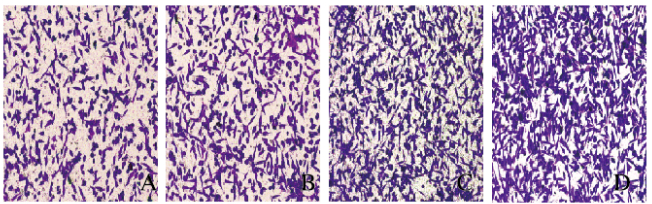
|
| A:Control group; B:50 μg·L-1 EG-VEGF group; C:100 μg·L-1 EG-VEGF group; D:200 μg·L-1 EG-VEGF group. 图 4 Transwell细胞迁移实验检测各组结肠癌LoVo细胞迁移数(×100) Figure 4 Migration number of colon cancer LoVo cells in various groups detected by Transwell cell migration assay(×100)(seen on page 519in paragraph) |
|
|
结肠癌的恶性结果通常是由多种基因和蛋白质调控其恶性行为导致的,如VEGF和EZH2增殖基因[9-10]等。EG-VEGF作为与VEGF有相似作用效果但作用方式不同的细胞因子,在结肠癌、绒毛膜癌、浸润性小管癌及胰腺癌等肿瘤组织中均有表达[11-13]。研究者[14-15]将EG-VEGF抗体处理的高表达EG-VEGF的结肠癌(HCT116、LoVo和DLD-1)细胞注射到小鼠皮下后发现:与对照组比较,其肿瘤的大小及血管形成明显被抑制。
本研究结果显示:EG-VEGF可明显增强结肠癌细胞的增殖和迁移能力,改变结肠癌的细胞周期,说明EG-VEGF的表达加剧了结肠癌的恶性结果。为了验证EG-VEGF与结肠癌恶性行为的关系,本实验室已成功沉默HT29细胞的EG-VEGF基因,验证其在沉默的条件下增殖能力及迁移能力减弱[16]。本研究利用克隆的小分子蛋白质体外模拟体内EG-VEGF对结肠癌细胞的影响,选取结肠癌LoVo细胞作为研究对象,与对照组比较,EG-VEGF组细胞增殖活性明显升高并随浓度的升高其增殖效果越明显,且G0/G1期细胞百分率明显降低,S期细胞明显增多,细胞迁移能力增强。针对EG-VEGF对结肠癌恶性行为的具体影响机制及通路的研究仍较少,研究[17-18]表明:EG-VEGF通过EG-VEGF受体2、基质金属蛋白酶2和基层金属蛋白酶9增加细胞的迁移能力,提出EG-VEGF受体2可作为结肠癌预后的诊断因子,其恶性行为的具体机制及通路在胰腺癌中也有相似的研究[13]结果。有研究者[19]建议将EG-VEGF作为生物治疗方法应用于肿瘤的的治疗中,本文作者认为EG-VEGF对肿瘤恶性行为影响的通路需要更深入的研究。
EG-VEGF影响结肠癌细胞增殖和迁移,其机制很可能通过是促进其细胞增殖和迁移等恶性行为影响结肠癌的转移及预后[20-21]。本研究的不足之处是对结肠癌其他恶性行为如凋亡等的研究尚未涉及。EG-VEGF对结肠癌细胞增殖能力的促进作用随浓度增加而增加,提示结肠癌中EG-VEGF表达水平与不良预后呈正相关关系,EG-VEGF促进结肠癌细胞增殖及迁移是结肠癌远处转移的基础,这可为结肠癌预后评估及晚期治疗提供新的思路和视角。
| [1] | Chen W, Zheng R, Zhang S, et al. Annual report on status of cancer in China, 2010[J]. Chin J Cancer Res, 2014, 26(1): 48–58. |
| [2] | 孙朝文, 周崇民, 张皓, 等. 晚期结肠癌患者生物治疗临床应用的研究进展[J]. 重庆医学, 2017, 46(8): 1123–1125. |
| [3] | LeCouter J, Kowalski J, Foster J, et al. Identification of an angiogenic mitogen selective for endocrine gland endothelium[J]. Nature, 2001, 412(6850): 877–884. DOI:10.1038/35091000 |
| [4] | Goi T, Nakazawa T, Hirono Y, et al. Prokineticin 1 expression in gastrointestinal tumors[J]. Anticancer Res, 2013, 33(12): 5311–5315. |
| [5] | Corlan AS, Cȋmpean AM, Jitariu AA, et al. Endocrine gland-derived vascular endothelial growth factor/prokineticin-1 in cancer development and tumor angiogenesis[J]. Internat J Endocrinol, 2017, 2017(4): 3232905. |
| [6] | Ngan ES, Tam PK. Prokineticin-signaling pathway[J]. Int J Biochem Cell Biol, 2008, 40(9): 1679–1684. DOI:10.1016/j.biocel.2008.03.010 |
| [7] | 董延琥, 栾文强, 李兴坤, 等. PROK1在结肠癌组织中的表达及其与转移的相关性[J]. 中国实用医药, 2016, 11(22): 16–18. |
| [8] | Goi T, Nakazawa T, Hirono Y, et al. The prognosis was poorer in colorectal cancers that expressed both VEGF and PROK1(No correlation coefficient between VEGF and PROK1)[J]. Oncotarget, 2015, 6(30): 28790–28799. |
| [9] | Bai LM, Huang XF, Xu HM. Investigation of microvessel density and related factors expression for xenografts tumor of HT-29 cells in nude mice at different growth stages[J]. Chin Pharmacol Bull, 2014, 30(6): 796–800. |
| [10] | 李西霞, 王晓春. EZH2通过抑制miR-608基因表达促进结肠癌细胞增殖[J]. 基因组学与应用生物学, 2016, 35(4): 745–751. |
| [11] | Nakazawa T, Goi T, Hirono Y, et al. Prokineticin 1 protein expression is a useful new prognostic factor for human sporadic colorectal cancer[J]. Ann Surg Oncol, 2015, 22(5): 1496–1503. DOI:10.1245/s10434-014-4150-3 |
| [12] | Traboulsi W, Bouffetal H, Aboussaouira T, et al. EG-VEGF and its receptors are deregulated in complete hydatiform moles:Potential role in placental tumor development[J]. Placenta, 2014, 35(9): A50. |
| [13] | Morales A, Morimoto S, Vilchis F, et al. Molecular expression of vascular endothelial growth factor, prokineticin receptor-1 and other biomarkers in infiltrating canalicular carcinoma of the breast[J]. Oncol Lett, 2016, 12(4): 2720. DOI:10.3892/ol.2016.4961 |
| [14] | Ren L, Guo X, Shao X, et al. Endocrine gland-derived vascular endothelial growth factor modulates proliferation, apoptosis and migration in pancreatic cancer cells[J]. Mol Med Rep, 2015, 11(6): 4279–4284. DOI:10.3892/mmr.2015.3340 |
| [15] | Goi T, Nakazawa T, Hirono Y, et al. The anti-tumor effect is enhanced by simultaneously targeting VEGF and PROK1 in colorectal cancer[J]. Oncotarget, 2015, 6(8): 6053–6061. |
| [16] | Goi T, Nakazawa T, Hirono Y, et al. Anti-prokineticin1 (PROK1) monoclonal antibody suppresses angiogenesis and tumor growth in colorectal cancer[J]. Ann Surg Oncol, 2014, 21(Suppl 4): S665. |
| [17] | 史剑飞, 邓红玉, 冯赫宇, 等. 靶向干扰PROK1基因对结直肠癌细胞HT29增殖和迁移的影响[J]. 基因组学与应用生物学, 2017, 36(4): 1294–1300. |
| [18] | Su MT, Tsai PY, Tsai HL, et al. miR-346 and miR-582-3p-regulated EG-VEGF expression and trophoblast invasion via matrix metalloproteinases 2 and 9[J]. Biofactors, 2017, 43(2): 210–219. DOI:10.1002/biof.v43.2 |
| [19] | Akanori G, Hidetaka K, Yuki U, et al. Expression of prokineticin-receptor2(PK-R2) is a new prognostic factor in human colorectal cancer:[J]. Oncotarget, 2015, 6(31): 31758–31766. |
| [20] | 闻崇炜, 周夕莲, 刘瑞江. EG-VEGF在肿瘤治疗中的应用前景[J]. 中国医药导报, 2010, 7(1): 173. |
| [21] | 张玲, 屈亚威, 谈涛, 等. 高分辨率显微内镜对结肠癌诊断价值的初步研究[J]. 解放军医学杂志, 2016, 41(9): 746–748. |
 2018, Vol. 44
2018, Vol. 44


