扩展功能
文章信息
- 陈彪, 张睿, 张文娟, 岳磊, 范戌辉, 刘吉伦, 刘耀强, 崔怡, 屈鹏飞, 杨威
- CHEN Biao, ZHANG Rui, ZHANG Wenjuan, YUE Lei, FAN Xuhui, LIU Jilun, LIU Yaoqiang, CUI Yi, QU Pengfei, YANG Wei
- 牙髓干细胞对兔面神经损伤的修复作用及其机制
- Repair effect of dental pulp stem cells on facial nerve injury in rabbits and its mechanism
- 吉林大学学报(医学版), 2018, 44(03): 504-509
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 504-509
- 10.13481/j.1671-587x.20180309
-
文章历史
- 收稿日期: 2017-06-22
干细胞是一类具有高度自我更新能力和多向分化潜能的细胞,可分化成多种功能细胞,在疾病治疗和组织工程化方面应用的潜力巨大[1]。干细胞治疗是具有临床应用前景的重要治疗手段之一。牙髓干细胞是一种成纤维细胞,研究[2]显示:牙髓干细胞可为神经元提供营养支持,在体外可分化为神经元,在治疗时能保护并促进中枢神经系统脑细胞的生存。面神经损伤是一种临床上较难治疗的疾病,常引发部分或完全性面瘫。面神经损伤的致病因素较多,目前尚未明确。临床治疗包括内科治疗和外科手术,内科治疗主要采用抗炎、脱水;外科手术包括面神经吻合、面神经减压及自体神经移植等。由于其周围神经受到局部和整体的影响,面神经损伤后再生困难[3]。近年来,随着显微外科技术的不断完善,手术修复取得进步,但由于神经再生速度极缓慢,往往发生不可逆的肌萎缩,给恢复带来负面影响[4]。因此如何改善神经再生微环境、去除阻碍神经再生的因素等成为研究者关注的方向。牙髓干细胞是存在于牙髓中具有多向分化潜能的成体干细胞,已成为全球基础医学界研究的热点。牙髓干细胞具有来源广泛、取材容易、分化能力强和免疫原性较低等特点,在临床治疗和伦理学方面均具有明显的优越性,作为种子细胞日益受到研究者的关注。2008年日本学者Sasaki等[5]证实了转化生长因子可以诱导牙髓干细胞向神经组织转化。本研究通过切断兔面神经上颊支引起周围神经缺损建立模型,模拟人面神经损伤,并分离牙髓干细胞对模型兔进行治疗,通过检测兔的运动功能和面神经组织切片指标来探讨牙髓干细胞移植对面神经损伤模型的修复作用。
1 材料与方法 1.1 实验动物、主要试剂和仪器普通级雄性新西兰幼兔1只,1周龄,体质量(1.0±0.1)kg,用于提取牙髓干细胞;普通级雄性健康新西兰兔45只,7~8月龄,体质量(3.0±0.5)kg;所有动物均由新疆医科大学实验动物中心提供,动物许可证号:SCXK(新)2014-0003。饲养环境:(25±2)℃、湿度(50±5)%。所有实验动物均符合卫计委一级动物标准。适应性喂养1周后进行实验。DMEM细胞培养基(美国Hyclone公司),免疫组织化学DAB显色试剂盒(北京中山生物技术有限公司),3%戊巴比妥钠(武汉金诺化工有限公司),脑源性神经营养因子(BDNF)和睫状神经生长因子(CNTF)单克隆抗体(武汉博士德生物工程公司),CNTF抗体(北京中山生物技术有限公司)。病理组织切片机(德国Sartorius公司),Leica DMI4000B倒置荧光显微镜(日本Olympus公司),Jouan BR4I高速离心机(德国Hereaus公司),微量加样器(美国Hyclone公司)。
1.2 牙髓干细胞的分离培养、纯化和诱导分化参照文献[6]方法,将幼兔消毒后置于超净工作台上,局麻下拔除兔前牙及磨牙,采用0.1 mol·L-1PBS冲洗,无菌条件下打开牙冠,取出兔牙髓组织,反复冲洗后置于离心管中,依次加入3 g·L-1Ⅰ型胶原酶和4 g·L-1 dispase酶溶液各1 mL,37℃水浴中消化1 h,过细胞筛网(70 μm孔径),加入PBS溶液制成悬液,低温条件下以1500r·min-1离心5 min,弃上清液,加10%血清培养液,调制成2×105 mL-1细胞悬液,接种于培养皿中,恒温培养箱中培养。24 h后首次换液,之后每3 d换液1次,待原代细胞长至底部90%时,胰酶溶液消化5 min,按1:3比例进行传代培养。取第3代细胞,接种于含碱性成纤维细胞生长因子(bFGF)和CNTF的培养液中诱导培养分化,每日观察细胞生长情况。
1.3 动物分组和兔面神经损伤模型制备将45只兔随机分为正常对照组、模型组和实验组,每组15只。除正常对照组外均建模,建模前兔禁食12 h,麻醉后,无菌条件下,采用兔架将兔仰卧固定于操作台上,沿嘴角至耳前处做长约3 cm的切口,显现上下颊支,显微镜下暴露出上颊支,离断上颊支,建立面神经上颊支损伤的动物模型[19-22],然后用自制的神经导管套接吻合缺损,两断端嵌入无菌神经导管1.5 mm形成神经再生室, 用10-0丝线缝合固定, 形成神经导管再生室。操作完成后,逐层缝合,再次消毒,按50 000 U·kg-1注射青霉素预防性抗感染。放入兔饲养房内正常饲养,自由活动和进食。建模1周后,采用微量加样器向实验组兔神经导管再生室管腔内注射0.1 mL牙髓干细胞悬液(5×106个),模型组兔的神经导管再生室管腔中注射等量0.1 mL PBS液。术后分笼饲养,给予基础饲料、自由饮水,置于温暖、干燥、通风的环境中。正常对照组兔不作任何处理。
1.4 各组兔行为表现观察和面部胡须运动功能评分参考文献[7]方法,于术前、术后2周观察兔行为表现,观察兔面部两侧胡须及肌肉运动情况,检测胡须运动功能评分,评分标准:①完全瘫痪,胡须垂向后下方(0分);②轻微胡须抖动(1分);③轻度面部运动(2分);④胡须及上唇中度运动(3分);⑤上唇及胡须正常运动(4分)。
1.5 HE染色观察兔面神经组织病理形态表现经心脏灌注处死实验兔,经心脏灌注4%多聚甲醛进行预固定,在实验兔左右两侧颊部至耳后1.5 cm处进行消毒,切开显露手术部位,取面神经,迅速放入4%多聚甲醛和2.5%戊二醛溶液中,行常规HE染色,于光学显微镜下观察兔面神经组织病理形态表现。
1.6 免疫组织化学染色观察兔面神经组织中BDNF和CNTF阳性细胞数染色前将切片60℃、1 h二甲苯脱蜡,酒精脱水,蒸馏水水化,滴加3%双氧水,37℃下孵育10 min,冲洗,滴加正常山羊血清工作液进行封闭,37℃下孵育10 min,除去血清,滴加一抗BDNF和CNTF抗体,4℃孵育12 h,PBS冲洗,滴加二抗工作液,37℃下孵育10 min,滴加链霉素卵白素工作液(辣根过氧化物酶标记后),37℃下孵育30 min,PBS冲洗,滴加DAB显色液,显色10 min,PBS冲洗,苏木素复染,脱水,封片,光镜下观察免疫组织化学标本。镜下呈棕黄色的神经元则判定为阳性细胞。
1.7 透射电镜下观察兔面神经组织横切片中再生神经纤维数、纤维直径和髓鞘厚度取一片干净牙科蜡,置于润湿平皿底内,滴加染液于蜡块上,盖上盖玻片。取组织横切片,采用铀-铅双染法:将载网用1%~3%醋酸双氧铀水染20~30 min,反复清洗。将柠檬酸铅溶于氢氧化钠,得强碱溶液(pH12),按照上述染、洗方法进行染色。染色完成后,采用0.02%氢氧化钠和蒸馏水连续冲洗载网,之后置于培养皿的滤纸上干燥。透射电镜下观察计算移植后单位面积内再生神经纤维数、纤维直径和髓鞘厚度,取平均值。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组兔面神经组织中BDNF和CNTF阳性细胞数及单位面积内再生神经纤维数、纤维直径以及髓鞘厚度以x±s表示,组间比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 牙髓干细胞形态表现原代幼兔牙髓细胞大多数呈成纤维状、长梭形,少数细胞呈椭圆形,部分呈多角形,增殖后可见大量的成纤维样细胞,细胞体积较小,细胞达到90%融合时,可见到大量的细胞分裂相。见图 1。HE染色后,第3代干细胞的细胞核呈深蓝色,卵圆形;呈梭形、着色深细胞为成纤维细胞样细胞,胞浆粉红,着色较浅。分离纯化的牙髓干细胞经免疫组织化学染色鉴定的结果显示:抗波形丝蛋白、牙本质涎蛋白和CD44染色呈阳性反应。见图 2(插页三)。
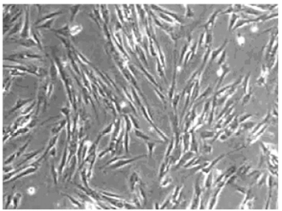
|
| 图 1 牙髓干细胞形态表现(×40) Figure 1 Morphology of dental pulp stem cells(×40) |
|
|
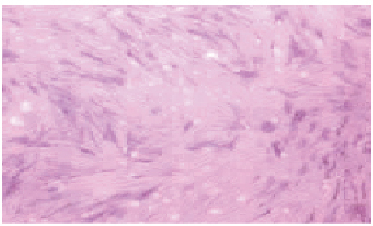
|
| A:Normal control group; B:Model group; C:Experiment group. 图 2 牙髓干细胞形态表现(HE,×100) Figure 2 Morphology of dental pulp stem cells(HE, ×100)(seen on page 507in paragraph) |
|
|
正常对照组所有兔行为表现均正常;与正常对照组比较,术后模型组兔面部胡须运动功能评分降低(P<0.01),表现为胡须垂向后下方,耳下垂,眼睛对光反射减弱,受到刺激后不能完全闭合,出现面神经麻痹症状;与模型组比较,从第8周开始,实验组兔面部胡须运动功能改善较快,胡须运动功能评分升高(P<0.05)。见表 1。
| (n=15, x±s) | |||||
| Group | Movement function score | ||||
| (week) 2 | 4 | 6 | 8 | 10 | |
| Normal control | 4.01±0.22 | 4.03±0.37 | 4.02±0.28 | 4.05±0.31 | 4.03±0.40 |
| Model | 0.11±0.02* | 0.98±0.05* | 1.21±0.07* | 1.48±0.10** | 2.01±0.12* |
| Experiment | 0.23±0.02 | 1.15±0.04 | 1.60±0.06 | 1.97±0.08△ | 3.48±0.14△ |
| * P < 0.01 vs normal control group; △ P < 0.05 vs model group. | |||||
正常对照组兔面神经上颊支的纵切面见神经纤维排列整齐,呈长条状平行排列,其外包绕髓鞘,结构致密无明显变化,神经纤维束被神经束膜包裹,呈连续性。模型组兔新生神经纤维呈现不规则松散状且数量较少。移植术后10周,实验组兔面神经组织切片显微镜下可见新生神经纤维较多,呈束状且紧密。见图 3(插页三)。
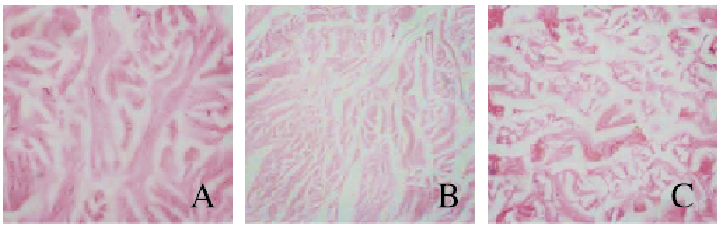
|
| A:Normal control group; B:Model group; C:Experiment group. 图 3 各组兔神经组织形态表现(HE,×10) Figure 3 Morphology of nerve tissue of rabbits in various groups(HE, ×10)(seen on page 507in paragraph) |
|
|
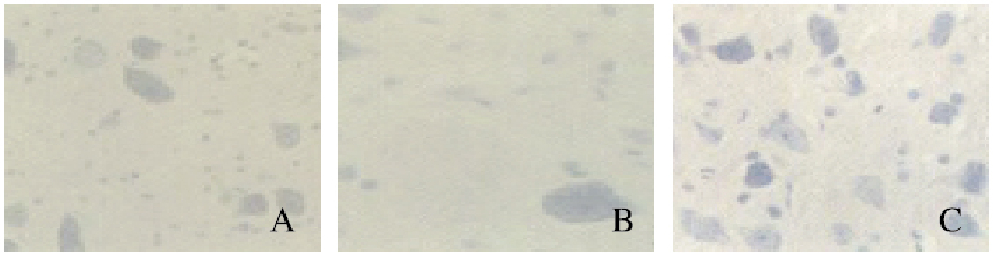
与正常对照组比较,模型组兔面神经组织中BDNF和CNTF阳性细胞数明显减少(P<0.05);与模型组比较,实验组兔面神经组织中BDNF和CNTF阳性细胞数明显增多(P<0.05)。见表 2和图 4、5(插页三)。
| (n=15, x±s) | ||
| Group | Number of positive cells | |
| BDNF | CNTF | |
| Normal control | 16.63±2.50 | 40.71±5.92 |
| Model | 6.78±0.97* | 14.95±1.74* |
| Experiment | 13.01±1.78△ | 36.62±5.86△ |
| * P < 0.05 vs normal control group; △ P < 0.01 vs model group. | ||
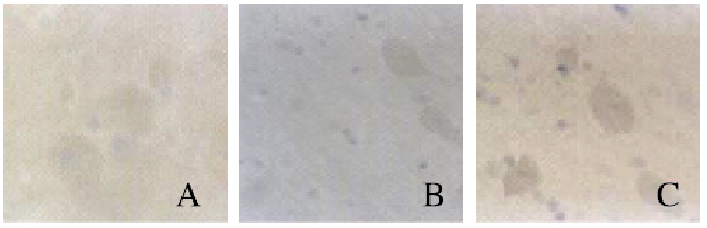
|
| 图 4 各组兔面神经组织中BDNF表达(免疫组织化学,×400) Figure 4 Expressions of BDNF in facial nerve tissue of rabbits in various groups(Immunohistochemistry, ×400)(seen on page 507in paragraph) |
|
|
|
| A:Normal control group; B:Model group; C:Experiment group. 图 5 各组兔面神经组织中CNTF表达(免疫组织化学,×400) Figure 5 Expressions of CNTF in facial nerve tissue of rabbits in various groups(Immunohistochemistry, ×400)(seen on page 507in paragraph) |
|
|
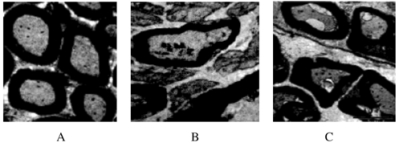
移植术后10周,与正常对照组比较,模型组兔再生神经纤维数、纤维直径和髓鞘厚度明显降低(P<0.05);与模型组比较,实验组兔面神经组织横切片中再生神经纤维数目、纤维直径和髓鞘厚度数均明显升高(P<0.05)。见表 3和图 6。
| (n=15, x±s) | |||
| Group | Number of myelinated nerve fibers | Diameter of fiber(l/μm) | Thickness of myelin sheath(l/μm) |
| Normal control | 1 044.36±91.61 | 6.09±0.52 | 0.51±0.02 |
| Model | 847.41±68.33* | 3.14±0.25* | 0.37±0.04* |
| Experiment | 1 356.50±90.12△ | 7.12±0.48△ | 0.71±0.04△ |
| * P < 0.05 vs normal control group; △ P < 0.05 vs model group. | |||
|
| A:Normal control group; B:Model group; C:Experiment group. 图 6 透射电镜下各组兔面神经组织切片中再生神经纤维形态表现(×8 000) Figure 6 Morphology of regenerated nerve fibers in facial nerve tissue section of rabbits in various groups under transmission electron microscope(×8 000) |
|
|
临床上外伤、肿瘤和手术损伤等常导致面神经损伤,引起面瘫和味觉的部分损失等[8]。临床上面神经损伤治疗以药物保守为主,或结合显微缝合神经断端,但治疗效果常常不佳[9]。研究[10]显示:面神经损伤属于细胞损伤的范畴,但由于神经元不能分裂再生长,损伤后只能依靠轴突的生长延伸,生长速度较慢,再加上神经受损后易发生萎缩、变性和纤维化,导致神经功能恢复困难。随着医学科研技术的深入发展,神经再生研究已进入细胞和分子水平。组织工程学技术对神经生物学的研究为面神经损伤的修复提供了新的研究方向。
组织工程学技术主要方法是模仿神经组织的构造进行局部移植干细胞,促进神经修复的细胞,诱导或促进损伤神经的再生与连接,从而改善或修复受损的神经功能。
在实验动物的选择方面,家兔易于获得,饲养方便,抗病能力强,且家兔的体形较大、面神经直径较粗,在结构上与人面神经相似,具备制作面神经缺损模型的优点,便于面部表情肌功能恢复的观察和测试,近年研究[11]多以家兔作为实验动物制作神经缺损模型。本实验采用目前公认的建模方法,即通过切断动物面神经上颊支引起周围神经缺损,结果显示:与正常对照组比较,模型组兔术后面部胡须活动均明显减弱,表现为胡须垂向后下方,耳下垂,眼睛对光反射减弱,受到刺激后不能完全闭合,出现面神经麻痹症状,说明兔面神经损伤模型建模成功。
神经损伤后神经代谢的恢复和受损神经功能的修复是神经再生的综合体现,自体神经或异体神经等干细胞移植是常用的神经再生方法[12-13]。实验[14]证明:牙髓干细胞在一定诱导条件下,可定向分化为神经元,可作为种子细胞构建组织工程的人工神经,其是治疗神经系统疾病的重要细胞,牙髓干细胞移植可产生一些细胞因子,对神经功能的恢复具有促进作用。本研究结果显示:转化生长因子β3(TGF-β3)联合牙髓干细胞可促进面神经再生[15-16]。Huojia等[17]对新西兰大白兔面神经颊支人为制造约7mm的神经断端,采用硅胶导管制作再生室,尝试采用牙髓干细胞联合TGF-β3修复面神经损伤发现:此法修复面神经损伤组兔的S100蛋白与巢蛋白Nestin高表达,进一步证实牙髓干细胞可定向分化为神经细胞,有效修复神经。本研究体外培养的原代幼兔牙髓细胞增殖能力强,增殖后可见大量的成纤维样细胞,细胞体积较小,细胞达到90%融合时,可见到大量的细胞分裂相,原代和传代培养的干细胞鉴定结果均为染色阳性。表明牙髓干细胞可作为种子细胞。本研究结果显示:在第3代干细胞中抗波形丝蛋白、牙本质涎蛋白和CD44染色均呈阳性反应,证实其来源为间充质干细胞。所以本实验选择第3代形成的牙髓干细胞进行干细胞移植治疗。
研究[18-19]证明:神经干细胞在增殖分化产生神经细胞的过程与所处的微环境信号有紧密联系,BDNF和CNTF就是其中之一。BDNF为损伤神经元提供营养,具有抗神经损伤作用,而CNTF可促进神经细胞生长,减少瘢痕生成,改善内环境,促进神经功能的恢复[20-21]。本研究结果显示:实验组兔神经组织中BDNF和CNTF阳性细胞数量较多,面神经组织横切片中再生神经纤维较多,呈束状且紧密;模型组兔面神经组织横切片显微镜下再生神经纤维呈现不规则松散状且数量较少,再生神经纤维数目较多,纤维较粗,髓鞘增厚,轴浆内细胞器完整,只有少数脱髓鞘神经纤维,神经纤维间结缔组织较少。本研究结果表明:牙髓干细胞可促进兔面神经损伤后神经功能恢复,可能因为干细胞促进BDNF和CNTF的分泌及表达,改善了神经系统细胞再生的微环境,同时减少了瘢痕组织生成,发挥神经营养作用,进而促进受损神经功能的修复,其修复机制可能与上调BDNF及CNTF表达有关。
| [1] | Strojny C, Boyle M, Bartholomew A, et al. Interferon gamma-treated dental pulp stem cells promote human mesenchymal stem cell migration in vitro[J]. J Endod, 2015, 41(8): 1259–1264. DOI:10.1016/j.joen.2015.02.018 |
| [2] | Kanafi M, Majumdar D, Bhonde R, et al. Midbrain cues dictate differentiation of human dental pulp stem cells towards functional dopaminergic neurons[J]. J Cell Physiol, 2014, 229(10): 1369–1377. DOI:10.1002/jcp.v229.10 |
| [3] | Ronis MJ, Gomez-Acevedo H, Blackburn ML, et al. Uterine responses to feeding soy protein isolate and treatment with 17β-estradiol differ in ovariectomized female rats[J]. Toxicol Appl Pharmacol, 2016, 297: 68–80. DOI:10.1016/j.taap.2016.02.019 |
| [4] | Rataj F, Möller FJ, Jähne M, et al. Progesterone, as well as 17β-estradiol, is important for regulating AHR battery homoeostasis in the rat uterus[J]. Arch Toxicol, 2015, 89(3): 393–404. DOI:10.1007/s00204-014-1261-3 |
| [5] | Sasaki R, Aoki S, Yamato M, et al. Neurosphere generation from dental pulp of adult rat incisor[J]. Eur J Neurosci, 2008, 27(3): 538–548. DOI:10.1111/ejn.2008.27.issue-3 |
| [6] | Gronthos S, Arthur A, Bartold PM, et al. A method to isolate and culture expand human dental pulp stem cells[J]. Methods Mol Biol, 2011, 698: 107–121. DOI:10.1007/978-1-60761-999-4 |
| [7] | Lieberman DM, Jan TA, Ahmad SO, et al. Effects of corticosteroids on functional recovery and neuron survival after facial nerve injury in mice[J]. Arch Facial Plast Surg, 2011, 13(2): 117–124. |
| [8] | Barbour JR, Yee A, Moore AM, et al. Cadaveric nerve allotransplantation in the treatment of persistent thoracic neuralgia[J]. Ann Thorac Surg, 2015, 99(4): 1414–1417. DOI:10.1016/j.athoracsur.2014.06.092 |
| [9] | 刘浏. 犬下牙槽神经切断对牙种植体周围成骨结构影响的影像学分析[D]. 大连: 大连医科大学, 2015. |
| [10] | Goodus MT, Guzman AM, Calderon F, et al. Neural stem cells in the immature, but not the mature, subventricular zone respond robustly to traumatic brain injury[J]. Dev Neurosci, 2015, 37(1): 29–42. |
| [11] | Shah SR, Young S, Goldman JL, et al. A composite critical-size rabbit mandibular defect for evaluation of craniofacial tissue regeneration[J]. Nat Protoc, 2016, 11(10): 1989–2009. DOI:10.1038/nprot.2016.122 |
| [12] | McGregor C, Sau A, Ruddy SC, et al. Novel ligands balance estrogen receptor β and α agonism for safe and effective suppression of the vasomotor response in the ovariectomized female rat model of menopause[J]. Endocrinology, 2014, 155(7): 2480–2491. DOI:10.1210/en.2013-1976 |
| [13] | Zhu Y, Liu S, Zhou S, et al. Vascularized versus nonvascularized facial nerve grafts using a new rabbit model[J]. Plast Reconstr Surg, 2015, 135(2): 331–339. DOI:10.1097/PRS.0000000000000992 |
| [14] | Hook V, Brennand KJ, Kim Y, et al. Human iPSC neurons display activity-dependent neurotransmitter secretion:aberrant catecholamine levels in schizophrenia neurons[J]. Stem Cell Reports, 2014, 3(4): 531–538. DOI:10.1016/j.stemcr.2014.08.001 |
| [15] | 庄友梅, 木合塔尔·霍加, 许辉, 等. 转化生长因子-β3和牙髓干细胞在兔面神经损伤修复中作用[J]. 中华实用诊断与治疗杂志, 2015, 29(7): 637–639. |
| [16] | 王腾, 木合塔尔·霍加, 白惠子. 外源性转化生长因子-β_3联合兔牙髓干细胞对兔骨缺损处成骨细胞转化生长因子-β_3表达的影响[J]. 中华实用诊断与治疗杂志, 2017, 31(6): 525–529. |
| [17] | Huojia M, Wu Z, Zhang X, et al. Effect of dental pulp stem cells (DPSCs) in repairing rabbit alveolar bone defect[J]. Clin Lab, 2015, 61(11): 1703–1708. |
| [18] | Takasugi T, Minegishi S, Asada A, et al. Two degradation pathways of the p35 Cdk5 (cyclin-dependent kinase)activation subunit, dependent and independent of ubiquitination[J]. J Biol Chem, 2016, 291(9): 4649–4657. DOI:10.1074/jbc.M115.692871 |
| [19] | Fu S, Shi ZY, Fan WJ, et al. Microenvironments induce iPSCs and BMSCs into neuron-like cells-Reelin's regulative role in cell differentiation and polarization[J]. Sheng Li Xue Bao, 2015, 67(4): 357–369. |
| [20] | Barbon S, Stocco E, Negro A, et al. In vitro assessment of TAT-ciliary neurotrophic factor therapeutic potential for peripheral nerve regeneration[J]. Toxicol Appl Pharmacol, 2016, 309: 121–128. DOI:10.1016/j.taap.2016.09.001 |
| [21] | Lee N, Serbinski CR, Braunlin MR, et al. Muscle and motor neuron ciliary neurotrophic factor receptor α together maintain adult motor neuron axons in vivo[J]. Eur J Neurosci, 2016, 44(12): 3023–3034. DOI:10.1111/ejn.2016.44.issue-12 |
 2018, Vol. 44
2018, Vol. 44


