扩展功能
文章信息
- 孙竹梅, 梁伟时, 康佳丽, 孟徐兵, 王建行, 韩淑英
- SUN Zhumei, LIANG Weishi, KANG Jiali, MENG Xubing, WANG Jianxing, HAN Shuying
- 2型糖尿病db/db小鼠肾脏动态病理特点
- Dynamic pathological characteristics of kidney in db/db mice with type 2 diabetes mellitus
- 吉林大学学报(医学版), 2018, 44(03): 499-503
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 499-503
- 10.13481/j.1671-587x.20180308
-
文章历史
- 收稿日期: 2017-04-30
2. 华北理工大学冀唐学院, 河北唐山 063000;
3. 华北理工大学基础医学院, 河北 唐山 063000
2. Jitang College, North China University of Science and Technology, Tangshan 063000, China;
3. College of Basic Medical Sciences, North China University of Science and Technology, Tangshan 063000, China
db/db小鼠是瘦素受体基因缺陷导致的先天性肥胖型2型糖尿病小鼠,主要表现为高血糖、高胰岛素血症、糖和脂代谢异常等特征,并伴有典型的糖尿病肾脏病变[1]。合适的糖尿病动物模型在糖尿病发病机制研究、并发症治疗、药物开发过程中均发挥极其重要的作用[2]。有关db/db小鼠生理学特点的报道多集中于研究其生化指标和形态学表现[3],而少有关于db/db小鼠病程中肾脏纤维化程度及超微结构改变的研究[4],因此本实验检测db/db小鼠体质量、血糖和肾脏指数,动态观察小鼠肾脏病理改变特点,为糖尿病肾病的研究提供实验依据。
1 材料与方法 1.1 实验动物SPF级7~8周龄雄性、体型肥胖、空腹血糖(fasting blood glucose, FBG)水平高于11.1 mol·L-1的db/db小鼠(模型组)购于常州卡文斯实验动物有限公司,动物许可证号:SCXK(苏)2001-0003;同龄雄性、体型正常、FBG低于6.6 mol·L-1小鼠(正常组)购于常州卡文斯实验动物有限公司,动物许可证号:SCXK(苏)2001-0003。SPF级实验动物饲料即60Co辐射实验动物颗粒饲料,购于南京贝斯弗饲料有限公司,生产批号:20151030001MF01。每组16只,每笼4只,饲养于华北理工大学实验动物中心屏蔽实验室。
1.2 主要试剂和仪器多聚甲醛(北京Solarbio公司),无水酒精(富凯化工公司),二甲苯(济宁宏明公司),苏木精染色剂(南京Oddfoni公司),伊红生物染色剂(展云化工公司),石蜡(恒勘化工公司),PBS粉末(北京雅安达公司),Masson染色试剂盒(北京Solarbio公司)。罗氏血糖仪及试纸(德国Roche公司),电子天平(上海菁海公司),恒温烤片机(上海徕卡公司),生物组织自动石蜡包埋机(湖北泰维公司),轮转式切片机(德国Leica公司),高倍显微镜(日本Olympus公司),真彩病理图像分析系统(南昌高腾公司),H-7650型透视电镜(日本日历公司)和莱卡uc6超薄切片机(德国Leica公司)。
1.3 各组大鼠体质量、FBG和双肾指数测定分别在鼠龄为8、16和32周时测定其体质量,采用血糖仪测尾静脉血FBG水平。小鼠处死时用电子天平称体质量,取双肾用电子天平称双肾质量,计算双肾指数。双肾指数=双肾质量/体质量。
1.4 HE染色和Masson染色观察各组小鼠肾组织形态表现于鼠龄为16和32周时每组各处死8只小鼠,左肾固定于4%多聚甲醛24 h,常规石蜡包埋、切片、烤片,HE染色,光镜下观察。另取石蜡切片行Masson染色,其步骤为:常规脱蜡至水,Weigetr染液染色25 min后酸性乙醇分化水洗,Masson蓝化液反蓝5 min,丽春红品红染色3 min,弱酸工作液洗涤后,磷钼酸溶液洗涤2 min,苯胺蓝染色10 min,弱酸工作液水洗,梯度脱水,中性树胶封片。所有染片光镜下观察并照相。
1.5 电镜下观察各组小鼠肾组织超微结构取小鼠右肾组织切成约1 mm×1 mm×1 mm的小块,浸入2.5%戊二醛液中固定,经0.1 mol·L-1PB充分冲洗,1%四氧化锇固定,梯度酒精脱水,100%酒精:丙酮(1:1)脱水,丙酮:树脂(1:1)浸透1 h,纯树脂(815/812混合液)浸透,Epon812包埋,半薄切片用甲苯胺蓝染色,修切组织块大小适用于超薄切片,超薄切片厚度为70 nm,捞于200目铜网上,经醋酸铀和柠檬酸铅电子染色后,电镜下观察并摄片。
1.6 统计学分析采用SPSS17.0统计软件进行统计学分析。各组小鼠体质量、FBG水平和双肾指数以x±s表示,组间样本均数比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组小鼠体质量和FBG水平观察期内不同时间点模型组小鼠体质量均高于正常组(P < 0.01);32周龄时,模型组小鼠平均体质量达到70.51g,而正常组小鼠平均体质量只有28.22 g,模型组小鼠32周体质量是正常组小鼠体质量的2倍多。所有模型组小鼠FBG水平均明显高于正常组(P < 0.05),观察期间内随着时间延长,正常组小鼠FBG水平有一定程度升高,但各时间点比较差异无统计学意义(P>0.05);模型组小鼠各时间点FBG水平比较差异无统计学意义(P>0.05)。见表 1。
| (n=8, x±s) | |||||||
| Group | Body weight(m/g) | FBG [cB/(mmol·L-1)] | |||||
| (week) 8 | 16 | 32 | 8 | 16 | 32 | ||
| Normal | 18.81±0.84 | 24.34±1.43△ | 28.22±1.74△△# | 5.16±0.51 | 5.58±0.66 | 6.07±0.71 | |
| Model | 41.26±1.37* | 59.37±2.28*△ | 70.51±5.16*△△# | 20.54±2.17* | 21.08±2.38* | 20.16±2.26* | |
| * P < 0.01 vs nomal group; △ P < 0.05, △△ P < 0.01 vs 8 weeks; # P < 0.05 vs 16 weeks. | |||||||
16和32周龄时正常组小鼠双肾指数变化不大,而模型组小鼠双肾指数均低于正常组(P < 0.01),且32周龄时模型组小鼠双肾指数明显低于16周龄时(P < 0.05)。见表 2。
| (n=8, x±s) | ||
| Group | Double kidney index | |
| (week) 16 | 32 | |
| Normal | 1.27±0.06 | 1.25±0.08 |
| Model | 0.71±0.11* | 0.58±0.10*△ |
| * P < 0.01 vs normal group;△ P < 0.05 vs 16 weeks. | ||
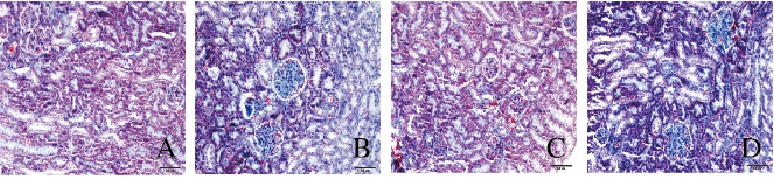
HE染色光镜下观察:正常组小鼠肾组织形态和结构未见异常改变,无炎细胞浸润。Masson染色很少见蓝染的胶原纤维组织,正常组小鼠32周龄时肾蓝染组织较16周时略有增多;模型组小鼠肾小球体积增大,肾小囊变窄,系膜增生、基底膜增厚;肾小管上皮细胞水肿明显,空泡变性,管腔变窄;肾小管间质炎细胞浸润明显,肾小球囊内和肾小管见大量蓝染物质沉积,蓝色的系膜基质明显增加。模型组小鼠32周龄时肾组织病理改变明显重于16周龄,蓝染物质明显增多。见图 1和2(插页三)。

|
| A, B:16weeks; C, D:32 weeks; A, C:Normal group; B, D:Model group. 图 1 16和32周龄时2组小鼠肾组织形态表现(HE, ×400) Figure 1 Morphology of kidney tissue of mice in two groups at 16 and 32 weeks(HE, ×400)(seen on page 501in paragraph) |
|
|
|
| A, B:16 weeks; C, D:32 weeks; A, C:Normal group; B, D:Model group. 图 2 16和32周龄时2组小鼠肾组织形态表现(Masson染色,×200) Figure 2 Morphology of kidney tissue of mice in two groups at 16 and 32 weeks (Masson, ×200)(seen on page 501in paragraph) |
|
|
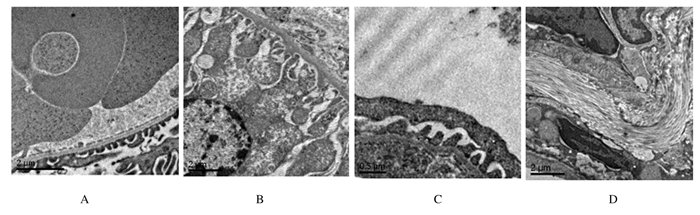
电镜下可见:16和32周龄正常组小鼠肾组织足细胞胞体分出大的初级突起和指状的次级突起形成足突,紧贴于毛细血管基膜外, 突起之间可见裂孔, 足细胞排列整齐,肾小球基底膜未见增厚。16周龄时模型组小鼠肾组织可见小球毛细血管基底膜弥漫性增厚,足细胞数目减少,足突广泛融合,足突裂孔减少;32周龄时肾组织病变明显加重,肾小球毛细血管基底膜正常屏障结构丧失,系膜外基质(ECM)增多,可见大量胶原纤维,显示肾脏病理超微结构明显改变。见图 3。
|
| A, B:16weeks; C, D:32 weeks; A, C:Normal group; B, D:Model group. 图 3 正常组和模型组小鼠肾组织超微结构(×700) Figure 3 Ultrastructures of kidney tissue of mice in normal group and model group(×700) |
|
|
db/db小鼠是Bar harbor于1966年在C57BLKS/J(BKS)近交系中发现的由于瘦素受体基因缺陷导致的先天肥胖性2型糖尿病小鼠。db/db小鼠在1~2周龄时出现高胰岛素血症,3~4周龄时明显肥胖,4~8周龄时出现高血糖、胰岛素抵抗和β细胞功能衰竭[5]。除此之外,db/db小鼠还伴有严重的糖尿病肾病、心肌病和糖尿病肝病等糖尿病并发症,一般在32~40周龄时死亡[6-7]。db/db小鼠是目前广泛被认可的研究人类2型糖尿病的较好的动物模型[8]。
糖尿病肾病的主要病理改变是以肾小球系膜区为主的ECM和肾小球基底膜积累,致使弥漫性或结节性肾小球硬化[9-10]。本研究结果显示:模型组小鼠体质量明显高于正常组,生长速度明显快于正常组;模型组小鼠FBG水平均明显高于正常组,但模型组小鼠8周龄时FBG水平较高,之后不再继续升高。刘静等[4]研究db/db小鼠的早期生物学特性时发现:模型组小鼠早期脂质代谢紊乱,血糖、血脂水平明显升高,糖耐量及胰岛素耐量异常,血糖水平稳定。李娟娥等[11]在自发性2型糖尿病动物模型研究中指出:与ob/ob小鼠不同之处是模型组小鼠可发生明显的肾病(ob/ob小鼠模型也是FDA推荐的动物模型,与瘦素缺乏有关,而db/db小鼠模型与瘦素受体缺乏有关,且可发生明显的肾损伤)。本研究结果显示:正常组小鼠双肾指数在16和32周龄时变化不大,而模型组小鼠双肾指数均明显低于正常组,并且32周龄时明显低于16周龄时,可能是由于模型组小鼠体质量不断增加、而肾脏质量不随之增加或可能随着时间延长肾损伤明显、出现肾萎缩现象。郑丽阳等[12]在研究三七皂苷对db/db小鼠肾脏保护作用时发现:db/db小鼠的肾脏病变表现为系膜细胞增生、基质增加和基底膜增厚等肾脏结构破坏,与邢玮等[13]研究结果一致。金智生等[14]在观察红芪多糖对早期糖尿病肾病db/db小鼠的保护性研究中发现:与正常组比较,模型组小鼠血糖水平明显升高,肾小球肥大,系膜区明显增宽,毛细血管基底膜增厚。本研究结果表明:正常组小鼠肾组织形态和结构无异常改变,Masson染色很少见蓝染胶原组织;而模型组小鼠肾组织16周龄时即出现明显病理改变,主要表现为肾小球体积增大,肾小管上皮细胞明显水肿,管腔变窄,32周龄时肾组织病理改变明显重于16周龄,Masson染色见大量蓝染胶原组织。电镜观察显示16和32周龄时正常组小鼠肾组织超微结构无明显改变。而16周龄模型组小鼠肾组织可见肾小球毛细血管基底膜弥漫性增厚,足突广泛融合;32周龄时病变明显加重,可见大量胶原纤维,说明随着时间延长糖尿病肾脏损伤明显加重,肾小球产生严重硬化和纤维化现象。
糖尿病肾病的发病机制比较复杂,研究认为有多方面因素参与,如高血糖状态、脂代谢紊乱导致脂毒性、氧化应激、晚期糖基化终末产物积累和肾脏血流动力学的改变等[15]。糖尿病肾脏病变随着病情进展有不同的病理改变,早期有肾脏体积增大、肾小球基底膜增厚和系膜增生、肾小管细胞肿胀和肾小管上皮细胞空泡样改变,晚期可发生弥漫性肾小球硬化、肾小管萎缩、基膜增厚和肾间质纤维化等。本研究结果与文献[16-18]报道一致,肾脏早期病变主要是肾小球基底膜增厚、足突融合,晚期时肾组织中有大量纤维增生,说明已有肾硬化发生,已向终末期糖尿病肾病进展。
综上所述,db/db小鼠具有早期脂质代谢紊乱、持续高血糖水平等特点,不仅符合典型糖尿病临床症状,也表现出糖尿病各种并发症[19],如肾小球系膜基质增加、肾小球基底膜增厚和小管扩张等。因此,在糖尿病肾脏损伤发病机制及药物防治糖尿病肾病的研究方面,db/db小鼠可作为较好的糖尿病动物模型。
| [1] | 刘芳, 杨华, 周文江, 等. 诱发性2型糖尿病小鼠模型与自发性db/db小鼠特性的比较[J]. 中国实验动物学报, 2014, 22(6): 54–59. |
| [2] | 黄海燕, 王利则, 于燕, 等. 丹参联合罗格列酮对db/db糖尿病小鼠肝纤维化的干预作用[J]. 中国老年学杂志, 2012, 32(10): 2082–2084. DOI:10.3969/j.issn.1005-9202.2012.10.040 |
| [3] | 陆洁, 刘静, 裴天仙, 等. 自发性2型糖尿病模型db/db小鼠生物学特性研究[J]. 药物评价研究, 2013, 36(5): 341–345. |
| [4] | 刘静, 陆洁, 裴天仙, 等. 基因缺陷型2型糖尿病模型动物db/db小鼠早期生物学特性研究[J]. 药物评价研究, 2013, 36(8): 8–12. |
| [5] | 邢玮, 王政霖, 吕甜甜, 等. 2型糖尿病db/db小鼠的生物学特性[J]. 中国比较医学杂志, 2017, 27(8): 12–15. |
| [6] | 郑丽阳, 薛瑞, 吕婷婷, 等. 三七皂苷Fc对2型糖尿病db/db小鼠肾脏保护作用研究[J]. 中华中医药学刊, 2017, 35(3): 609–611. |
| [7] | 金智生, 王东旭, 张花治, 等. 红芪多糖对db/db小鼠糖尿病心肌病TGF-B/Smads信号通路影响的实验研究[J]. 北京中医药大学学报, 2017, 40(1): 20–26. |
| [8] | Piccoli GB, Grassi G, Cabiddu G, et al. Diabetic kidney disease:a syndrome rather than a single disease[J]. Rev Diabet Stud, 2015, 12(1/2): 87–109. |
| [9] | Zhang L, Liu J, Zhou F, et al. PGC-1α ameliorates kidney fibrosis in mice with diabetic kidney disease through an antioxidative mechanism[J]. Mol Med Rep, 2018, 17(3): 4490–4498. |
| [10] | Lindblom R, Higgins G, Coughlan M, et al. Targeting mitochondria and reactive oxygen species-driven pathogenesis in diabetic nephropathy[J]. Rev Diabet Stud, 2015, 12(1/2): 134–156. |
| [11] | 李娟娥, 王磊, 秦灵灵, 等. 自发性2型糖尿病啮齿类动物模型研究概况[J]. 中国实验方剂学杂志, 2010, 16(6): 267–271. |
| [12] | 郑丽阳, 薛瑞, 吕亭亭, 等. 三七皂苷Fc对2型糖尿病db/db小鼠的肾脏保护作用研究[J]. 中华中医药学刊, 2017, 35(3): 609–611. |
| [13] | 邢玮, 王政霖, 吕甜甜, 等. 2型糖尿病db/db小鼠的生物学特性[J]. 中国比较医学杂志, 2017, 27(8): 12–15. |
| [14] | 金智生, 魏玉娇, 林海龙, 等. 红芪多糖对早期糖尿病肾病db/db小鼠肾间质纤维化的影响[J]. 北京中医药大学学报, 2017, 40(8): 677–683. |
| [15] | Shaw JE, Sicree RA, Zimmet PZ. Global estimates of the prevalence of diabetes for 2010 and 2030[J]. Diabetes Res Clin Pract, 2010, 87(1): 4–14. DOI:10.1016/j.diabres.2009.10.007 |
| [16] | Aggarwal PK, Veron D, Thomas DB, et al. Semaphorin3a promotes advanced diabetic nephropathy[J]. Diabetes, 2015, 64(5): 1743–1759. DOI:10.2337/db14-0719 |
| [17] | 童国玉, 朱大龙. 糖尿病肾病国内外临床指南和专家共识解读[J]. 中国实用内科杂志, 2017, 37(3): 211–216. |
| [18] | 胡承. 糖尿病肾病遗传机制研究现状与研究策略[J]. 中国实用内科杂志, 2017, 37(3): 207–210. |
| [19] | Jia ZH, Liu ZH, Zheng JM, et al. Combined therapy of rhein and benazepril on the treatment of diabetic nephropathy in db/db mice[J]. Exp Clin Endocrinol Diabetes, 2007, 115(9): 571–576. DOI:10.1055/s-2007-981469 |
 2018, Vol. 44
2018, Vol. 44


