扩展功能
文章信息
- 孙成博, 孙波, 刘春禹, 李星儒, 王志琴, 张璟祎, 张雪绵, 王泽红, 于晓艳
- SUN Chengbo, SUN Bo, LIU Chunyu, LI Xingru, WANG Zhiqin, ZHANG Jingyi, ZHANG Xuemian, WANG Zehong, YU Xiaoyan
- 茵陈提取物对糖尿病大鼠肾组织中miRNAs表达谱的影响及其肾脏保护作用
- Effect of herba artemisiae capillaris extracts on expression profile of miRNAs in kidney tissue of diabetic rats and its protective effect on kidney
- 吉林大学学报(医学版), 2018, 44(03): 493-498
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 493-498
- 10.13481/j.1671-587x.20180307
-
文章历史
- 收稿日期: 2017-08-13
2. 吉林省中医院针灸科, 吉林 长春 130021
2. Department of Acupunture, Jilin Provincial Traditional Chinese Medicine Hospital, Changchun 130021, China
糖尿病肾病(diabetic nephropathy,DN)是由糖尿病引起的一种常见的慢性并发症,中医药防治糖尿病有上千年的历史,中西医结合防治DN在我国已成为趋势。微小核糖核酸(miRNAs)是一类含有20~25个核苷酸、具有调控功能的内源性非编码RNAs,约占总基因的4%[1]。近年来,基因芯片和测序等技术的快速发展极大地加速了miRNAs的研究进程,其在DN发病机制中作用的研究也逐步深入,研究[2-13]显示:多种miRNA参与DN的发病过程,由于DN发病机制极其复杂,miRNA参与调控的机制更为复杂,miRNA在DN中的具体表达水平、参与DN发展进程的机制以及参与调控的miRNA的种类和数量仍需更多的科学研究来验证。茵陈为菊科植物茵陈蒿或滨蒿的地上干燥部分,我国大多地区皆有分布,在山西和安徽等地最为常见。潘竞锵等[14-15]研究发现:茵陈蒿可降低糖尿病动物空腹血糖水平,改善糖耐量减退。栾智杰[16]研究发现:茵陈蒿汤可在一定程度上改善肾衰大鼠肾功能,延缓肾脏衰竭。目前关于茵陈与DN的研究较少,且多见于复方,迄今为止尚未检索到基于miRNA水平探讨茵陈对于DN防治作用的研究报道。本课题组前期实验[17]已证实:茵陈提取物(herba artemisiae capillaris extracts,HACE)对DN大鼠肾脏有保护作用。本研究将在前期实验基础上进行深层次的研究,从miRNAs角度探讨HACE干预DN的相关机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器60只雄性Wistar大鼠,体质量190~220 g,购于吉林大学实验动物中心,动物合格证号:SCXK(辽)2015-0006。HACE购自湖南诺泽生物科技有限公司(批号131122,经高效液相色谱检测绿原酸百分率为1.32%, 对羟基苯乙酮百分率为0.18%),链脲佐菌素(STZ,美国Sigma公司,批号15215),All-in-OneTM miRNA qRT-PCR Detection Kit和大鼠miRNAs(广州复能基因有限公司),其他试剂均为国产分析纯。ABI实时PCR仪(美国应用生物系统公司),台式高速离心机(中国湖南湘仪实验室仪器开发有限公司),日立7150全自动生化分析仪(日本日立公司)。
1.2 DN模型的制备和分组大鼠适应性饲养1周,禁食12 h后,腹腔注射2%STZ(55 mg·kg-1)复制DN模型;将注射等量0.1 mmol·L-1枸橼酸盐缓冲液的大鼠作为对照组(n=12)。1周后选择血糖水平≥16.67 mmol·L-1、尿糖≥
大鼠处死前代谢笼收集24 h尿量,采用日立7150全自动生化分析仪检测大鼠尿白蛋白和尿总蛋白浓度。尿白蛋白排泄率(mg·24 h-1)=尿白蛋白浓度(g·L-1)×24h尿量(mL);尿总蛋白排泄率(mg·24 h-1)=尿总蛋白浓度(g·L-1)×24h尿量(mL)。
1.4 HE染色观察大鼠肾组织形态表现石蜡标本切片后进行常规HE染色,观察大鼠肾组织结构。
1.5 miRNAs基因芯片初筛miRNAs差异表达谱根据大鼠尿蛋白排泄率结果,在给药8周后各组大鼠中随机挑选2个肾脏,由华联生物科技采用MRmiOA5.0版本芯片测定肾组织中miRNAs表达谱的变化(服务号2r614052802)。miRNAs表达量采用荧光强度表示。
1.6 RT-qPCR法验证大鼠肾组织中miRNAs的相对表达量分析miRNAs芯片初筛结果,对于差异表达在1.74倍(log2 |Fold change|>0.8)以上、高丰度(信号>800)的miRNAs结合miRNA相关生物信息数据库筛选高表达阳性miRNAs。采用RT-qPCR法分别针对8和16周大鼠肾脏验证筛选的miRNAs的相对表达量。采用△Ct值表示各个miRNAs的相对表达量(△Ct值=目的基因的Ct值-内参U6的Ct值)。
1.7 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组大鼠尿白蛋白和尿总蛋白排泄率及各组大鼠肾组织中miRNAs的相对表达量以x±s表示,组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠一般状态、尿白蛋白和尿总蛋白排泄率一般状态:与对照组比较,模型组大鼠体质量明显减轻,并出现明显的“三多一少”症状,即多饮、多尿、多食及消瘦;HACE组大鼠的状态明显改善。实验过程中大鼠有死亡情况,其中对照组无死亡,模型组死亡2只,HACE组死亡1只。给药8周后,与对照组(0.23 mg±0.05 mg)比较,模型组大鼠尿白蛋白排泄率(0.47 mg±0.11 mg)明显升高(P < 0.05);与模型组比较,HACE组大鼠尿白蛋白排泄率(0.32 mg±0.13 mg)明显降低(P < 0.05);尿总蛋白排泄率组间比较差异无统计学意义(P>0.05)。给药16周后,与对照组(0.36 mg±0.22 mg)比较,模型组大鼠尿白蛋白排泄率(0.79 mg±0.45 mg)明显升高(P < 0.05);与模型组比较,HACE组大鼠尿白蛋白排泄率(0.46mg±0.22 mg)明显降低(P < 0.05);尿总蛋白排泄率组间比较差异无统计学意义,但与对照组(16.14 mg±4.75 mg)和HACE组(16.55 mg±13.07 mg)比较,模型组大鼠尿白蛋白排泄率(30.63 mg±29.72 mg)有升高趋势。
2.2 各组大鼠肾组织形态表现对照组大鼠肾小球大小均匀。8周时模型组大鼠部分肾小球出现轻重程度不同的病变,表现为肾小球体积肿大、系膜区扩大、细胞数目增加;16周时大鼠病变肾小球数目明显增多,病变程度明显加重。8和16周时HACE组大鼠病变肾小球数目均少于模型组,且肾小球体积肿大和系膜区扩大等病变程度也有所减轻。见图 1(插页三)。
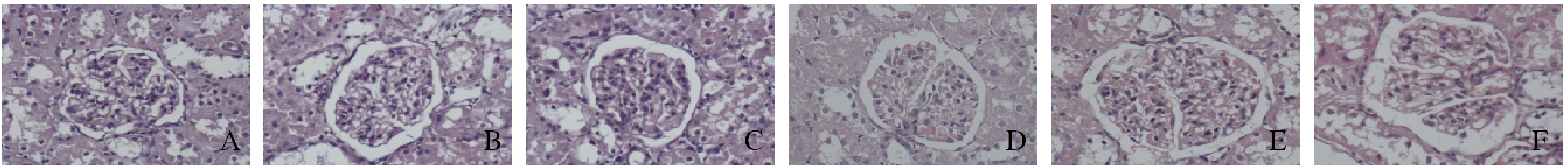
|
| A-C:8 weeks; D-F:16 weeks; A, D:Control group; B, E:Model group; C, F:HACE group. 图 1 各组大鼠肾组织形态表现(HE, ×400) Figure 1 Morphology of kidney tissue of rats in various groups(HE, ×400)(seen on page 495in paragraph) |
|
|
对照组和模型组大鼠肾组织中miRNAs的表达谱中共筛选出35个差异表达的miRNAs,筛选标准为差异表达在1.74倍(log2 |Fold change|>0.8)以上且表达信号>800,其中模型组miRNAs上调的基因23个,miRNAs下调的基因12个。HACE组和模型组大鼠肾组织中miRNAs表达谱中共筛选出差异表达的miRNA17个,其中HACE组miRNAs上调的基因1个,下调的基因16个。见图 2。
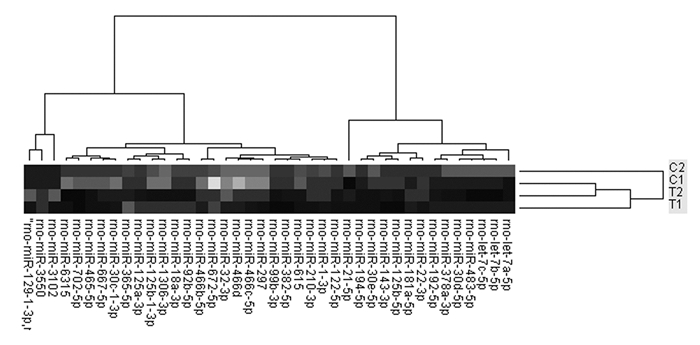
|
| 图 2 miRNAs芯片差异表达谱 Figure 2 Differential expression profiles of miRNAs chips |
|
|
对于差异表达的miRNAs结合miRNA相关生物信息数据库筛选出7个与DN密切相关且变化较为明显的阳性miRNAs,即miR-21-5p、miR-1306-3p、miR-92b-5p、miR-672-5p、miR-466d、let-7b和miR-3550。采用RT-qPCR法对这7个miRNAs验证的结果显示:给药8周后,与对照组比较,模型组大鼠肾组织中miRNAs相对表达量明显降低的有miR-1306-3p(P < 0.05)、miR-672-5p(P < 0.05)和miR-3550(P < 0.01);miR-21-5p和miR-92b-5p表达量虽有降低的趋势,但组间比较差异无统计学意义(P>0.05)。与模型组比较,HACE组大鼠肾组织中miRNAs相对表达量明显升高的仅有miR-672-5p(P < 0.05);miR-21-5p、miR-92b-5p和miR-3550相对表达量虽有升高的趋势,但组间比较差异无统计学意义(P>0.05)。给药8周后表达量发生变化且给予HACE后趋于正常的miRNAs仅有miR-672-5p。见表 1。
| (x±s) | ||||||||
| Group | n | miR-21-5p | miR-1306-3p | miR-92b-5p | miR-672-5p | miR-466d | let-7b | miR-3550 |
| Control | 12 | -1.50±0.23 | 1.53±0.21 | -9.37±1.97 | 0.51±0.07 | 2.75±0.13 | -1.84±0.29 | 6.44±0.19 |
| Model | 24 | -1.26±0.22 | 3.70±0.43* | -8.08±1.52 | 1.54±0.26* | 2.96±0.29 | -1.86±0.41 | 7.68±0.38** |
| HACE | 24 | -1.68±0.28 | 3.83±1.03* | -9.26±1.01 | 0.77±0.11△ | 3.56±0.52 | -1.73±0.34 | 7.24±0.55* |
| * P < 0.05,** P < 0.01 compared with control group;△ P < 0.05 compared with model group. | ||||||||
给药16周后,与对照组比较,模型组大鼠肾组织中miRNAs相对表达量升高的为miR-21-5p(P < 0.01),相对表达量降低的为miR-1306-3p(P < 0.05)、miR-672-5p(P < 0.01)和miR-466d(P < 0.05);与模型组比较,HACE组大鼠肾组织中miRNAs相对表达量降低的有miR-21-5p(P < 0.05)和miR-1306-3p(P < 0.05),相对表达量升高的有miR-672-5p(P < 0.05)。给药16周后相对表达量变化且给予HACE后趋于正常的miRNAs有miR-21-5p和miR-672-5p。见表 2。
| (x±s) | ||||||||
| Group | n | miR-21-5p | miR-1306-3p | miR-92b-5p | miR-672-5p | miR-466d | let-7b | miR-3550 |
| Control | 12 | -1.40±0.37 | 2.26±0.52 | -6.80±1.66 | 1.14±0.26 | 2.58±0.35 | -1.27±0.25 | 6.04±1.28 |
| Model | 24 | -3.64±0.38** | 3.31±0.94* | -6.85±1.44 | 3.28±0.34** | 4.20±0.58* | -0.88±0.28 | 7.60±0.66 |
| HACE | 24 | -1.79±0.37△ | 5.09±0.26△ | -7.85±1.76 | 1.98±0.36△ | 5.10±1.00** | -0.90±0.21 | 6.74±0.98 |
| * P < 0.05,** P < 0.01 compared with control group;△ P < 0.05 compared with model group. | ||||||||
本课题组在前期研究[1]的基础上,应用单次腹腔注射STZ复制DN大鼠模型,从肾功能和肾脏病理学改变等方面观察HACE对DN大鼠不同时期的保护作用,并采用miRNA芯片技术筛选DN大鼠差异表达的阳性miRNAs,对部分阳性miRNAs进行相关的验证。
模型组大鼠尿白蛋白排泄率明显升高,肾组织中肾小球出现不同程度的病理变化,给予HACE治疗后,这二方面均有不同程度的改善,且随着给药时间的延长,其改善作用也随之增强,说明HACE可以缓解DN大鼠肾脏功能和组织形态改变,且不论在DN大鼠的任何阶段,HACH均可在一定程度上保护肾脏,抑制肾脏病变的进展。
miRNA芯片筛查与RT-qPCR验证已成为近年来研究miRNAs差异表达的最常用技术手段。多项研究表明:DN状态下miRNAs表达谱出现变化。彭睿等[18]通过芯片筛查检测早期DN患者中miRNAs差异表达谱发现:有明显差异表达的miRNAs共有49个,其中35个表达量升高,14个表达量降低,RT-qPCR验证结果与芯片一致。张政等[19]通过芯片筛查检测早期DN小鼠肾组织中miRNAs差异表达谱结果显示:有66个miRNAs有明显差异表达,其中35个表达量升高,31个表达量降低,差异倍数为1.08~10.20;RT-qPCR进一步验证其中一部分miRNAs表达结果显示:有3个miRNAs呈高表达,4个miRNAs呈低表达。杨雪唯等[20]研究发现:与正常小鼠比较,DN小鼠肾组织中miR-196a、miR-21、miR-200b表达量明显升高,且与血糖、甘油三酯、总胆固醇、24 h尿蛋白排泄率呈正相关关系。Campion等[21]还提出将miRNAs作为DN诊断与预后的重要生物标记物。本研究结果显示:组间多个miRNAs出现差异表达。结合相关研究[22-23]和生物信息学数据库,本课题组选择了7个与DN密切相关且差异表达在1.74倍(log2|Fold change|>0.8)以上、高丰度(信号>800)miRNAs进行RT-qPCR验证显示:本实验中DN miRNAs表达谱存在一定的差异表达,且在疾病的不同时期miRNAs的表达谱也不同,在DN早期(给药8周)时,miR-21-5p相对表达量变化不明显;DN中期(给药16周)时miR-21-5p相对表达量明显升高。在给药8周时miR-466d相对表达量无明显变化,给药16周时其相对表达量明显降低。而给药8和16周时miR-1306-3p和miR-672-5p相对表达量的变化趋势一致。还有一些miRNAs相对表达量在给药8周时有所变化,给药16周时无变化,如miR-3550。上述结果提示DN时miRNAs的变化较为复杂。给予HACE治疗后,部分miRNAs表达发生了变化,本研究分析2个时间点的RT-qPCR结果显示:造模后出现差异变化且给予HACE后表达量趋于正常的miRNAs有miR-21-5p和miR-672-5p,提示HACE可能通过影响这2个miRNAs表达从而延缓DN的发生发展。
综上所述,本研究在证实了HACE的肾脏保护作用基础上,筛查了大鼠DN不同时期miRNAs表达谱的变化,提示多个miRNAs参与DN的发生发展,且部分miRNAs的变化在给予HACE治疗后可趋向于正常,提示部分miRNAs参与了HACE对DN的干预作用。本文作者下一步计划以miR-21-5p或miR-672-5p作为研究目标,深入探讨其在HACE延缓DN发生发展中的具体机制。
| [1] | Vaca L. Point-of-care diagnostic tools to detect circulating microRNAS as biomarkers of disease[J]. Sensors(Basel), 2014, 14(5): 9117–9131. |
| [2] | Wu H, Kong L, Zhou S, et al. The role of microRNAs in diabetic nephropathy[J]. J Diabetes Res, 2014, 2014: 920134. |
| [3] | Castro NE, Kato M, Park JT, et al. Transforming growth factor β1 (TGF-β1) enhances expression of profibrotic genes through a novel signaling cascade and microRNAs in renal mesangial cells[J]. J Biol Chem, 2014, 289(42): 29001–29013. DOI:10.1074/jbc.M114.600783 |
| [4] | Long J, Wang Y, Wang W, et al. MicroRNA-29c is a signature microRNA under high glucose conditions that targets Sprouty homolog 1, and its in vivo knockdown prevents progression of diabetic nephropathy[J]. J Biol Chem, 2011, 286(13): 11837–11848. DOI:10.1074/jbc.M110.194969 |
| [5] | Kato M, Zhang J, Wang M, et al. MicroRNA-192 in diabetic kidney glomeruli and its function in TGF-beta-induced collagen expression via inhibition of E-box repressors[J]. Proc Natl Acad Sci U S A, 2007, 104(9): 3432–3437. DOI:10.1073/pnas.0611192104 |
| [6] | Wang Q, Wang Y, Minto AW, et al. MicroRNA-377 is up-regulated and can lead to increased fibronectin production in diabetic nephropathy[J]. FASEB J, 2008, 22(12): 4126–4135. DOI:10.1096/fj.08-112326 |
| [7] | Zhao B, Li H, Liu J, et al. MicroRNA-23b targets ras GTPase-activating protein SH3 domain-binding protein 2 to alleviate fibrosis and albuminuria in diabetic nephropathy[J]. J Am Chem Soc, 2016, 27(9): 2597–2608. |
| [8] | Koga K, Yokoi H, Mori K, et al. MicroRNA-26a inhibits TGF-β-induced extracellular matrix protein expression in podocytes by targeting CTGF and is downregulated in diabetic nephropathy[J]. Diabetologia, 2015, 58(9): 2169–2180. DOI:10.1007/s00125-015-3642-4 |
| [9] | Wang J, Duan L, Guo T, et al. Downregulation of miRNA-30c promotes renal fibrosis by target CTGF in diabetic nephropathy[J]. J Diabetes Complicat, 2016, 30(3): 406–414. DOI:10.1016/j.jdiacomp.2015.12.011 |
| [10] | Etikala DM, Liu R, Wang L. FOXP3-micro RNA-146-NF-kappa B as oncotarget[J]. Oncoscience, 2015, 2(10): 839–840. |
| [11] | Wang X, Shen E, Wang Y, et al. MiR-196a regulates high glucose-induced mesangial cell hypertrophy by targeting p27kip1[J]. J Lab Autom, 2015, 20(4): 491–499. DOI:10.1177/2211068215569055 |
| [12] | Zhang Z, Luo X, Ding S, et al. MicroRNA-451 regulates p38 MAPK signaling by targeting of Ywhaz and suppresses the mesangial hypertrophy in early diabetic nephropathy[J]. FEBS Lett, 2012, 586(1): 20–26. DOI:10.1016/j.febslet.2011.07.042 |
| [13] | Baker MA, Davis SJ, Liu P, et al. Tissue-specific microRNA expression patterns in four types of kidney disease[J]. J Am Soc Nephrol, 2017, 28(10): 2985–2992. DOI:10.1681/ASN.2016121280 |
| [14] | 潘竞锵, 刘广南. 茵陈蒿对小鼠血糖、血脂的影响[J]. 中药材, 1998, 21(8): 408–411. |
| [15] | 潘竞锵, 韩超, 刘惠纯, 等. 茵陈蒿汤对正常和多种糖尿病模型动物血糖的影响[J]. 中药材, 2001, 24(2): 128–131. |
| [16] | 栾智杰. 茵陈蒿汤对腺嘌呤肾衰大鼠CTGF和TGF-β1表达的影响[D]. 哈尔滨: 黑龙江省中医研究院, 2011. |
| [17] | 耿嘉男. 茵陈提取物对糖尿病肾病防治作用的研究[D]. 长春: 吉林大学, 2015. |
| [18] | 彭睿, 查何, 周吉, 等. 糖尿病肾病循环microRNA差异表达谱的分析[J]. 西南大学学报:自然科学版, 2014, 36(11): 75–82. |
| [19] | 张政, 罗勇军, 彭惠民, 等. 早期糖尿病肾病相关微小RNA在小鼠肾脏的表达变化[J]. 第三军医大学学报, 2010, 32(13): 1383–1386. |
| [20] | 杨雪唯, 梁小弟, 努尔斯曼古丽·奥斯曼, 等. MicroRNA及其靶基因在糖尿病肾病小鼠肾脏的表达[J]. 科技导报, 2017, 35(4): 84–89. |
| [21] | Campion CG, Sanchez-Ferras O, Batchu SN. Potential role of serum and urinary biomarkers in diagnosis and prognosis of diabetic nephropathy[J]. Can J Kidney Health Dis, 2017, 22(4): 205435811770537. |
| [22] | 郝传明, 张敏. 糖尿病肾病的防治策略-三级预防一体化治疗[J]. 中国实用内科杂志, 2017, 37(3): 195–198. |
| [23] | 孙赟. 复方积雪草合剂治疗早期糖尿病肾病临床疗效观察[J]. 中国实用内科杂志, 2017, 37(5): 467–468. |
 2018, Vol. 44
2018, Vol. 44


