扩展功能
文章信息
- 张书剑, 张有辰, 李慧文, 金正勇
- ZHANG Shujian, ZHANG Youchen, LI Huiwen, JIN Zhengyong
- 高氧对新生大鼠脑组织中NRP-cGMP信号通路的影响
- Effect of hyperoxia on NRP-cGMP signaling pathway in brain tissue of newborn rats
- 吉林大学学报(医学版), 2018, 44(03): 477-482
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 477-482
- 10.13481/j.1671-587x.20180304
-
文章历史
- 收稿日期: 2018-01-18
随着我国儿科学的发展及各省市新生儿重症监护室的相继建立,早产儿的存活率有明显提高,但神经系统损伤的患儿比例却大大增加。在众多致病因素中,产后常压高浓度吸氧引起的脑损伤逐年增多,已成为近年来新生儿科医师亟待解决的问题[1]。研究[2-3]显示:新生儿期长时间吸入高浓度氧气可引发远期迟发性认知功能障碍及学习、记忆和运动功能损害等。新生儿高氧脑损伤的发生机制尚未明确,可能由炎性水肿、细胞凋亡、细胞外基质重建、新生血管重塑和组织细胞修复异常等多种因素共同作用引起。Brehmer等[4]研究表明:长时间高浓度氧(高氧)暴露将增加氧自由基产生,进而启动氧化应激途径致神经元受损,与此同时机体释放大量促炎症因子,进一步加重脑组织神经细胞损伤、凋亡和坏死。钠尿肽(natriuretic peptides,NPs)作为一组参与机体内环境稳态调节的多肽,与靶细胞膜上特异性钠尿肽受体(natriuretic peptide receptors,NPRs)结合,通过细胞内信号传导机制,参与组织中环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)的合成,调节机体一系列重要生理功能和反应[5]。近年来研究[6]证实:在脑组织神经细胞中能定位到NPRs的存在,但目前尚无足够的证据显示何种通路参与高氧脑损伤。本研究复制新生大鼠高氧诱导脑损伤模型,探讨NRP-cGMP信号通路是否参与高氧诱导脑损伤的发病过程,为临床诊治提供理论依据。
1 材料与方法 1.1 实验动物、主要试剂和仪器新生健康Wistar大鼠60只,大鼠出生体质量5~9 g,雌雄兼有,购自延边大学动物实验中心,动物许可证号码:SYXK(吉)(2007-0011),大鼠均在延边大学医学院形态学中心饲养。苏木素染液和伊红染液购自北京Solarbio科技公司,Reagent 1 and Reagent 2购自北京ZSGB-Bio公司,NPR-A(H-125)抗体和NPR-B(H-80)抗体购自美国Santa Cruz Biotechnology公司,cGMP ELISA试剂盒购自英国Abbexa公司。低速离心机(TGL-16)购自湘南湘仪实验室仪器开发有限公司,凝胶成像分析系统购自美国Bio-Ra公司。
1.2 新生大鼠高氧诱导脑损伤模型的制备参照文献[7]复制高氧诱导新生大鼠脑损伤模型。将60只新生Wistar大鼠于出生后12 h内编排序号,并随机分为对照组和高氧模型组,每组30只。高氧模型组:将新生大鼠置于自制高氧箱内,活动空间、鼠粮和水源充足,有机玻璃箱顶端接入氧气管,以2 L·min-1速度持续吸入医用氧气,每日用电子测氧仪检测箱内氧浓度,保持氧浓度>85%,箱底垫钠石灰吸收CO2。对照组:除吸入空气(氧气浓度为21%)外,其他条件与高氧模型组相同。2组大鼠均连续吸入7 d。2组大鼠置于同一室内,玻璃箱与室内温度均为23℃~26℃,室内湿度为60%~70%,每日开箱20 min,观察并记录大鼠的一般情况,称体质量,更换饲料和垫料。对照组和高氧模型组每日互换哺乳母鼠,避免高氧模型组中母鼠因氧气中毒,导致应激性反应,从而引起实验误差。
1.3 2组大鼠脑组织形态和超微结构观察于实验第1、3和7天时,每组各取10只新生大鼠以10%水合氯醛0.7 mL灌肠麻醉后,固定于解剖台上, 充分暴露心脏和肝脏,剪开左心室,于心尖部进针,快速将0.9%生理盐水滴注,将膨胀的右心耳剪开,改用4%多聚甲醛灌注,拨开头盖骨,取出脑组织,浸泡于4%多聚甲醛溶液中浸泡24 h,经流水清洗过后, 再次梯度酒精逐步脱水, 之后二甲苯透明2次, 制作石蜡包埋,沿脑组织矢状面切片,选取半月形白色区域,即脑组织的海马区。切片后行HE染色,光镜下观察2组大鼠脑组织形态表现。
大脑海马组织以2.5%戊二醛固定后,经1%饿酸后固定、丙酮脱水、浸透与树脂包埋等制样、进行电镜聚合块的半薄切片,定位超薄切片70 nm,经醋酸铀和枸橼酸铅双染色后于透射电子显微镜下观察并照相。
1.4 Western blotting法检测2组大鼠脑组织中钠尿肽受体A(NPR-A)和钠尿肽受体B(NPR-B)表达水平取大鼠脑组织放入离心管中匀浆、反复剪碎,提取相关组织蛋白,采用BCA法测定样品蛋白浓度。SDS-PAGE凝胶后上样、电泳,低温转膜300 mA,40 min后关闭,采用TBS-T震荡清洗封闭后的PVDP膜,分别滴加一抗、二抗(最终浓度稀释比例为1:2 000)后室温摇床孵育,暗室中显影。X线曝光后依次显影、摇洗、冲洗和晒干。采用Western blotting法测定其灰度值/并以β-actin条带作为参照物。NPR-A表达水平=NPR-A目标条带灰度值/β-actin条带灰度值,NRP-B表达水平=NPR-B目标条带灰度值/β-actin条带灰度值。
1.5 ELISA法检测大鼠脑组织中cGMP水平取适量大鼠脑组织制备匀浆液,Polytron-type试剂处理后离心,取上清液待测。将cGMP标准品加入HCl溶液中制备cGMP工作液。在0.6 mL离心管中加入cGMP工作液,其余离心管中加入HCl溶液后,连续稀释标准品,每孔依次加样、中和液、乙酰化试剂后温育10 min,加入乙酰化cGMP液、cGMP抗体和cGMP-HRP温育1 h后洗涤5次,均匀加入HRP developer,温育1 h,终止反应。测定450 nm处吸光度(A)值,以A值代表cGMP水平。
1.6 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组大鼠体质量,大鼠脑组织中NPR-A、NPR-B表达水平和cGMP水平均以x±s表示,组间比较采用t检验。以P<0.05表示差异有统计学意义。
2 结果 2.1 2组大鼠体质量对照组新生大鼠在实验过程中精神状态较好、好动、皮下脂肪丰富、呼吸均匀,生长发育良好;高氧模型组大鼠随着氧气暴露时间的延长,精神状态较差、不易动、皮肤干燥、体质量增长慢,甚至出现脑神经系统损害表现,如爬行姿势不稳、发育迟缓和惊厥等。对照组和高氧模型组新生大鼠体质量随着时间的延长而升高,与对照组比较,高氧暴露1、3和7d高氧模型组新生大鼠体质量明显降低(P<0.05)。见表 1。
| (n=10, x±s, m/g) | |||
| Group | Body weight | ||
| (t/d) 1 | 3 | 7 | |
| Control | 6.15±0.17 | 10.36±0.41 | 17.43±0.45 |
| Hyperoxia model | 5.07±0.21* | 8.32±0.31* | 13.10±0.29* |
| *P<0.05 compared with control group. | |||
对照组新生大鼠高氧暴露1、3和7 d时,脑组织海马锥体细胞排列整齐,层次紧密、丰富,形态正常,锥体细胞核圆而丰满,核仁清晰,神经纤维密集,胞质丰富,呈现均匀的蓝色。高氧暴露3d时,高氧模型组大鼠可见海马锥体细胞体积缩小,排列稀疏;高氧暴露7d时,高氧模型组大鼠海马细胞出现深染皱缩,细胞与周围分界不清,核固缩深染。见图 1(插页一)。
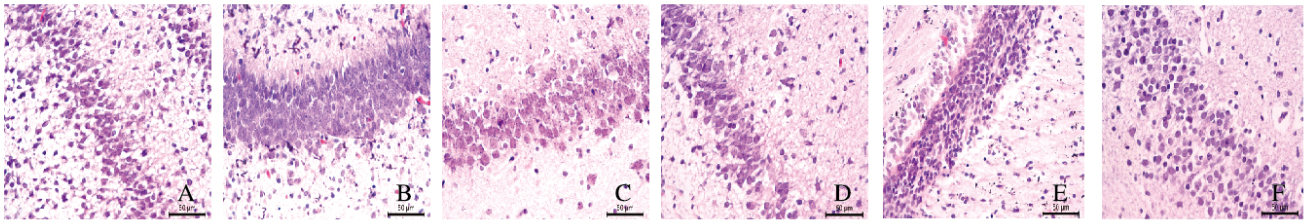
|
| A-C:Control group; D-E:Hyperoxia model group. A, D:1 d after birth; B, E:3 d after birth; C, F:7 d after birth. 图 1 2组大鼠脑组织中海马椎体细胞形态表现(HE,×100) Figure 1 Morphology of hippocampal pyramidal cells in brain tissue of rats in two groups (HE, ×100)(seen on page 479in paragraph) |
|
|
电镜下,高氧暴露1d时,对照组清晰可见线粒体双侧膜和粗面内质网等结构以及少许突触。随着时间的推移,可见高尔基复合体,突触的数量、结构(突触间隙、突触小泡、致密物质)增加,突触间隙无明显变化,可检测到少许致密物质。与对照组比较,高氧暴露1d时,高氧模型组无明显差异;高氧暴露3d时,线粒体双层膜结构破坏,少许嵴消失,线粒体和突触数量减少,随着氧气暴露时间的延长,突触和小囊泡数目进一步减少,突触致密物密度降低。见图 2。
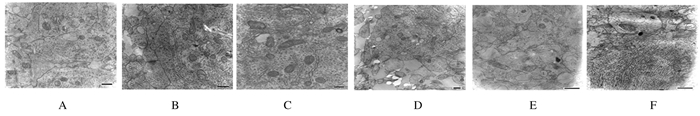
|
| Lane 1-3:Control group; Lane 4-6:Hyperoxia group; Lane 1, 4:1 d after hyperoxia exposure; Lane 2, 5:3 d after hyperoxia exposure; Lane 3, 6:7 d after hyperoxia exposure. 图 2 2组大鼠脑组织中海马椎体细胞超微结构(×12 000) Figure 2 Ultrastructures of hippocampus cells in brain tissue ofrats in two groups(×12 000) |
|
|
高氧模型组大鼠脑组织中NPR-A水平高于对照组(P<0.05),且随着高氧暴露时间延长而增加,与对照组比较差异有统计学意义(P<0.05)。仅高氧暴露1d时2组大鼠脑组织中NPR-B水平比较差异有统计学意义(P<0.05),高氧暴露3和7d时2组大鼠脑组织中NPR-B水平比较差异均无统计学意义(P>0.05)。见图 3和表 2。
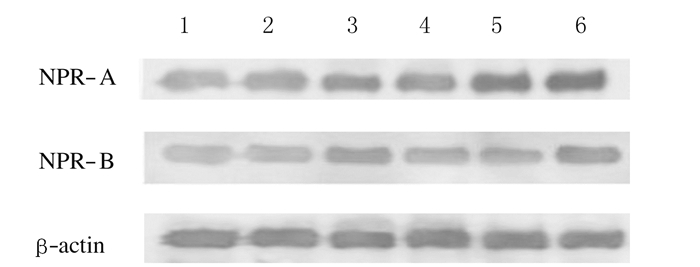
|
| A-C:Control group; D-E:Hyperoxia model group. A, D:1 d after hyperoxia exposure; B, E:3 d after hyperoxia exposure; C, F:7 d after hyperoxia exposure. 图 3 2组大鼠脑组织中NPR-A和NPR-B表达电泳图 Figure 3 Electrophoregram of expressions of NPR-A and NPR-B in brain tissue ofrats in two groups |
|
|
| (n=10, x±s) | |||||||
| Group | NPR-A level | NPR-B level | |||||
| (t/d) 1 | 3 | 7 | 1 | 3 | 7 | ||
| Control | 0.740±0.001 | 0.750±0.006 | 0.840±0.005 | 0.740±0.002 | 0.750±0.002 | 0.810±0.011 | |
| Hyperoxia model | 0.880±0.048* | 1.030±0.007* | 1.160±0.008* | 0.790±0.019* | 0.790±0.012 | 0.850±0.010 | |
| * P<0.05 compared with control group. | |||||||
对照组新生大鼠脑组织中cGMP水平随着大鼠日龄的增加而升高。与对照组比较,高氧暴露1、3和7d时,高氧模型组大鼠脑组织中cGMP水平明显升高(P < 0.05)。见表 3。
| [n=10, x±s, cB/(μmol·L-1)] | |||
| Croup | cGMP level | ||
| (t/d)1 | 3 | 7 | |
| Control | 0.330±0.016 | 0.360±0.009 | 0.370±0.008 |
| Hyperoxia model | 0.390±0.011* | 0.430±0.018* | 0.460±0.006* |
| *P<0.05 compared with control group. | |||
新生儿期常压高浓度吸氧可明显改善早产儿因呼吸窘迫引起的缺氧状态,对于低氧血症、缺血缺氧性脑病的治疗效果尤为显著[8],但是长时间常压高浓度吸氧对机体有一定的不良反应。研究[9-10]表明:早产儿各组织和器官发育极不成熟,对高氧引起的氧化应激及炎症反应等特别敏感,常见并发症主要包括肺损伤、视器损伤及神经系统损伤等,其中脑组织中枢神经系统损伤是造成围生期新生儿伤残及死亡的主要因素之一,临床上常表现为惊厥、脑水肿、昏迷、脑瘫、语言及视力发育障碍等。近年来,高氧暴露产生的体内代谢产物—活性氧被广泛认为是导致脑神经细胞损伤的主要原因,体内抗氧化系统受损会导致脑能量代谢改变,氧化应激、炎症、损伤和修复过程会产生神经毒性作用,导致神经细胞损伤和分化障碍。在诸多哺乳动物中,新生大鼠的脑组织神经结构与早产儿最为接近,高氧暴露后其脑组织病理变化也十分相似[11-12]。与新生儿大脑的发育过程比较,哺乳动物的大脑存在发育滞后现象,产后1 d新生大鼠相当于孕18~20周胎儿,产后2 d大鼠相当于孕20~24周胎儿,产后3 d大鼠相当于孕24~28周出生的早产儿,产后5 d大鼠相当于28~32周出生的早产儿。因此,本实验选用出生后12 h内新生大鼠模拟新生儿期长时间常压高浓度氧疗环境,复制新生大鼠高氧诱导脑损伤模型。本研究结果显示:高氧模型组新生大鼠长时间高氧暴露后活动明显减少,精神状态差,出现爬行姿势不稳、发育迟缓和惊厥等脑神经系统损害表现,这与新生儿脑组织损伤后的临床症状较相似,考虑原因为新生大鼠长时间暴露于高氧环境中,导致神经连接的密度、神经细胞的活性降低及神经营养因子表达水平降低,同时促炎症因子的释放增加,加快神经细胞及血管内皮细胞的损伤,毛细血管数量减少,进而破坏脑组织血液循环及供应,从而出现神经系统异常的表现,这与Bender等[13]报道的结果一致。检测2组新生大鼠体质量的结果显示:高氧模型组大鼠体质量的增长明显低于对照组,提示高氧诱导可影响新生大鼠的新陈代谢,从而减慢各组织器官的生长发育情况,与文献[3, 7]报道相符。
在新生儿大脑发育成熟的过程中,长期处于高氧环境可能使神经运动功能受到损害,远期认知功能也会产生一定的缺陷,但其发生机制是否与脑组织海马区有关联尚未明确[14]。文献[15]报道:高氧暴露后引起的远期迟发性认知、学习与记忆功能障碍可伴随患儿持续至成年,但脑组织的损害不随着神经系统的发育而得到恢复,相关认知功能的改变可能与海马区域神经通路有关。本研究中高氧模型组高氧暴露3d的新生大鼠脑组织病理切片显示:大鼠海马椎体细胞体积缩小,排列稀疏;高氧暴露7d时出现深染皱缩,细胞与周围分界不清,呈现明显病理损伤变化,提示高氧诱发的脑细胞损伤于高氧暴露后立即发生,随着高氧暴露时间的延长(高氧暴露7d时),脑损伤程度加重,大脑组织病理改变最为典型,临床上这一阶段正是新生儿脑组织神经细胞发育最快、同时也是最易受损的时期,与文献[16]报道一致。另外高氧模型组新生大鼠脑组织电镜下超微结构的改变与Serdar等[17]报道一致,进一步证实本研究已成功建立高氧脑损伤动物模型。
NPs通过与其特异性受体NPRs结合而产生相应的生理作用,包括排钠利尿、扩张血管、通过抑制RAAS系统和SNS系统进而起到降压作用等[18],可缓解新生大鼠脑组织处于代偿性缺氧缺血的状态,改善脑水肿及脑血流不足的影响。研究[16, 19]表明:人类和大鼠的NPR-A和NPR-B高表达于垂体、小脑、肾脏及心脏内皮细胞,在脑组织中,嗅球僧帽细胞层、内侧缰核、穹隆下器官和后斑状等区域皆有表达,在下丘脑和脑垂体的整个神经叶中表达尤为明显。NPR-A和NPR-B以单体-二聚体动态平衡的状态存在,参与cGMP的合成,调节cGMP依赖蛋白的活性。cGMP作为胞内特异性第二信使,激活并调节特定的依赖蛋白,参与神经元间信号传导,介导NPs在细胞内发挥相关生物学效应。Domek等[20]研究显示:cGMP在血小板聚集、松弛平滑肌和免疫调节中扮演重要角色,cGMP参与大脑内神经细胞发育及生长过程,cGMP通过PKG和API转录因子的调节影响脑组织中相关蛋白的表达和细胞分化。本实验中高氧暴露1、3和7d时,新生大鼠脑组织中NPR-A及cGMP水平升高,而NPR-B水平升高程度小,考虑造成上述结果的原因可能与NPR-B蛋白基因调控系统中存在具有负反馈作用的cGMP反应元件有关,其抑制了NPR-B蛋白的表达,与Farrow等[21]和刘瑶等[22]的研究结果一致,但其基因调控系统研究较少,仍有待于今后的进一步探讨。
综上所述,高氧诱导下新生大鼠脑组织中NPR-A和cGMP水平升高,NRP-cGMP信号通路参与了高氧诱导脑损伤的发生。
| [1] | Laura T, Michele S. Comparative response of brain to chronic hypoxia and hyperoxia[J]. Int J Mol Sci, 2017, 18(9): 1–24. |
| [2] | 杨山, 张有辰, 李慧文, 等. 前列腺素E1对高氧诱导新生大鼠脑损伤的保护作用[J]. 中国当代儿科杂志, 2018, 20(3): 230–235. DOI:10.7499/j.issn.1008-8830.2018.03.013 |
| [3] | 陈坤, 蒋朴, 徐颖, 等. Toll样受体4在新生小鼠常压高氧脑损伤中的作用[J]. 免疫学杂志, 2012, 28(2): 98–103. |
| [4] | Brehmer F, Bendix I, Prager S, et al. Interaction of inflammation and hyperoxia in a rat model of neonatal white matter damage[J]. PLoS One, 2012, 7(11): e49023. DOI:10.1371/journal.pone.0049023 |
| [5] | 孙程, 吐尔逊娜依. 钠尿肽来源于并且作用于神经胶质细胞[J]. 中国实用医药, 2011, 6(6): 241–242. |
| [6] | 田美慧, 曹志鹏, 雒心怡, 等. 脑钠尿肽的表达调控机制及其法医学应用[J]. 中国法医学杂志, 2017, 32(5): 472–475. |
| [7] | 宋朝敏, 王程毅, 陈涵强, 等. 新生大鼠高氧脑损伤的评价研究[J]. 中国新生儿科杂志, 2014, 29(1): 54–57. |
| [8] | Schmitz T, Krabbe G, Weikert G, et al. Minocycline protects the immature white matter against hyperoxia[J]. Exp Neurol, 2014, 254: 153–165. DOI:10.1016/j.expneurol.2014.01.017 |
| [9] | 李慧文, 张有辰, 许春花, 等. C型钠尿肽腹腔注射对新生大鼠高氧肺损伤的防治作用及其机制探讨[J]. 山东医药, 2018, 58(2): 37–39. |
| [10] | Goren B, Cakir A, Sevinc C, et al. Uridine treatment protects against neonatal brain damage and long-term cognitive deficits caused by hyperoxia[J]. Brain Res, 2017, 1676: 57–68. DOI:10.1016/j.brainres.2017.09.010 |
| [11] | 杜敏, 刘扬, 蒋朴, 等. 小胶质细胞在高氧暴露未成熟脑损伤中的作用[J]. 免疫学杂志, 2014, 30(12): 1069–1072. |
| [12] | 刘杨, 蒋朴, 徐颖. 脂多糖可致敏高浓度氧对新生小鼠未成熟脑的损伤[J]. 南方医科大学学报, 2014, 34(2): 214–217. |
| [13] | Bender GF, Sun X, Kuang Y, et al. Decreased VEGF expression and microvascular density, but increased HIF-1 and 2α accumulation and EPO expression in chronic moderate hyperoxia in the mouse brain[J]. Brain Res, 2012, 1471: 46–55. DOI:10.1016/j.brainres.2012.06.055 |
| [14] | Salmaso N, Jablonska B, Scafidi J, et al. Neurobiology of premature brain injury[J]. Nat Neurosci, 2014, 17(3): 341–346. DOI:10.1038/nn.3604 |
| [15] | 熊高洁, 唐俊海, 刘漫君, 等. 高氧对缺血缺氧新生大鼠远期学习记忆能力的影响[J]. 成都医学院学报, 2013, 8(5): 554–555. |
| [16] | 许春花, 王永双, 杨磊, 等. 重组人促红细胞生成素对高氧脑损伤大鼠脑组织Caspase-3、Bcl-2表达的影响[J]. 山东医药, 2017, 57(42): 34–36. DOI:10.3969/j.issn.1002-266X.2017.42.009 |
| [17] | Serdar M, Herz J, Kempe K, et al. Fingolimod protects against neonatal white matter damage and long-term cognitive deficits caused by hyperoxia[J]. Brain Behav Immun, 2016, 52: 106–119. DOI:10.1016/j.bbi.2015.10.004 |
| [18] | 姜曰水, 陈蕴, 金坚. 钠尿肽受体的结构特征及信号转导机制[J]. 中国科学, 2013, 43(5): 368–375. |
| [19] | 赵寒阳, 胡婉婷, 许春花. IGF-1对新生大鼠高氧脑损伤的钠尿肽受体表达的影响[J]. 吉林医学, 2017, 38(5): 803–805. |
| [20] | Domek-Lopacinska K, Strosznajder JB. Cyclic GMP metabolism and its role in brain physiology[J]. J Physiol Pharmacol, 2005, 56(Suppl 2): 15–34. |
| [21] | Farrow KN, Lee KJ, Perez M, et al. Brief hyperoxia increases mitochondrial oxidation and increases phosphodiesterase 5 activity in fetal pulmonary artery smooth muscle cells[J]. Antioxid Redox Signal, 2012, 17(3): 460. DOI:10.1089/ars.2011.4184 |
| [22] | 刘瑶, 赵雅宁, 李建民, 等. P38MAPK通路对脑缺血后处理大鼠海马自噬的影响[J]. 西安交通大学学报:医学版, 2017, 38(4): 522–528. |
 2018, Vol. 44
2018, Vol. 44


