扩展功能
文章信息
- 梁冰, 刘扬, 宋金萍, 曲丹华, 刘纯岩
- LIANG Bing, LIU Yang, SONG Jinping, QU Danhua, LIU Chunyan
- 组蛋白去乙酰化酶抑制剂SAHA对卵巢癌SKOV3细胞的化疗增敏作用
- Enhancement of histone deacetylase inhibitors SAHA in chemotherapeutic sensitivity of ovarian cancer SKOV3 cells
- 吉林大学学报(医学版), 2018, 44(03): 471-476
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 471-476
- 10.13481/j.1671-587x.20180303
-
文章历史
- 收稿日期: 2017-03-28
2. 吉林大学公共卫生学院放射医学实验 教学中心, 吉林 长春 130021;
3. 吉林大学基础医学院病理学与病理生理学系, 吉林 长春 130021;
4. 吉林大学第二医院呼吸内科, 吉林 长春 130041;
5. 吉林大学第二医院放射线科, 吉林 长春 130041
2. Radiation Medicine Teaching Experiment Center, School of Public Health, Jilin University, Changchun 130021, China;
3. Department of Pathology and Pathophysiology, School of Basic Medical Sciences, Jilin University, Changchun 130021, China;
4. Departmentof Respiratory Medicine, Second Hospital, Jilin University, Changchun 130041, China;
5. Department of Radiology, Second Hospital, Jilin University, Changchun 130041, China
卵巢癌是死亡率最高的妇科恶性肿瘤[1],据统计,全世界每年有近204 000例新发病例,并有近125 000名妇女死于卵巢癌,其严重威胁女性的生命健康[2]。上皮性卵巢癌是致死率最高的女性生殖系统肿瘤,约占卵巢恶性肿瘤的90%[3]。尽管大多数卵巢癌患者在标准治疗后达到了预期效果,但其5年生存率无明显改善。在细胞减灭手术和基于铂或紫杉醇药物化疗后,由于存在原发和继发耐药现象,卵巢癌复发率高达70%[4]。因此,寻找卵巢癌化疗耐药后的敏感新药和优化化疗联合方案势在必行。据报道[5]:组蛋白去乙酰化酶(histone deacetylase, HDAC)在各种癌症(包括卵巢癌)中过度表达。HDAC抑制剂(histone deacetylase inhibitors,HDACIs)是新兴的且有开发前景的抗肿瘤化合物。辛二酰苯胺异羟肟酸(suberoylanilide hydroxamicacid,SAHA)为一种常用的HDACIs,已被用于治疗实体瘤和血液肿瘤[6]。SAHA在体外可抑制卵巢癌SKOV3细胞增殖、诱导凋亡,但目前尚无关于SAHA联合长春新碱(vincristine,VCR)作用于卵巢癌的研究报道。本研究应用SAHA作用于卵巢癌SKOV3细胞,体外观察SAHA对SKOV3细胞增殖及化疗敏感性的作用,并探讨其对细胞凋亡、自噬及周期的影响,进一步为临床研究提供依据。
1 材料与方法 1.1 细胞、主要试剂和仪器人卵巢癌SKOV3细胞由加拿大British Columbia Cancer Research Centre的Dr Ling惠赠。α-MEM培养基和胰蛋白酶购自美国Gibco公司,VCR和SAHA粉末购自美国Sellek公司,细胞凋亡检测试剂盒购自美国BD公司,CCK-8试剂盒购自日本同仁公司,单丹磺酰尸胺(Dansylcadaverine, MDC)染料购自美国Sigma公司。流式细胞仪购自美国BD公司,酶标仪购自美国伯腾公司。
1.2 细胞培养人卵巢SKOV3细胞采用α-MEM培养基(含15%FBS、青霉素和链霉素各100 U·mL -1)置于37℃、5% CO2培养箱中培养,采用0.25%胰酶(含0.2% EDTA)消化并传代,取对数生长期细胞进行后续实验。
1.3 CCK-8法检测细胞生存率收集对数生长期SKOV3细胞,接种于96孔培养板内,每孔加入1×104个细胞,置于37℃、5%CO2环境中孵育24 h。按照实验需求处理细胞并将细胞分组。VCR组:终浓度分别为0(对照组)、0.01、0.05、0.10、0.50、1.00、10.00、20.00、30.00和40.00 mg·L-1;SAHA组:终浓度分别为0(对照组)、0.1、0.2、0.4、0.8、1.6、3.2、6.4、12.8和25.6 μmol·L-1;SAHA+VCR组:SAHA浓度为3和5 μmol·L-1,VCR浓度分别为0、0.01、0.05、0.10和0.50 mg·L-1,作用时间均为24 h。对照组细胞不给予任何处理(VCR0mg·L-1)。每组设3个复孔,置于37℃、5% CO2细胞培养箱中培养。24h后弃去原培养基,每孔加入90 μL新鲜培养基及10 μL CCK-8溶液,低速振荡混匀,置于37℃、5% CO2细胞培养箱中孵育2 h,于酶标仪450 nm波长处测定各孔吸光度(A)值,计算细胞生存率。细胞生存率=实验组A值/对照组A值×100%。
1.4 流式细胞术(FCM)检测细胞凋亡率、自噬和周期分布取对数生长期细胞分为对照组(0μmol·L-1SHHA,0μmol·L-1 VCR)、SAHA组(3或5 μmol·L-1)、VCR组(0.1 mg·L-1)、SAHA+VCR组(3或5 μmol·L-1SAHA +0.1 mg·L-1VCR),置于37℃、5% CO2培养箱中培养24 h后,收集各组细胞,采用PBS洗涤3次,调整细胞浓度保证每个样品收集1×105个细胞。①细胞凋亡率检测:每个样品分别加入5 μL Annexin Ⅴ-FITC和5 μL PI染色液,混合均匀,室温下避光孵育20 min。染色后1 h内,采用FCMCell Quest软件检测并分析各组细胞凋亡率。②细胞自噬率检测:每个样品分别加入终浓度为0.05 mmol·L-1MDC,于37℃避光孵育30 min,PBS洗涤3次,每个样品加入1 mL 4%多聚甲醛,室温避光固定15 min,PBS洗涤1次,FCM检测分析各组MDC阳性细胞百分率(即细胞自噬率),所得数据采用Cell Quest软件进行分析。③细胞周期检测:每个样品分别加入400 μL RNAse A,200 μL PI(含Triton-X100),充分混匀,室温避光孵育20 min,FCM检测细胞周期,Cell Quest软件收集,ModFit软件分析数据,结果以各期细胞百分率表示。每个样本至少设3复孔。实验重复3次。
1.5 统计学分析采用SPSS 11.0统计软件进行统计学分析。各组SKOV3细胞生存率、凋亡率、自噬率和各周期细胞百分率以x±s表示,组间均数两两比较采用方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组SKOV3细胞生存率与对照组比较,SAHA组和VCR组SKOV3细胞生存率降低,尤其在0.10、0.50、1.00、10.00、20.00、30.00、40.00mg·L-1VCR组(P < 0.05)和1.6、3.2、6.4、12.8、25.6μmol·L-1SAHA组(P < 0.05),并且其诱导的细胞毒性具有剂量依赖性,见表 1。与SAHA或VCR组比较,SAHA + VCR组SKOV3细胞生存率明显降低(P < 0.05)。见表 2。
| (n=3, x±s, η/%) | |
| Group | Survival rate |
| VCR (mg·L-1) | |
| 0(control) | 100.00±9.98 |
| 0.01 | 98.17±3.34 |
| 0.05 | 97.01±4.09 |
| 0.10 | 65.89±4.25* |
| 0.50 | 43.57±6.77* |
| 1.00 | 41.58±4.07* |
| 10.00 | 38.92±3.10* |
| 20.00 | 38.76±4.26* |
| 30.00 | 37.26±4.24* |
| 40.00 | 35.10±2.54* |
| SAHA(μmol·L-1) | |
| 0(control) | 100.00±3.26 |
| 0.1 | 99.83±4.73 |
| 0.2 | 98.75±1.81 |
| 0.4 | 95.90±6.52 |
| 0.8 | 93.15±4.07 |
| 1.6 | 85.96±1.49* |
| 3.2 | 70.09±4.97* |
| 6.4 | 52.88±1.00* |
| 12.8 | 38.43±2.79* |
| 25.6 | 28.40±0.77* |
| *P < 0.05 compared with control group. | |
| (n=3, x±s, η/%) | |||||
| SAHA (μmol·L-1) |
Survival rate | ||||
| VCR (mg·L-1) 0 | 0.01 | 0.05 | 0.10 | 0.50 | |
| 0 | 100.00±3.71 | 99.58±4.46 | 98.36±2.84 | 69.30±2.03* | 52.00±1.46* |
| 3 | 78.07±2.14* | 76.90±2.46*△ | 74.23±4.77*# | 41.47±3.53*○▲ | 30.33±1.66*□● |
| 5 | 63.83±4.51* | 59.19±4.11*● | 58.54±3.56*● | 30.20±2.77*○■ | 17.00±1.25*▲■ |
| * P < 0.05 compared with control group;△ P < 0.05 compared with 0 μmol·L-1 SAHA+0.01 mg·L-1 VCR group; # P < 0.05 vs 0 μmol·L-1 SAHA+0.05 mg·L-1 VCR group; ○ P < 0.05 vs 0 μmol·L-1 SAHA+0.10 mg·L-1 VCR group; □ P < 0.05 vs 0 μmol·L-1 SAHA+0.50 mg·L-1 VCR group; ● P < 0.05 compared with 3 μmol·L-1 SAHA+0mg·L-1 VCR group; ■ P < 0.05 compared with 5 μmol·L-1 SAHA+0 mg·L-1 VCR group. | |||||
与对照组(6.11%±0.03%)比较,VCR组细胞凋亡率(17.77%±0.27%)明显升高(P < 0.05),3 μmol·L-1 SAHA组(15.03%±0.83)%和5 μmol·L-1 SAHA组(20.24%±0.52%)SKOV3细胞凋亡率升高(P < 0.05),且SAHA浓度越高,细胞凋亡率越高(P < 0.05)。与SAHA或VCR组比较,3 μmol·L-1 SAHA + VCR组(27.14%±1.48%)和5 μmol·L-1 SAHA + VCR组(40.12%±2.10%)细胞凋亡率升高(P < 0.05)。见图 1。

|
| A:Control group; B:3 μmol·L-1 SAHA group; C:5 μmol·L-1 SAHA group; D:VCR group; E:3 μmol·L-1SAHA+VCRgroup; F:5 μmol·L-1 SAHA+VCRgroup. 图 1 FCM检测各组SKOV3细胞凋亡率 Figure 1 Apoptotic rates of SKOV3 cells in various groups detected by FCM |
|
|
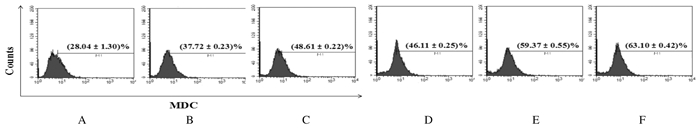
VCR能够诱导SKOV3细胞发生自噬,与对照组比较,3和5 μmol·L-1 SAHA组细胞自噬率明显升高,且SAHA浓度越高,SKOV3细胞自噬率升高越明显(P < 0.05)。与SAHA或VCR组比较,SAHA + VCR组细胞自噬率明显升高(P < 0.05)。见图 2。
|
| A:Control group; B:3 μmol·L-1 SAHA group; C:5 μmol·L-1 SAHA group; D:VCR group; E:3 μmol·L-1SAHA+VCR group; F:5 μmol·L-1 SAHA+VCR group. 图 2 FCM检测各组SKOV3细胞自噬率 Figure 2 Autophagy rates of SKOV3 cells in various groups detected by FCM |
|
|
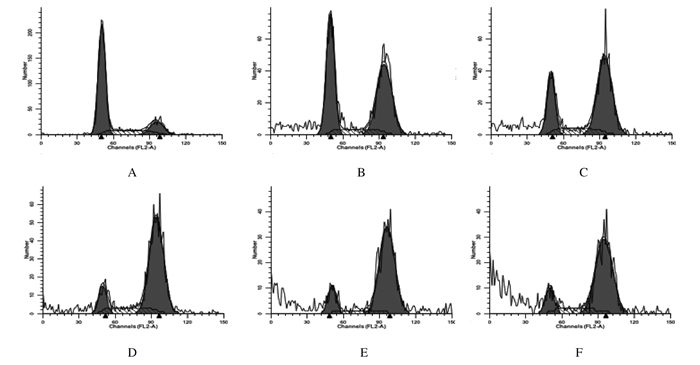
与对照组比较,只加入VCR(0.1 mg·L-1)和只加入SAHA组(3或5μmol·L-1)G2 / M期细胞百分率明显升高(P < 0.05),G1期细胞百分率降低(P < 0.05);与只加入VCR组比较,SAHA + VCR组G2 / M期细胞百分率升高(P < 0.05);与3 μmol·L-1SHHA组或5μmol·L-1SAHA组比较,SAHA+VCR组G2/M期细胞百分率升高(P < 0.05)。见图 3和表 3。
|
| A:Control group; B:3 μmol·L-1 SAHA group; C:5 μmol·L-1 SAHA group; D:VCR group; E:3 μmol·L-1SAHA+VCR group; F:5 μmol·L-1 SAHA+VCR group. 图 3 FCM检测各组SKOV3细胞不同细胞周期分布 Figure 3 Distribution ofSKOV3 cells at different cell cyclesin various groups detected by FCM |
|
|
| (n=3, x±s, η/%) | ||||
| Group | Percentage of cells | |||
| G1 | S | G2 / M | ||
| SAHA(μmol·L-1)+ | 0+0(control) | 69.60±1.45 | 15.06±1.96 | 15.34±0.50 |
| VCR(mg·L-1) | 3+0 | 40.41±2.82* | 13.99±3.80 | 45.60±2.02* |
| 5+0 | 25.59±0.16* | 13.46±1.22* | 60.95±0.28* | |
| 0+0.1 | 30.52±1.09* | 14.00±0.66 | 55.48±1.76* | |
| 3+0.1 | 15.75±3.65*△#○ | 9.30±3.31*△#○ | 74.95±0.34*△#○ | |
| 5+0.1 | 13.87±1.23*△#○ | 6.22±2.53*△#○ | 79.91±1.30*△#○ | |
| * P < 0.05 compared with control group(0+0);△ P < 0.05 compared with 0 μmol·L-1 SAHA+0.1mg·L-1 VCR group;# P < 0.05 compared with 3 μmol·L-1 SAHA group; ○ P < 0.05 compared with 5 μmol·L-1 SAHA group. | ||||
由于患者对化疗药物的反应差导致其生存率低,是治疗卵巢癌的一个亟待解决的难题。表观遗传学中的乙酰化修饰调节与肿瘤的发生发展密切相关。组蛋白是真核生物体内染色体中的碱性蛋白质,其乙酰化与去乙酰化受组蛋白乙酰基转移酶(histone acetyltransferase, HAT)和HDAC两类酶调节。HDACIs是一种新兴的抗肿瘤化合物,HDACIs可以通过抑制核小体组蛋白中的HDAC活性促进组蛋白乙酰化,进而调节染色质动力学,激活某些基因的转录,最终抑制肿瘤的发生发展[7]。HDACIs具有多种抗癌活性,如可促进细胞周期阻滞、细胞凋亡、血管发生抑制和DNA损伤。
HDACIs根据其化学结构分为4种不同类型,分别是异羟肟酸、环肽、短链脂肪酸和苯甲酰胺[8]。SAHA属于异羟肟酸类的HDACIs,是1种具有膜通透性的可逆的竞争性抑制剂,其通过与位于HDAC的催化结构域中的锌离子结合,在细胞质和细胞核中均能发挥抑制HDAC的作用[9]。SAHA能够抑制Ⅰ类HDAC(HDAC1、HDAC2和HDAC3)和Ⅱ类HDAC(HDAC6),是美国食品和药物管理局(FDA)批准用于皮肤T细胞淋巴瘤(cutaneous T cell lymphoma, CTCL)临床应用的第1种HDACIs[10]。SAHA对正常细胞的毒性较低[11],在结肠癌、前列腺癌、乳腺癌、非小细胞肺癌、卵巢癌和口腔鳞状细胞癌等不同肿瘤治疗中具有较大潜力[12]。
本研究结果显示:SAHA以剂量依赖的方式抑制了卵巢癌SKOV3细胞的增殖。联合使用SAHA和VCR能够进一步增加SKOV3细胞的死亡率,即起到增敏作用,这种现象的机制尚未清楚。细胞的死亡方式有很多种,其中最重要细胞死亡方式是凋亡和自噬。VCR能够诱导肿瘤细胞发生凋亡和自噬[13-14]。研究[15]显示:SAHA可以通过诱导凋亡来抑制卵巢癌细胞的生长。并且最近报道[16]指出:HDACIs是肿瘤细胞中有效的自噬诱导剂,在某些高增殖性肿瘤中自噬是HDACIs的重要治疗靶点。将SAHA与其他药物联合应用可增强细胞自噬水平,最终提高抗肿瘤治疗的效果。本研究结果显示:与对照组比较,SAHA与VCR均能够诱导SKOV3细胞发生凋亡;与Dietrich等[15]发现的SAHA可以通过诱导凋亡来抑制卵巢癌细胞生长的结论一致。与SAHA或VCR组比较,SAHA + VCR组细胞凋亡率进一步升高,说明SAHA和VCR联合用药能够使SKOV3细胞凋亡率升高,SAHA可以增强SKOV3细胞对VCR的敏感性。经SAHA或VCR处理后,SKOV3细胞自噬率明显升高。为明确SAHA在VCR诱导卵巢癌细胞自噬性死亡中的作用,本研究分别使用不同浓度SAHA与VCR联合作用SKOV3细胞的结果显示:与单独用药组比较,SAHA+VCR组细胞自噬率升高更为明显,说明SAHA不仅能够诱导卵巢癌细胞发生自噬性死亡,而且增强了VCR诱导的SKOV3细胞的自噬水平。上述结果为SAHA联合化疗药治疗卵巢癌提供了重要的靶点。
VCR是从长春花中提取出来的有效成分,主要通过抑制微管蛋白的聚合影响纺锤体微管的形成,使细胞停止在有丝分裂中期而发挥抗肿瘤作用。临床上常用于急性淋巴细胞性白血病的治疗,除此之外,对其他肿瘤如乳腺癌、恶性淋巴肿瘤、卵巢癌和淋巴肉瘤也有疗效。本研究采用FCM检测细胞周期的结果显示:VCR将SKOV3细胞阻滞于G2 / M期。研究[17-18]显示:HDACIs可以抑制cyclin B1蛋白的表达,进而促进肿瘤细胞阻滞于G2 / M期。本研究结果显示:不同浓度SAHA均导致了细胞于G2 / M期进程阻滞,证实了Lee等[16]研究中SAHA诱导MCF-7乳腺癌细胞发生G2 / M期进程阻滞这一结论。SAHA与VCR联用后,G2/M期细胞数量进一步增加,说明SAHA促进VCR诱导的SKOV3细胞G2 / M期阻滞,为SAHA与化疗药物联合应用治疗卵巢癌提供了理论依据。细胞增殖与细胞周期关系密切,正常细胞周期主要由G0 / G1、S和G2 / M期组成,SAHA联合VCR对细胞G2 / M期有延缓或阻滞效应,可抑制细胞有丝分裂,进而抑制细胞增殖。因此SAHA发挥的细胞周期阻滞作用是其发挥化疗增敏作用的另一重要机制。
综上所述,SAHA可以通过G2 / M期阻滞抑制细胞周期进程,诱导细胞凋亡和发生自噬,最终发挥增强卵巢癌细胞对VCR敏感性的作用。化疗药物具有多种副作用,应用SAHA可以明显降低化疗药物的使用剂量,同时保持相同的治疗效果,因此将SAHA与化疗药物联合应用可能是提高卵巢癌患者化疗疗效的新策略。
| [1] | Bast RC Jr, Hennessy B, Mills GB. The biology of ovarian cancer:New opportunities for translation[J]. Nat Rev Cancer, 2009, 9(6): 415–428. DOI:10.1038/nrc2644 |
| [2] | Ozols RF, Bookman MA, Connolly DC, et al. Focus on epithelial ovarian cancer[J]. Cancer Cell, 2004, 5(1): 19–24. DOI:10.1016/S1535-6108(04)00002-9 |
| [3] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1): 11–30. DOI:10.3322/caac.v63.1 |
| [4] | Monk BJ, Coleman RL. Changing the paradigm in the treatment of platinum-sensitive recurrent ovarian cancer:from platinum doublets to nonplatinum doublets.and adding antiangiogenesis compounds[J]. Int J Gynecol Cancer, 2009, 19(suppl 2): S63–S67. DOI:10.1111/IGC.0b013e3181c104fa |
| [5] | Qin Y, Zhao X, Fang Y. PP242 synergizes with suberoylanilide hydroxamic acid to inhibit growth of ovarian cancer cells[J]. Int J Gynecol Cancer, 2014, 24(8): 1373–1380. DOI:10.1097/IGC.0000000000000238 |
| [6] | Marks PA, Breslow R. Dimethyl sulfoxide to vorinostat:development of this histone deacetylase inhibitor as an anticancer drug[J]. Nat Biotechnol, 2007, 25(1): 84–90. DOI:10.1038/nbt1272 |
| [7] | Siegel D, Hussein M, Belani C, et al. Vorinostat in solid and hematologic malignancies[J]. J Hematol Oncol, 2009, 2: 31. DOI:10.1186/1756-8722-2-31 |
| [8] | Bolden JE, Peart MJ, Johnstone RW. Anticancer activities of histone deacetylase inhibitors[J]. Nat Rev Drug Discov, 2006, 5(9): 769–784. DOI:10.1038/nrd2133 |
| [9] | Olson DE, Sleiman SF, Bourassa MW, et al. Hydroxamate-based histone deacetylase inhibitors can protect neurons from oxidative stress via a histone deacetylase-independent catalase-like mechanism[J]. Chem Biol, 2015, 22(4): 439–445. DOI:10.1016/j.chembiol.2015.03.014 |
| [10] | Slingerland M, Guchelaar HJ, Gelderblom H. Histone deacetylase inhibitors:an overview of the clinical studies in solid tumors[J]. Anticancer Drugs, 2014, 25(2): 140–149. DOI:10.1097/CAD.0000000000000040 |
| [11] | Emanuele S, Lauricella M, Tesoriere G. Histone deacetylase inhibitors:apoptotic effects and clinical implications(Review)[J]. Int J Oncol, 2008, 33(4): 637–646. |
| [12] | Grabarska A, Luszczki JJ, Nowosadzka E, et al. Histone deacetylase inhibitor SAHA as potential targeted therapy agent for larynx cancer cells[J]. J Cancer, 2017, 8(1): 19–28. DOI:10.7150/jca.16655 |
| [13] | Fan M, Goodwin ME, Birrer MJ, et al. The c-Jun NH2-terminal protein kinase/AP-1 pathway is required for efficient apoptosis induced by vinblastine[J]. Cancer Res, 2001, 61(11): 4450–4458. |
| [14] | Liang B, Liu X, Liu Y, et al. Inhibition of autophagy sensitizes MDR-phenotype ovarian cancer SKVCR cells to chemotherapy[J]. Biomed Pharmacother, 2016, 82: 98–105. DOI:10.1016/j.biopha.2016.04.054 |
| [15] | Dietrich CS, Greenberg VL, DeSimone CP, et al. Suberoylanilide hydroxamic acid (SAHA) potentiates paclitaxel-induced apoptosis in ovariancancer cell lines[J]. Gynecol Oncol, 2010, 116(1): 126–130. DOI:10.1016/j.ygyno.2009.09.039 |
| [16] | Lee YJ, Won AJ, Lee J, et al. Molecular mechanism of SAHA on regulation of autophagic cell death in tamoxifen-resistant MCF-7 breast cancer cells[J]. Int J Med Sci, 2012, 9(10): 881–893. DOI:10.7150/ijms.5011 |
| [17] | Chen MY, Liao WS, Lu Z, et al. Decitabine and suberoylanilide hydroxamic acid (SAHA) inhibit growth of ovarian cancer cell lines and xenografts while inducing expression of imprinted tumor suppressor genes, apoptosis, G2/M arrest and autophagy[J]. Cancer, 2011, 117(19): 4424–4438. DOI:10.1002/cncr.26073 |
| [18] | 王宝金, 申爱荣, 付喜玲, 等. APTO-253对紫杉醇或顺铂处理的卵巢癌SKOV3及OVCAR3细胞凋亡及细胞周期的影响[J]. 郑州大学学报:医学版, 2018, 53(1): 75–79. |
 2018, Vol. 44
2018, Vol. 44


