扩展功能
文章信息
- 吕鹏, 宁明杰, 邵玉, 张璐妮, 唐英, 王南博, 陈飞儿, 齐玲
- LYU Peng, NING Mingjie, SHAO Yu, ZHANG Luni, TANG Ying, WANG Nanbo, CHEN Feier, QI Ling
- 野黄芩苷对人脑胶质瘤U87细胞的增殖抑制作用及其机制
- Inhibitory effect of scutellarin on proliferation of human glioma U87 cellsand its mechanism
- 吉林大学学报(医学版), 2018, 44(03): 466-470
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 466-470
- 10.13481/j.1671-587x.20180302
-
文章历史
- 收稿日期: 2017-09-28
脑肿瘤由于发生位置特殊,易造成严重的后果,甚至危及患者的生命,至今仍无理想的治疗方法。脑肿瘤以胶质瘤最为常见,以恶性居多,综合疗法和抗肿瘤药替莫唑胺治疗的效果不理想[1-2]。野黄芩苷(scutellarin,SCU)又名灯盏乙素,是从菊科植物灯盏细辛中提取的黄酮类有效成分[3]。SCU具有降低脑血管阻力、改善脑血循环、增加脑血流量及抗血小板凝集的作用。近年来,SCU的抗肿瘤活性越来越受到重视[4-9],在临床上也广泛应用于抗肿瘤的治疗。但有关SCU对人脑胶质瘤U87细胞的作用及其机制的研究尚未见相关报道。本研究从细胞增殖活性、细胞形态表现和细胞凋亡率及蛋白表达等多方面探讨SCU对U87细胞的增殖抑制及诱导凋亡作用及其机制。
1 材料与方法 1.1 细胞、主要试剂和仪器人脑胶质瘤U87细胞由吉林大学基础医学院提供。SCU(中国食品药品检定研究院),0.25%胰蛋白酶和小牛血清(美国Gibco公司),RPMI-1640培养液(美国Hyclone公司),二甲基亚砜(DMSO)和四甲基偶氮唑蓝(MTT)(美国Sigma公司),bax和bcl-2抗体(美国Santa CRUZ公司)。CO2培养箱(CB150,德国Binder公司),J-26XP型超低温高速离心机和流式细胞仪EpicsXL(美国贝克曼公司),PLUS384型全自动酶标仪(美国MDC公司),β-actin抗体(英国Proteintech公司),DNA蛋白电泳系统(美国Bio-Rad公司),Image-Pro Plus图像分析管理系统(美国Media Cybernetics公司)。
1.2 细胞培养称取SCU,用含5%小牛血清的RPMI-1640细胞培养液配制原液,使SCU终浓度为400 mg·L-1,4℃保存备用。将含有10%小牛血清的DMEM培养基置于37℃培养箱中预热,将U87细胞从液氮罐中取出,37℃水浴振荡后1000 r·min-1离心5 min,采用1 mL培养基重悬后放至培养皿中,加入9 mL新鲜配置的培养基,轻轻混匀后放入5% CO2、37℃培养箱中培养。待细胞生长至80%~90%后,按1:3进行细胞传代培养。
1.3 MTT法检测各组U87细胞存活率采用含5%小牛血清的DMEM细胞培养液配制SCU,使药物浓度为20、40和80 mg·L-1。收集对数生长期的U87细胞,调整细胞浓度使其终浓度为8×104 mL-1。将混匀后的细胞均匀接种至96孔板中,每孔加入100 μL,在5% CO2、37℃培养箱中培养24 h,次日重新加入含有不同浓度SCU的培养液,每组设5个复孔,并设空白对照孔(未加细胞的空白对照组),培养72 h后终止反应,每孔中加入20 μLMTT,在37℃培养箱中继续培养4 h终止反应,弃掉上清液,每孔中加入150 μL DMSO,反应15 min后采用酶联免疫检测仪测定各孔波长为490 nm处的吸光度(A)值,计算细胞存活率。细胞存活率=药物组A值/空白对照组A值×100%。
1.4 倒置显微镜下观察各组U87细胞形态表现按每孔5×103个细胞将U87细胞接种至24孔板中,孵育24 h待细胞贴壁,加入80 mg·L-1SCU,同时设空白对照组,细胞孵育72 h后取出24孔板,倒置显微镜下观察其形态表现。
1.5 Annexin Ⅴ/PI双染检测各组U87细胞凋亡率采用80 mg·L-1 SCU处理U87细胞,同时设空白对照组,作用72 h后,胰酶消化细胞,PBS洗涤细胞2次,离心后台盼蓝计数活细胞。按照说明书操作,用1: 4 binding buffer缓冲液190μL重悬细胞,调整细胞浓度为1×106 mL-1,加入5 μLFITC标记的Annexin Ⅴ-FITC和10 μL20 mg·L-1 PI,冰浴10 min,流式细胞术检测各样品中每10 000个细胞中细胞周期各阶段的细胞凋亡率。细胞凋亡率=凋亡法细胞数/总细胞数×100%。
1.6 Westen blotting法检测各组细胞中bax和bcl-2蛋白表达水平收集对数生长期U87细胞,计数细胞并按细胞密度1×105 mL-1接种至6孔板,每孔加入5 mL新鲜培养基。实验组加入20、40和80 mg·L-1 SCU,作用72h,每组设3个复孔;空白对照组中加入相同体积的不含药物培养基。收集细胞并置于1.5 mL离心管中,离心后弃上清液,PBS洗涤细胞,加入50 μL细胞裂解液裂解细胞。4℃、12 000 r·min-1离心15 min,收集上清液,检测裂解后的蛋白浓度,SDS-PAGE电泳分离样品,转膜封闭,加入bax、bcl-2和β-actin抗体4℃孵育过夜。次日加入二抗,室温、避光孵育1 h,胶片曝光拍照。实验结果采用Image-Pro Plus图像分析软件进行分析,蛋白表达水平=特异性条带平均A值×条带的面积。
1.7 统计学分析采用SPSS17.0统计软件进行统计学分析。各组U87细胞存活率和细胞凋亡率以x±s表示,组间比较采用t检验;各组U87细胞中bcl-2和bax蛋白表达水平以x±s表示,组间比较采用t检验。以P < 0.01表示差异有统计学意义。
2 结果 2.1 各组U87细胞的存活率与空白对照组比较,20、40和80 mg·L-1 SCU组细胞存活率均明显降低(P < 0.01),半数抑制浓度(IC50)=27.55 mg·L-1。见表 1。
| (n=5, x±s) | ||
| Group | A | Survival rate(η/%) |
| Blank control | 0.85±0.03 | 100.00±4.35 |
| SCU(mg·L-1) | ||
| 20 | 0.47±0.03* | 55.38±4.35* |
| 40 | 0.21±1.86* | 25.11±3.18* |
| 80 | 0.15±0.02* | 18.19±2.66* |
| *P < 0.01 compared withblank control group. | ||
空白对照组细胞大而饱满,轮廓清楚,细胞间接触紧密。作用72 h后,80 mg·L-1 SCU组U87细胞数明显减少,细胞体积变小,细胞间距变大。细胞出现皱缩、脱落,贴壁细胞轮廓模糊。见图 1。
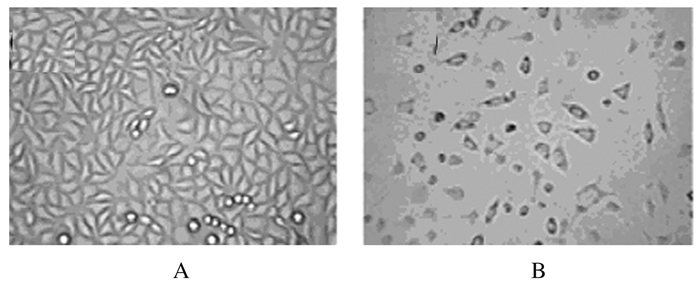
|
| A:Blank control group; B:80 mg·L-1 SCU group. 图 1 倒置显微镜下各组U87细胞形态表现(×200) Figure 1 Morphology of U87 cells in various groups under inverted microscope(×200) |
|
|
作用72 h后,80 mg·L-1 SCU组U87细胞晚期凋亡率(29.8%)和总凋亡率(33.1%)均明显升高,与空白对照组(1.4%和6.9%)比较差异有统计学意义(P < 0.01)。见图 2。
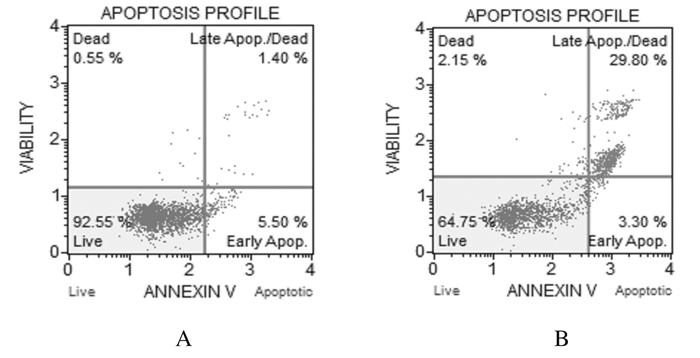
|
| A:Blank control group; B:80 mg·L-1 SCU group. 图 2 流式细胞式检测各组U87细胞凋亡率 Figure 2 Apoptotic rates of U87 cells in variousgroups detected by FCM |
|
|
与空白对照组比较,作用72 h后,20、40和80 mg·L-1 SCU组U87细胞作用中bax蛋白表达水平虽有降低趋势,但组间比较差异无统计学意义(P>0.05);与空白对照组比较,80mg·L-1 SCU组U87细胞中bcl-2蛋白表达水平明显降低(P < 0.01);与空白对照组比较,80 mg·L-1 SCU组U87细胞中bax/bcl-2比值升高(P < 0.01)。见图 3和表 2。
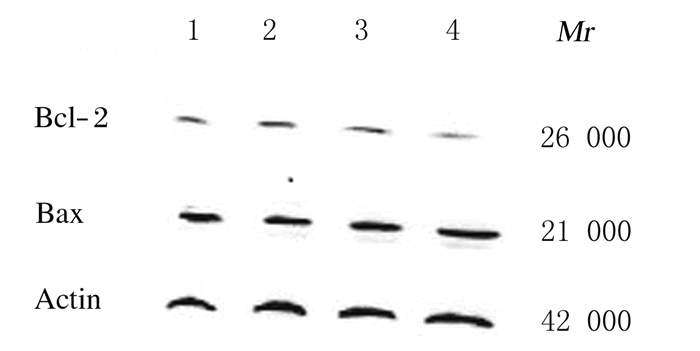
|
| Lane 1:Blank control group; Lane 2:20 mg·L-1SCU group; Lane 3:40 mg·L-1SCU group; Lane 4: 80 mg·L-1SCU group. 图 3 各组U87细胞中bcl-2和bax蛋白表达电泳图 Figure 3 Electrophoregram of expressions of bcl-2 and bax in U87 cells in various groups |
|
|
| (x±s) | |||
| Group | bax/β-actin | bcl-2/β-actin | bax/bcl-2 |
| Blank control | 1.19±0.54 | 1.25±0.48 | 0.95±0.46 |
| SCU(mg·L-1) | |||
| 20 | 1.03±0.57 | 0.94±0.54 | 1.09±0.59 |
| 40 | 1.00±0.59 | 0.95±0.56 | 1.04±0.59 |
| 80 | 0.94±0.54 | 0.66±0.50* | 1.42±0.71* |
| * P<0.01 compared with blank control group. | |||
作为人类死亡率最高的恶性肿瘤之一,原发性脑恶性肿瘤至今仍无理想的治疗方法。其中恶性程度最高的胶质母细胞瘤,即使经过目前认为最佳的治疗方案治疗,其治疗效果仍不乐观,患者平均生存期只有14个月。肿瘤细胞增殖和凋亡失衡致使肿瘤无限生长,在肿瘤形成的过程中,恶性肿瘤细胞凋亡或数量减少在肿瘤发展进程中起重要作用。诱导肿瘤细胞凋亡已成为新型抗癌药物的新靶点,细胞凋亡率可以作为一项新指标[10]评价抗肿瘤效果。在胶质瘤的治疗中,改进患者的生存质量,延长患者的生存时间已成为研究的重点。研究[11]显示:恶性胶质瘤细胞由于激活细胞生长途径和(或)抑制细胞凋亡途径而对治疗产生抵抗。
传统中药主要是天然的动植物和矿物质,不良反应少,来源广泛,因此成为研究热点。本实验所用SCU是从灯盏、细辛和黄芩茎叶中提取的黄酮类主要成分[12],具有较强的抗炎、抗氧化、抑制肿瘤[13-17]、改善记忆、降血脂、解热镇痛和提高机体免疫力等药理学活性和高效低毒的特点。研究[18-19]显示:SCU的抑制细胞生长和诱导细胞凋亡2个机制在抗肿瘤过程中起主要作用。
本课题组前期研究[20]显示:SCU可以抑制胶质瘤细胞的生长,但其机制尚不清楚。为明确SCU抑制胶质瘤细胞增殖的作用机制,本研究采用MTT法检测SCU作用胶质瘤后U87细胞存活率的结果显示:20、40和80 mg·L-1SCU分别作用于U87细胞72 h时,各组细胞存活率均明显降低。倒置显微镜观察结果显示:正常对照组细胞大而饱满,轮廓清楚,细胞间接触紧密。80 mg·L-1 SCU作用U87细胞72 h后,细胞数量明显减少,细胞的体积变小,细胞间距变大。细胞出现皱缩、脱落,贴壁细胞轮廓模糊。上述实验结果证明:SCU可以抑制U87胶质瘤细胞的增殖,且具有浓度依赖性。
肿瘤细胞的异常增殖是由于细胞周期失调控或者抗凋亡因素增加引起。为了明确SCU抑制胶质瘤细胞生长的机制,本研究采用Annexin Ⅴ/PI双染检测80 mg·L-1 SCU作用后U87细胞凋亡率结果显示:与空白对照组比较,SCU组U87细胞晚期凋亡率及总凋亡率均明显升高,说明SCU可诱导U87细胞凋亡。因此,本文作者推测SCU有诱导胶质瘤细胞发生凋亡的作用,从而抑制其增殖。
本研究结果显示:20、40和80 mg·L-1 SCU作用U87细胞后,细胞中bax蛋白表达水平虽有降低趋势,但组间比较差异无统计学意义。与空白对照组比较,80 mg·L-1 SCU组U87细胞中bcl-2蛋白表达水平明显降低,bax/bcl-2比值均明显升高。bcl-2基因及其所表达出来的蛋白可抑制多种肿瘤细胞的凋亡,使细胞寿命得以延长,所以称其为抗凋亡基因。而bax是bcl-2基因家族中成员,bax的生物学作用是拮抗bcl-2,促进细胞凋亡[21-24]。本研究结果提示:SCU可以明显降低U87细胞中bcl-2蛋白表达,升高bax/bcl-2比值,使促凋亡因素占优势,进而使肿瘤细胞发生凋亡而抑制肿瘤细胞的增殖。
综上所述,SCU可以明显抑制U87细胞的生长,其机制可能是SCU通过上调bax/bcl-2比值诱导细胞凋亡从而抑制肿瘤细胞的生长,但其确切机制尚需进一步研究。
| [1] | Qi L, Ding L, Wang S, et al. A network meta-analysis:the overall and progression-free survival of glioma patients treated by different chemotherapeutic interventions combined with radiation therapy (RT)[J]. Oncotarget, 2016, 7(42): 69002–69013. |
| [2] | 齐玲, 杨阳, 刘玉翠, 等. 双氢青蒿素抑制神经母细胞瘤细胞生长的作用[J]. 吉林大学学报:医学版, 2016, 42(2): 266–270. |
| [3] | Jiang NH, Zhang GH, Zhang JJ, et al. Analysis of the transcriptome of Erigeron breviscapus uncovers putative scutellarin and chlorogenic acidsbiosynthetic genes and genetic markers[J]. PLoS One, 2014, 9(6): e100357. DOI:10.1371/journal.pone.0100357 |
| [4] | Zhu PT, Mao M, Liu ZG, et al. Scutellarin suppresses human colorectal cancer metastasis and angiogenesis by targeting ephrinb[J]. Am J Transl Res, 2017, 9(11): 5094–5104. |
| [5] | 葛志华, 张颖, 李俊玫, 等. 野黄芩苷对人舌鳞癌Tca8113细胞Bcl-2、Bax表达的影响[J]. 实用口腔医学杂志, 2014, 30(5): 649–652. |
| [6] | 王行天, 孙立新, 杨宇, 等. 野黄芩苷对人舌鳞癌细胞的增殖移植和Bcl-2蛋白表达的影响[J]. 实用口腔医学杂志, 2013, 29(1): 83–85. |
| [7] | You L, Zhu H, Wang C, et al. Scutellarin inhibits Hela cell growth and glycolysis by inhibiting the activity of pyruvate kinase M2[J]. Bioorg Med Chem Lett, 2017, 27(24): 5404–5408. DOI:10.1016/j.bmcl.2017.11.011 |
| [8] | Hou L, Chen L, Fang L. Scutellarin inhibits proliferation, invasion, and tumorigenicity in human breast cancer cells by regulating HIPPO-YAP signaling pathway[J]. Med Sci Monit, 2017, 23: 5130–5138. DOI:10.12659/MSM.904492 |
| [9] | Zhang L, Sun S, Li W, et al. Effect of Scutellarin inhibits collagen-induced arthritis through TLR4/NF-κB-mediated inflammation[J]. Mol Med Rep, 2017, 16(4): 5555–5560. DOI:10.3892/mmr.2017.7292 |
| [10] | Wesseling J, Hartog H, Horlings H, et al. Different effects of insulin-like growth factor-1 receptor expression on prognosis of estrogen receptor positive versus triple-negative invasive ductal breast carcinoma[J]. J Clin Oncol, 2009, 27(15 suppl): 3546. |
| [11] | Qi L, Bellail AC, Rossi MR, et al. Heterogeneity of primary glioblastoma cells in the expression of caspase-8 and the response to TRAIL-induced apoptosis[J]. Apoptosis, 2011, 16(11): 1150–1164. DOI:10.1007/s10495-011-0645-6 |
| [12] | 颜承, 徐冠玲, 谢梦, 等. 野黄芩苷和野黄芩素制备研究进展[J]. 中成药, 2015, 37(8): 1785–1790. |
| [13] | Han T, Li J, Xue J, et al. Scutellarin derivatives as apoptosis inducers:Design, synthesis and biological evaluation[J]. Eur J Med Chem, 2017, 135: 270–281. DOI:10.1016/j.ejmech.2017.03.020 |
| [14] | Yang N, Zhao Y, Wang Z, et al. Scutellarin suppresses growth and causes apoptosis of human colorectal cancer cells by regulating the p53 pathway[J]. Mol Med Rep, 2017, 15(2): 929–935. DOI:10.3892/mmr.2016.6081 |
| [15] | Wang W, Ma X, Han J, et al. Neuroprotective effect of scutellarin on ischemic cerebral injury by down-regulating the expression of angiotensin-converting enzyme and AT1receptor[J]. PLoS One, 2016, 11(1): e0146197. DOI:10.1371/journal.pone.0146197 |
| [16] | Niu C, Sheng Y, Yang R, et al. Scutellarin protects against the liver injury induced by diosbulbin B in mice and its mechanism[J]. J Ethnopharmacol, 2015, 164: 301–308. DOI:10.1016/j.jep.2015.02.031 |
| [17] | 郭晓菲, 高树建, 闫朝岐, 等. 野黄芩苷抑制人乳腺癌细胞系MCF-7的增殖并上调miRNA表达[J]. 现代肿瘤医学, 2016, 24(2): 197–200. |
| [18] | Qi L, Yu HQ, Li YQ, et al. Schidandrin B kills tumor cells by initiating apoptosis in glioma SHG-44 cells[J]. Chin J Integr Med, 2016. DOI:10.1007/s11655-015-2406-9 |
| [19] | Li H, Huang D, Gao Z, et al. Scutellarin inhibits the growth and invasion of human tongue squamous carcinoma through the inhibition of matrix metalloproteinase-2 and-9 and avβ6 integrin[J]. Int J Oncol, 2013, 42(5): 1674–1681. DOI:10.3892/ijo.2013.1873 |
| [20] | 邵玉, 张璐妮, 宁明杰, 等. 野黄芩苷诱导肿瘤细胞凋亡作用机制的研究进展[J]. 吉林医药学院学报, 2017, 38(4): 298–301. |
| [21] | Qi L, Bellail AC, Rossi MR, et al. Heterogeneity of primary glioblastoma cells in the expression of caspase-8 and the response to TRAIL-induced apoptosis[J]. Apoptosis, 2011, 16(11): 1150–1164. DOI:10.1007/s10495-011-0645-6 |
| [22] | 张瑞, 李成云, 苏莉, 等. 原花青素对硫酸镍染毒大鼠肝脏细胞Capase-3、Bcl-2和Bax蛋白表达的影响[J]. 工业卫生与职业病, 2013, 39(5): 276–279. |
| [23] | 王双双, 孔根现, 杨升华, 等. 骨髓间充质干细胞拮抗氧化型低密度脂蛋白致人脐静脉内皮细胞凋亡[J]. 中国动脉硬化杂志, 2013, 21(2): 105–108. |
| [24] | 刘志军, 周海存, 陈小兵, 等. 人脑胶质瘤组织中CPEB4的表达及与细胞迁移和侵袭的关系[J]. 郑州大学学报:医学版, 2016, 51(5): 622–626. |
 2018, Vol. 44
2018, Vol. 44


