扩展功能
文章信息
- 包幸福, 倪宇昕, 李莹, 郭小凯, 王玉琢, 方蛟, 胡敏
- BAO Xingfu, NI Yuxin, LI Ying, GUO Xiaokai, WANG Yuzhuo, FANG Jiao, HU Min
- Wnt5a在小鼠牙骨质发育中的表达特点及其对成牙骨质细胞分化的影响
- Expression characteristics of Wnt5a in different periods of cementum development and its effect on differentiationof cementoblasts of mice
- 吉林大学学报(医学版), 2018, 44(03): 461-465
- Journal of Jilin University (Medicine Edition), 2018, 44(03): 461-465
- 10.13481/j.1671-587x.20180301
-
文章历史
- 收稿日期: 2017-09-12
2. 吉林大学口腔医院种植科, 吉林 长春 130021
2. Department of Implantation, Stomatology Hospital, Jilin University, Changchun 130021, China
牙骨质是覆盖在牙根表面的薄层矿化组织,具有锚定牙根和保护牙髓的作用。牙骨质在牙根发育的中晚期开始形成,发育成熟后一般不进行改建[1-2]。牙骨质会在牙根受到压力或细菌影响时发生吸收,而在刺激因素消失后进行新生。牙骨质发育和再生的调控机制尚未完全清楚[3]。Wnt信号通路是一类保守的信号通路的总称,依据下游信号分子的不同而被分为Wnt经典通路和Wnt非经典通路。Wnt家族5A蛋白(Wnt5a)是Wnt非经典通路的典型激活剂,可以引起下游多种信号分子的活化并发挥调控作用[4]。研究[5]显示:Wnt5a在发育中的牙囊细胞中呈阳性表达,提示其参与了牙根和牙周组织的发育活动,但是其表达的具体特点尚不清楚。因此,本研究以牙骨质作为研究对象,探讨Wnt5a在牙根发育中的调控作用,为阐明Wnt非经典通路调控牙发育的机制提供理论依据。
1 材料与方法 1.1 动物、细胞、主要试剂和仪器24只SPF级昆明怀孕母鼠购自北京华阜康生物科技公司,动物合格证号:SCXK(京)2014-0004。成牙骨质细胞OCCM30由美国华盛顿大学Somerman教授赠送。免疫组织化学试剂盒PV9001(北京中杉金桥公司,中国),兔抗小鼠Wnt5a多克隆抗体(武汉博士德公司,中国),DAB显色试剂盒(福州迈新公司,中国),DMEM培养基和胎牛血清(Gibco公司,美国),总RNA提取试剂盒(北京天根公司,中国),反转录试剂盒及荧光实时定量试剂盒(TaKaRa公司,日本)。RT-PCR仪(MX3005P,Bio-Rad公司,美国)。
1.2 组织切片制备以孕鼠分娩时作为实验起点,选取出生后0.5、4.5、10.5、16.5、20.5、24.5、26.5和30.5d的小鼠并以此时间点进行分组,每组3只,采用颈椎脱臼法处死后分离下颌第一磨牙和牙周组织。浸泡于4%多聚甲醛溶液中过夜,流水冲洗并进行脱钙处理,方法如下:将组织块浸泡于10%乙二胺四乙酸钠中,于4℃保存1~30 d,以探针能穿透组织作为结束标准。随后进行常规组织脱水和石蜡包埋,利用切片机获得5 μm厚的组织切片。
1.3 免疫组织化学染色观察牙根发育中Wnt5a表达量按试剂盒说明书进行染色前的切片处理,二甲苯脱蜡,室温下采用酶消化液孵育10 min;磷酸盐缓冲液洗涤3次,每次2 min;3%过氧化氢室温孵育10 min,磷酸盐缓冲液洗涤3次,每次2 min。在组织块上滴加1:60稀释的Wnt5a一抗,并置于4℃冰箱中过夜,次日用磷酸盐缓冲液洗涤3次,将试剂盒中的试剂1和试剂2依次滴加到组织块上,浸泡15 min;磷酸盐缓冲液冲洗3次后,采用DAB开始显色反应,流水冲洗结束反应。采用苏木素复染并常规脱水、透明处理和树胶封片。阴性对照组中将一抗更换为PBS,其他方法一致。显微镜下观察,黄色染色者定义为阳性,无特异染色则为阴性,依据颜色深浅判断Wnt5a表达量。
1.4 成牙骨质细胞OCCM30的培养将复苏后的OCCM30细胞铺至培养瓶中,于5%CO2和37℃条件下进行培养,培养液包含DMEM培养基和10%胎牛血清,隔天换液。待细胞近75%融合时进行传代。实验前将细胞用胰酶消化成单细胞悬液,计数后调整细胞密度,按每孔6×105个密度接种至6孔板中,次日细胞贴壁后更换培养液。按处理方式分为实验组和对照组。实验组加入终浓度200 μg·L-1重组Wnt5a蛋白,对照组无添加。实验重复3次。
1.5 RT-PCR检测培养24 h后按说明书步骤提取细胞总RNA,测量RNA浓度后进行反转录获得DNA,采用RT-PCR进行检测,所用引物序列见表 1。采用2-ΔΔCt方法计算成牙骨质细胞中Ocn、Opn、Alp、Bsp、Wnt5a和Runx-2基因相对表达水平。
| Primer | Sequence(5′-3′) | |
| Ocn | Forward Reverse | TGAACAGACTCCGGCG GATACCGTAGATGCGTTTG |
| Opn | Forward Reverse | TTTACCAGCCTGCACCC CTAGCAGTGACGGTCT |
| Alp | Forward Reverse | AGGGCAATGAGG TCACATCC GCATCTCGTTATCCGAGTACCAG |
| Bsp | Forward Reverse | GAGACGGCGATAGTTCC AGTGCCGCTAACTCAA |
| Wnt5a | Forward Reverse | GGGGACATGCAGTATGAGTT GGCCTGGTAGTTGTTGTGAG |
| Runx-2 | Forward Reverse | CTTCATTCGCCTCACAAAC CTAGCAGTGACGGTCT |
| Gapdh | Forward Reverse | ACCACAGTCCATGCCATCAC TCCACCACCCTGTTGCTGTA |
采用SPSS 17.0统计软件对数据进行统计学分析。2组成牙骨质细胞中Ocn、Opn、Alp、Bsp、Wnt5a和Runx-2基因相对表达水平以x±s表示,组间比较采用配对t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 牙根发育中Wnt5a的表达特点成功地制备了不同出生时间的小鼠磨牙切片,对照组中无阳性染色。出生后0.5 d,磨牙牙胚处于钟状期,无Wnt5a阳性表达。出生后4.5d, 小鼠牙胚已经初见牙冠形态,牙釉质部分形成,成釉细胞和成牙本质细胞中可见较强的Wnt5a阳性表达,牙乳头其余部分无阳性表达,此时上皮根鞘刚刚形成。出生后10.5d, 小鼠牙釉质和冠部牙本质发育基本完成,成牙本质细胞整齐排列在牙本质内侧,Wnt5a表达量降低,上皮根鞘向根方延伸。出生后16.5d,牙根发育完成了2/3,此期牙骨质已经形成,成牙骨质细胞整齐排列在牙骨质外侧且Wnt5a呈阳性表达。出生后20.5~30.5d,牙冠不断萌出,牙根继续发育,该期间成牙骨质细胞中Wnt5a表达量较少,而牙周膜组织中Wnt5a表达量也随着牙根发育完成而降低,最终维持在一定水平,牙髓组织中始终未见阳性表达。见图 1~3(插页一)。
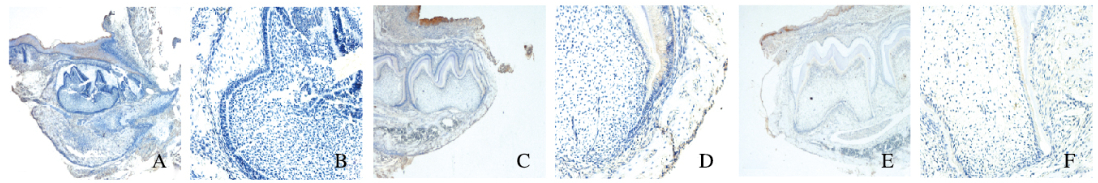
|
| A, B:0.5 d after birth; C, D:4.5 d after birth; E, F:10.5 d after birth; A, C, E:×10; B, D, F:×40. 图 1 免疫组织化学染色检测小鼠第一磨牙牙胚中Wnt5a表达(0.5-10.5 d) Figure 1 Expressions of Wnt5a in first molar tooth germ of micedetected by immunohistochemistry staining(0.5-10.5 d)(seen on page 463in paragraph) |
|
|
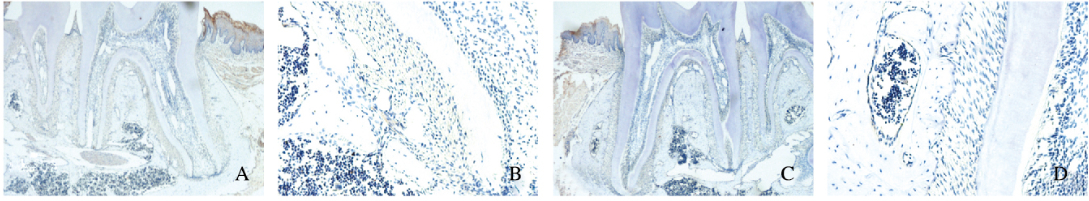
|
| A, B: 16.5 d after birth; C, D: 20.5 d after birth; E, F: 24.5 d after birth; A, C, E:×10; B, D, F:×40. 图 2 免疫组织化学染色检测小鼠第一磨牙牙胚中Wnt5a表达(16.5-24.5 d) Figure 2 Expressions of Wnt5a in first molar tooth germ of micedetected by immunohistochemistry staining(16.5-24.5 d)(seen on page 463in paragraph) |
|
|
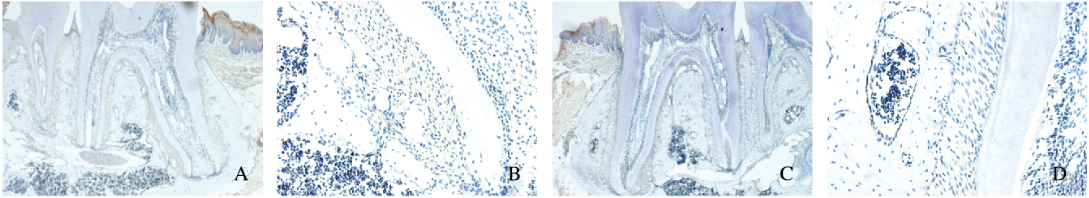
|
| A, B: 26.5 d after birth; C, D: 30.5 d after birth; A, C:×10; B, D:×40. 图 3 免疫组织化学染色检测小鼠第一磨牙牙胚中Wnt5a表达(26.5-30.5 d) Figure 3 Expressions of Wnt5a in first molar tooth germ of micedetected by immunohistochemistry staining(26.5-30.5 d)(seen on page 463in paragraph) |
|
|
与对照组比较,实验组成牙骨质细胞中Runx-2基因相对表达水平无变化;Wnt5a、Opn和Bsp相对表达水平降低,但差异无统计学意义(P>0.05);Ocn和Alp基因相对表达水平降低超过20%,差异有统计学意义(P < 0.05)。见表 2。
| (n=3, x±s) | ||||||
| Group | Ocn | Opn | Alp | Bsp | Wnt5a | Runx-2 |
| Control | 1.003±0.006 | 1.003±0.035 | 1.000±0.036 | 1.003±0.067 | 1.007±0.157 | 1.010±0.105 |
| Experiment | 0.770±0.030* | 0.907±0.005 | 0.810±0.078* | 0.940±0.061 | 0.853±0.107 | 1.000±0.099 |
| * P < 0.05 vs control group. | ||||||
牙骨质是牙根表面的类似于骨组织样的薄层矿化组织,成牙骨质细胞是形成牙骨质的主要细胞。牙骨质虽然与骨组织相似,但仍有诸多区别,如牙骨质中无血管和神经,因此一般不进行改建。当有正畸力或细菌感染时,牙骨质会在破牙细胞的作用下发生吸收[6-7];当刺激因素消失后,在牙周膜组织中的成牙骨质细胞会向缺损处迁移、黏附,继而形成新生的修复性牙骨质。牙骨质的再生对于缓解正畸牙根吸收以及牙周炎均具有重要意义。研究[8-9]显示:多种信号分子参与了牙骨质的发育和再生过程,如Bmp/Tgfβ通路、Fgf和Hh通路,但仍有诸多细节尚未研究清楚。根据是否需要β连环蛋白参与,Wnt信号通路划分为经典通路和非经典通路。研究[10]显示:Wnt经典通路参与了牙根的发育,如特异性地降低发育中的成牙本质细胞中的β连环蛋白水平,会造成牙根发育停止;而采用过表达DKK1降低Wnt经典通路水平则会造成牙根发育过短和牙本质缺陷[11],提示Wnt经典通路在牙根发育中的调控作用。Wnt5a是一种保守的蛋白,在不同类型的细胞中均可以通过不同的细胞表面受体而发挥不同作用。Wnt5a最常见的细胞表面受体是Frizzled(Fz),已知Fz3、Fz4、Fz5和Fz8均能与Wnt5a结合而激活不同的下游分子[12-14]。另一种重要的受体是Ror受体,包括Ror1和Ror2,介导不同的调控作用[15-17]。关于Wnt非经典通路在牙骨质稳态中作用的报道较少,因而本研究通过动物和细胞实验,探讨Wnt5a在牙骨质发育和分化中的作用,为揭示Wnt非经典通路对牙骨质调控机制提供依据。
本研究中出生后0.5 d时小鼠磨牙中Wnt5a无阳性表达;随着牙釉质开始发育,成釉细胞中开始出现Wnt5a强阳性表达,并在牙冠发育完成后其表达量降低,直到牙冠萌出,提示Wnt5a参与了小鼠出生后牙釉质的发育调控。研究[18]显示:牙乳头中有Wnt5a表达,并抑制牙乳头细胞的增殖和迁移。本研究中位于牙乳头外层的成牙本质细胞中出生后4.5d时Wnt5a呈阳性表达,其阳性表达持续至牙本质发育完成,在出生后30.5d时小鼠牙本质发育完成后仍维持一定的表达量;而牙乳头的内侧,即牙髓组织中始终未见明显的Wnt5a阳性表达,牙乳头中的表达量差异提示Wnt5a调控作用可能具有细胞选择性。
出生后4.5d时上皮根鞘形成,标志着牙根和牙周组织的发育即将开始。在已经形成的根部牙本质外侧,整齐地排列着成牙骨质细胞。直到牙根发育完成,成牙骨质细胞和牙周膜细胞中Wnt5a均呈阳性表达,提示Wnt5a在牙囊向牙周组织的分化中起调控作用,这与之前的研究[19]结果相近,而在发育完成后的牙周膜细胞中仍有一定量的Wnt5a表达,因此推测Wnt5a可能在牙周组织稳态的维持中发挥作用。
为了进一步分析Wnt5a在牙骨质发育中的作用,本研究培养了小鼠成牙骨质细胞细胞系,并在体外分化的培养液中加入了200 μg·L-1重组Wnt5a蛋白,分析有关基因相对表达水平的变化。Runx-2是调控成牙骨质细胞分化最重要的一个基因[20],Wnt5a并未影响其表达水平。本研究中实验组细胞Wnt5a基因表达水平降低,说明Wnt5a可能具有自身负反馈调节作用,外源性Wnt5a蛋白表达水平升高时会下调成牙骨质细胞的自身表达水平。Ocn、Opn和Bsp均是成牙骨质细胞中与钙离子代谢有关的基因,本研究中三者的表达水平均不同程度降低,提示Wnt5a可能主要通过影响钙离子沉积和羟基磷灰石晶体形成发挥调控作用。另一个关键指标碱性磷酸酶(ALP)水平的变化也很明显,重组Wnt5a蛋白降低了ALP的表达水平。研究[19]显示:外源性Wnt5a蛋白可抑制牙囊向成牙骨质细胞的分化。本研究结果表明:Wnt5a对成牙骨质细胞分化可能无明显作用,而主要通过影响矿化物生产发挥调控作用。
综上所述,Wnt5a在小鼠磨牙牙骨质、牙釉质和牙本质的不同发育阶段具有独特的表达特点,其可能对牙体和牙周硬组织的发育起调控作用,而对成牙骨质细胞的调控可能是通过影响钙离子沉积和羟基磷灰石形成而实现的。
| [1] | Foster BL. On the discovery of cementum[J]. J Periodont Res, 2017, 52(4): 666–685. DOI:10.1111/jre.2017.52.issue-4 |
| [2] | Yamamoto T, Hasegawa T, Yamamoto T, et al. Histology of human cementum:Its structure, function, and development[J]. Jpn Dent Sci Rev, 2016, 52(3): 63–74. DOI:10.1016/j.jdsr.2016.04.002 |
| [3] | Li J, Parada C, Chai Y. Cellular and molecular mechanisms of tooth root development[J]. Development, 2017, 144(3): 374–384. DOI:10.1242/dev.137216 |
| [4] | Tamura M, Nemoto E. Role of the Wnt signaling molecules in the tooth[J]. Jpn Dent Sci Rev, 2016, 52(4): 75–83. DOI:10.1016/j.jdsr.2016.04.001 |
| [5] | Peng L, Ye L, Dong G, et al. WNT5A inhibits human dental papilla cell proliferation and migration[J]. Biochem Biophys Res Commun, 2009, 390(3): 1072–1078. DOI:10.1016/j.bbrc.2009.10.136 |
| [6] | Iglesias-Linares A, Hartsfield JK Jr. Cellular and molecular pathways leading to external root resorption[J]. J Dent Res, 2017, 96(2): 145–152. DOI:10.1177/0022034516677539 |
| [7] | Kinane DF, Stathopoulou PG, Papapanou PN. Periodontal diseases[J]. Nat Rev Dis Primers, 2017, 3: 17038. DOI:10.1038/nrdp.2017.38 |
| [8] | Li J, Feng J, Liu Y, et al. BMP-SHH signaling network controls epithelial stem cell fate via regulation of its niche in the developing tooth[J]. Dev Cell, 2015, 33(2): 125–135. DOI:10.1016/j.devcel.2015.02.021 |
| [9] | Liu Y, Feng J, Li J, et al. An Nfic-hedgehog signaling cascade regulates tooth root development[J]. Development, 2015, 142(19): 3374–3382. DOI:10.1242/dev.127068 |
| [10] | Kim TH, Bae CH, Lee JC, et al. β-catenin is required in odontoblasts for tooth root formation[J]. J Dent Res, 2013, 92(3): 215–221. DOI:10.1177/0022034512470137 |
| [11] | Han X L, Liu M, Voisey A, et al. Post-natal effect of overexpressed DKK1 on mandibular molar formation[J]. J Dent Res, 2011, 90(11): 1312–1317. DOI:10.1177/0022034511421926 |
| [12] | Kumawat K, Gosens R. WNT-5A signaling and functions in health and disease[J]. Cell Mol Life Sci, 2016, 73(3): 567–587. DOI:10.1007/s00018-015-2076-y |
| [13] | Zhou Y, Kipps TJ, Zhang S. Wnt5a signaling in normal and cancer stem cells[J]. Stem Cells Int, 2017: 5295286. |
| [14] | Gibson JD, O'Sullivan MB, Alaee F, et al. Regeneration of articular cartilage by human esc-derived mesenchymal progenitors treated sequentially with BMP-2 and Wnt5a[J]. Stem Cells Transl Med, 2017, 6(1): 40–50. DOI:10.5966/sctm.2016-0020 |
| [15] | Kobayashi Y, Uehara S, Udagawa N, et al. Regulation of bone metabolism by Wnt signals[J]. J Biochem, 2016, 159(4): 387–392. DOI:10.1093/jb/mvv124 |
| [16] | Maeda K, Kobayashi Y, Udagawa N, et al. Wnt5a-Ror2 signaling between osteoblast-lineage cells and osteoclast precursors enhances osteoclastogenesis[J]. Nat Med, 2012, 18(3): 405–412. DOI:10.1038/nm.2653 |
| [17] | Stricker S, Rauschenberger V, Schambony A. ROR-family receptor tyrosine kinases[J]. Curr Top Dev Biol, 2017, 123: 105–142. DOI:10.1016/bs.ctdb.2016.09.003 |
| [18] | Peng L, Ye L, Dong G, et al. WNT5A inhibits human dental papilla cell proliferation and migration[J]. Biochem Biophys Res Commun, 2009, 390(3): 1072–1078. DOI:10.1016/j.bbrc.2009.10.136 |
| [19] | Sakisaka Y, Tsuchiya M, Nakamura T, et al. Wnt5a attenuates Wnt3a-induced alkaline phosphatase expression in dental follicle cells[J]. Exp Cell Res, 2015, 336(1): 85–93. DOI:10.1016/j.yexcr.2015.06.013 |
| [20] | Wang YL, He H, Liu ZJ, et al. Effects of TNF-α on cementoblast differentiation, mineralization, and apoptosis[J]. J Dent Res, 2015, 94(9): 1225–1232. DOI:10.1177/0022034515590349 |
 2018, Vol. 44
2018, Vol. 44


