扩展功能
文章信息
- 宋效庆, 刘红, 陈天杰, 刘称称, 路政宽, 秦爽, 黄山
- SONG Xiaoqing, LIU Hong, CHEN Tianjie, LIU Chenchen, LU Zhengkuan, QIN Shuang, HUANG Shan
- 淫羊藿苷/载明胶纳米复合物-PLGA缓释系统的制备及工艺优化
- Preparation of icariin/gelatin nanocomposite-PLGA sustained release system and its optimization of technology
- 吉林大学学报(医学版), 2018, 44(02): 438-443
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 438-443
- 10.13481/j.1671-587x.20180244
-
文章历史
- 收稿日期: 2017-08-06
先天畸形、外伤、感染及手术所导致的骨缺损患者日益增多,且临床修复难度较大,对患者的身心健康构成了严重威胁,已经成为极其严重的公共健康问题[1]。近年来,中医药治疗骨缺损方面显示出巨大优势,尤其是单味中药有效成分具有选择性高、针对性强的特点。在众多中药提取的有效成分的对比研究中,淫羊藿苷(icariin, ICA)具有显著的成骨效能,被认为是最具潜力的促进骨修复的天然药物之一[2-3]。
但ICA较低的生物利用率和短的半衰期限制了其临床应用。将ICA载入缓释体系,提高其生物利用率是目前较为热门的研究课题[4]。聚合物载体系统可以保护药物免于降解,并在药物释放的靶点提供一个预先设计的方式给药,获得更好的疗效,同时排除了过高和过低给药的可能。明胶是一种从胶原中提取的水溶性大分子链,明胶本身具有大量的氨基和羧基,并且可以通过pH值的调节改变其表面电势[5],是一种良好的载体和保护剂,明胶纳米微球用于载药研究已近三十年,并首先应用于小相对分子质量药物的载体[6]。聚乳酸-羟基乙酸共聚物[ poly(lactic-co-glycolic acid, PLGA]是一种高分子聚合物,是被美国食品药品管理局(Food and Drug Administration,FDA)认证的生物载体材料,其具有良好的生物相容性和可降解性。纳米-微球系统是新型的载药体系,在体内、体外实验中均取得了较为理想的结果。目前,已有学者[7-9]将PLGA、脂质体和壳聚糖包封于PLGA微球中,形成复合载药体系,但尚未见有关明胶PLGA复合微球载药系统的相关报道。本研究利用S/O/W法[10]制备一种新型缓释系统。这种方法是基于制备出具有吸附作用的明胶纳米粒(gelatin nanoparticles, GNPs)[11],ICA通过氢键结合于纳米粒的表面,形成无特定相对分子质量的纳米复合物,纳米复合物可以与可降解的控释聚合物兼容,容易被PLGA聚合物包封。本研究对载体系统的设计、物理化学特性和释放特点进行检测, 并优化制备工艺。
1 材料与方法 1.1 主要试剂和仪器PLGA(50:50 PLGA, 相对分子质量为30000~60000)、聚乙烯醇(PVA)和A型明胶(美国Sigma公司); 二氯甲烷(CH2Cl2)和分析纯(中国北京化工厂);丙酮、无水乙醇和50%戊二醛(中国天津市广成试剂有限公司,均为分析纯)。荧光倒置显微镜和光学显微镜(日本Olympus公司),CO2恒温细胞培养箱(日本SANYO公司),台式高速离心机(德国Eppendorf公司),JB-2型恒温磁力搅拌器(中国上海雷磁新泾仪器有限公司),KQ-100DA型超声仪(中国昆山市超声仪器有限公司),高效液相色谱仪(美国Agilent公司),扫描电子显微镜(SEM)(日本Hitachi公司),纳米粒度点位分析仪(美国Zeta PALS公司),普通台式离心机(中国上海安亭离心机械厂),JB-2型恒温磁力搅拌器(中国上海雷磁新泾仪器有限公司)
1.2 ICA纳米复合物的制备GNPs的制备使用二步去溶剂法[11-12]。取500 mg明胶加入到10 mL去离子水中,加热溶解制成明胶水溶液;再向明胶水溶液中加入10 mL丙酮,获得沉淀的明胶200~300 mg,然后用10 mL去离子水再次溶解,得到明胶水溶液,并将溶液的pH值调整为2.5~4.0;在500~1000 r·min-1磁力搅拌下将30~40 mL丙酮逐滴加入得到的明胶水溶液中,使体系乳化,然后立即向上述体系中加入40 μL、质量分数为50%的戊二醛水溶液,40℃继续搅拌1 h,再将乳液室温静置8h使GNPs固化,得到GNPs悬浮液, 置于4℃冰箱冷藏;取2 mL上述溶液,去离子水清洗沉淀3~5次,向最后所得的沉淀中加入1 mL去离子水,得到6 g·L-1GNPs保存液,再加入1 g·L-1ICA的甲醇储备液1 mL,然后于恒温箱25℃内共混24h,将得到的乳液离心,去上清,加入0.5mL的去离子水溶液,超声5~10 min, 得到吸附ICA的GNPs混悬液。
1.3 ICA@GNPs-PLGA复合微球的制备将得到的吸附ICA的GNPs混悬液加入到1.5mL PLGA(质量分数为0.25%~2.00%)的CH2Cl2溶液中,超声5~10 min,形成S/O混合相;形成的S/O混合相中缓慢滴入15~20 mL、质量分数为2%的聚乙烯醇(PVA)水溶液,滴加的速度为1~2 mL·min-1,然后于1 000~2 000 r·min-1下搅拌4 h,5 000 r·min-1离心,离心产物用去离子水洗涤3~4次,冻干,最后于4℃冰箱冷藏,从而得到所述的载ICA的PLGA-明胶复合微球。
1.4 GNPs和ICA@GNPs-PLGA微球表征的观测GNPs的尺寸和形貌利用SEM观测,去离子水洗涤3次,离心15 min后浓缩,样品冻干,得到GNPs粉末,置于硅片上,真空下喷金2 nm。PLGA的尺寸和形貌利用SEM观测,方法同上。使用Nano measurer 1.2软件计算粒径分布范围。
1.5 ICA标准曲线的绘制色谱条件及样品制备:高效液相色谱法(high performance liquid chromatography,HPLC)检测方法为内标法[13]。色谱柱:Zorbax SB-C18 HPLC column (5 μm, 4.6, 150 mm);流动相:-55%A+45%D (A: H2O+0.2% H3PO4, D:甲醇);检测波长:270 nm;流速:1.0 mL·min-1;柱温:30.0℃;进样量:10μL。将ICA明胶纳米复合物的水溶液恒温震荡分散2h后,取500μL溶液,10000 r·min-1离心5min后,再用微孔滤膜滤过,得样品溶液。标准曲线的制作:精确量取ICA甲醇溶液对照样品溶液1.0 mL,加水稀释成浓度分别为1、3、7、10、30、50和70 mg·L-1的水溶液,依次取10 μL注入高效液相色谱仪内,按上述色谱条件测定色谱峰面积,以样品浓度(mg·L-1)为横坐标,峰面积为纵坐标,得到回归方程。
1.6 纳米粒复合物中ICA吸附量的检测将0.5 mL纳米复合物储备液加入去离子水,补液至10 mL,超声5 min,离心,测量上清液中ICA的浓度,后收集GNPs再次分散,重复2次,采用HPLC测试染料木素的含量,将3次结果相加得到染料木素的含量。HPLC检测条件同上。按以下公式计算吸附率:吸附率=[N1(上清液药物含量)+ N2(上清液药物含量)+ N3(上清液药物含量)]/初始投入量×100%(N为离心的次数)。
1.7 药物体外释放规律和载药量观察检测所用微球制备条件同表 1中微球7。称取10 mg制备的复合微球分为3份,置于装有40mL PBS的试管中。在37℃条件下,将试管放入恒温摇床中震荡,转速为100 r·min-1,随着明胶的溶胀,ICA逐渐被释放出来,每隔一段时间取缓释液500μL,并同时补充500 μL生理盐水到释放体系中,HPLC条件同上。按以下公式计包封率(entrapment efficiency,EE):EE=(微球中药物含量/初始投药量)×100%;按以下公式计算载药量(drug loading, DL):DL=(微球中药物含量/微球总质量)×100%。
2 结果 2.1 GNPs和载药微球的形态冷冻干燥后的GNPs外观呈白色或淡黄色,大小均一,微球的粒径为150~200nm。冷冻干燥后得到的载药微球为白色粉末状,在室温下放置稳定,分散性良好。SEM观察:载药微球的球形度较好、表面光滑、分散性良好,微球的粒径为4~12μm。见图 1。

|
| 图 1 GNPs(A)和载药微球(B)的表面形貌 Figure 1 Surface morphology of GNPs (A) and microspheres(B) |
|
|
采用HPLC对不同浓度的ICA进行吸光度(A)值的测定,得到其线性回归方程为:y=22 170x+51.092, R2=0.987 8。
2.3 ICA@GNPs-PLGA复合微球的优化当PLGA与明胶的质量比为5:2时,形成的复合微球的比例达到100%;当PLGA与明胶的质量比超过5:2时,复合微球的制备过程中出现大量的明胶碎片。复合微球的形貌特征由核心球的大小、PLGA与明胶的质量比和转速决定。转速为2000r·min-1时,复合微球的均一性优于1000 r·min-1,转速超过2000 r·min-1时,制备出的复合微球乳液中出现大量的明胶团块状沉淀,完全复合微球形成比例也明显下降。见表 1。
| Group | PLGA concentration[wB/(g·mL-1)] | GNPs quality(m/mg) | PLGA polymer:GNPs | Full encapsulated GNPs(Yes/No) |
| 1 | 0.25 | 12 | 5:16 | No |
| 2 | 0.50 | 12 | 5:8 | No |
| 3 | 1.00 | 12 | 5:4 | No |
| 4 | 2.00 | 12 | 5:2 | Yes |
| 5 | 0.25 | 6 | 5:8 | No |
| 6 | 0.50 | 6 | 5:4 | No |
| 7 | 1.00 | 6 | 5:2 | Yes |
| 8 | 2.00 | 6 | 5:1 | Yes |
| 9 | 0.25 | 3 | 5:4 | No |
| 10 | 0.50 | 3 | 5:2 | Yes |
| 11 | 1.00 | 3 | 5:1 | Yes |
| 12 | 2.00 | 3 | 10:1 | Yes |
当温度超过25℃、时间超过24 h、GNPs的浓度超过6 g·L-1时,GNPs对ICA的吸附量超过90%;当温度超过33℃时,GNPs对ICA的吸附量下降至77%;继续升高温度达到37℃时,明胶对ICA的吸附量低于65%。
2.5 ICA@GNPs-PLGA复合微球EE和DLPLGA微球的载药量取决于GNPs对药物的吸附量,在复合微球可以完全包封GNPs的范围内,复合微球的DL与明胶对药物的吸附能力呈正相关关系(P < 0.05)。同时ICA投入量与PLGA的EE呈负相关关系(P < 0.05)。见图 2。ICA@GNPs-PLGA微球的EE高于(62.00±1.25)%。核壳比为5:2时,复合微球的DL最高,约为13.7%,当超过一比例和低于这一比例复合微球的DL均会下降。

|
| CM:Total content of drug in microsphere; C∑-C:Adsorbing capacity of drug in GNPs; I:ICA. 图 2 ICA的EE和ICA投入量的关系 Figure 2 Relationship between EE of ICA and quality of ICA added |
|
|
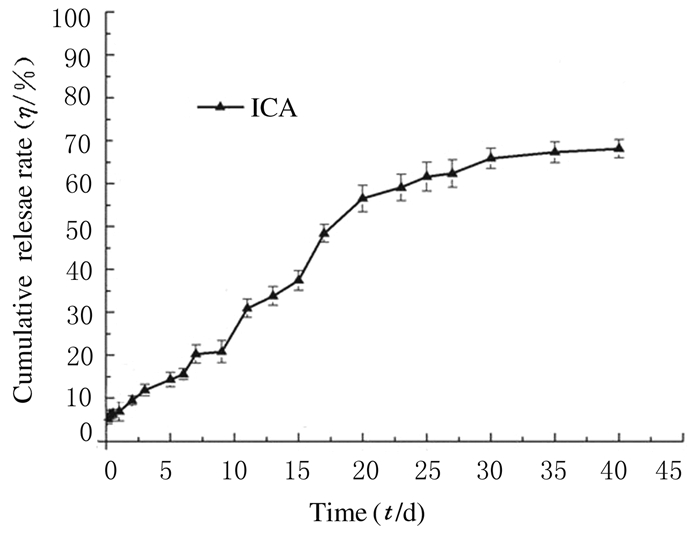
PLGA微球的释放从2 h到40 d, 累积释放率为65.21%。释放特征显示出较小的突释, 24h内微球累积释放率低于5.47%, 由于药物的溶解和分散于微球的表面,随后药物的持续释放周期超过25d。见图 3。
|
| 图 3 ICA@GNPs-PLGA复合微球体外释放曲线 Figure 3 Release curve of ICA@GNPs-PLGA composite microspheres in vitro |
|
|
目前,治疗缺损的药物主要有基础性用药、骨吸收抑制剂、骨形成促进剂和混合制剂四类, 虽然二膦酸盐和降钙素等药物在治疗骨缺损方面经临床证实疗效显著,但其昂贵的价格和可能引起的一系列并发症限制了其临床应用[14]。ICA是从淫羊藿中提取出来的一种异戊烯基黄酮醇苷,具有亲水特性,大量研究[15-17]表明:ICA通过骨形态发生蛋白(bone morphogenetic proteins, BMPs)通路、Wnt-β-Catenin通路、MAPK通路和Runx2、Osterix 2个蛋白节点调控间充质干细胞向成骨方向分化。传统中医认为ICA具有强筋健骨,补肾助阳的作用,取材方便且价格低廉。动物实验结果显示:ICA的药理活性浓度为1×10-8~1×10-5mol·L-1, 总体来看, 1×10-8~1× 10-5 mol·L-1应该是ICA发挥其最佳药理活性可能出现的区间,当浓度超过这一区间,ICA组破骨细胞凋亡率均明显升高, 骨吸收陷窝数目、面积明显减少,其抑制作用随浓度增加而增强。故ICA的浓度和作用时间对于骨修复至关重要。工艺优化的主要考察指标是EE,制备完全包封ICA的纳米复合物的缓释微球是提高EE的关键。此外,复合微球的制备使用S/O/W溶剂蒸发法,不同于W/O/W蒸发法,S/O/W溶剂蒸发技术制备的微球显示出相对较高的EE,这种技术已经成功地用于制备出包封多种药物复合微球[18]。考虑到ICA为针状晶体粉末及其在水溶液和有机溶剂中的有限溶解度,本实验首先将ICA吸附于GNPs表面,然后使用S/O/W溶剂蒸发技术制备微球。PLGA的类型是其成球性最重要的影响因素[19],出于最佳的成球性、EE与释放特征,本实验选用50:50的PLGA。
复合微球的制备实验以PLGA的浓度、PLGA和明胶的质量比以及GNPs的投入量为自变量,以微球的粒径和是否完全包封为因变量。PLGA的浓度设定为0.25%、0.50%、1.00%和2.00%,明胶的添加质量为12、6和3mg,为提高药物的EE,保证GNPs的形态不被破坏,转速设定为2000 r·min-1以下,当GNPs的质量为6mg时,PLGA在DCM中的临界浓度为0.5% ~1.0%;当GNPs的质量上升至12 mg时,PLGA在DCM中的临界浓度升至1.0%~2.0%。当PLGA的浓度低于0.25%时,无完全包封的复合微球形成。同时,ICA的投入量和微球DL呈反比。搅拌速率和PVA的浓度未显示出对DL的影响,所得到的数据差异可以被归类于实验的操作误差。本实验释放检测结果显示:在临界范围内制备的缓释微球,不仅可以提高ICA的DL,同时大幅提高其载药量,克服了PLGA微球降解初期的突释现象,长时间维持药物的有效浓度,间接降低了不良反应,为骨缺损的表面改性涂层提供了一个全新的思路。
综上所述,本研究在优化条件下制备了DL较高、粒径较为均一的ICA@GNPs-PLGA微球,且经过重复性实验验证后,证明该缓释体系形态良好、粒径分布范围较窄、可重复性好;同时在体外实验中这种复合微球克服了前期突释,释放时间超过40d,本实验对缓释体系的理性性质进了评价。未来本文作者将利用细胞学、分子生物学及动物实验全面、系统地评价缓释体系的生物活性及其临床应用的可行性。
| [1] | Bai X, Lü SY, Liu HD, et al. Polysaccharides based injectable hydrogel compositing bio-glass for cranial bone repair[J]. Carbohydr Polym, 2017, 175: 557–564. DOI:10.1016/j.carbpol.2017.08.020 |
| [2] | Zhang X, Liu T, Huang Y, et al. Icariin:does it have an osteoinductive potential for bone tissue engineering?[J]. Phytother Res, 2014, 28(4): 498–509. DOI:10.1002/ptr.v28.4 |
| [3] | Wang Z, Wang D, Yang D, et al. The effect of icariin on bone metabolism and its potential clinical application[J]. Osteoporos Int, 2018, 29(3): 535–544. DOI:10.1007/s00198-017-4255-1 |
| [4] | Wang QS, Wang GF, Zhou J, et al. Colon targeted oral drug delivery system based on chitosan/alginate microspheres loaded with icariin in the treatment of ulcerative colitis[J]. Int J Pharm, 2016, 515(1/2): 176–185. |
| [5] | Joshi N, Rawat K, Bohidar HB. pH and ionic strength induced complex coacervation of Pectin and Gelatin A[J]. Food Hydrocolloids, 2018, 74(1): 132–138. |
| [6] | Elzoghby AO. Gelatin-based nanoparticles as drug and gene delivery systems:reviewing three decades of research[J]. J Control Release, 2013, 172(3): 1075–1091. DOI:10.1016/j.jconrel.2013.09.019 |
| [7] | Gaspar VM, Moreira AF, Costa EC, et al. Gas-generating TPGS-PLGA microspheres loaded with nanoparticles (NIMPS) for co-delivery of minicircle DNA and anti-tumoral drugs[J]. Colloids Surface Biointerfaces, 2015, 134: 287–294. DOI:10.1016/j.colsurfb.2015.07.004 |
| [8] | Chen Z, Liu D, Wang J, Wu L, et al. Development of nanoparticles-in-microparticles system for improved local retention after intra-articular injection[J]. Drug Deliv, 2014, 21(5): 342–350. DOI:10.3109/10717544.2013.848495 |
| [9] | Utzinger M, Jarzebinska A, Haag N, et al. cmRNA/lipoplex encapsulation in PLGA microspheres enables transfection via calcium phosphate cement (CPC)/PLGA composites[J]. J Control Release, 2017, 249: 143–149. DOI:10.1016/j.jconrel.2017.01.045 |
| [10] | Jiang Y, Wang F, Xu H, et al. Development of andrographolide loaded PLGA microspheres:optimization, characterization and in vitro-in vivo correlation[J]. Int J Pharmaceut, 2014, 475(1/2): 475–484. |
| [11] | Shutava TG, Balkundi SS, Vangala P, et al. Layer-by-layer-coated gelatin nanoparticles as a vehicle for delivery of natural polyphenols[J]. ACS Nano, 2009, 3(7): 1877–1885. DOI:10.1021/nn900451a |
| [12] | Geh KJ, Hubert M, Winter G. Optimization of one-step desolvation and scale-up of gelatin nanoparticle production[J]. J Microencapsul, 2016, 33(7): 595–604. DOI:10.1080/02652048.2016.1228706 |
| [13] | Woollard DC, Bensch A, Indyk CH, et al. Determination of vitamin A and vitamin E esters in infant formulae and fortified milk powders by HPLC:Use of internal standardisation[J]. Food Chem, 2017, 33(A): 457–465. |
| [14] | Tella SH, Gallagher JC. Prevention and treatment of postmenopausal osteoporosis[J]. J Steroid Biochem Mol Biol, 2014, 142: 155–170. DOI:10.1016/j.jsbmb.2013.09.008 |
| [15] | Wang RN, Green J, Wang ZL, et al. Bone morphogenetic protein (BMP) signaling in development and human diseases[J]. Genes Dis, 2014, 1(1): 87–105. DOI:10.1016/j.gendis.2014.07.005 |
| [16] | Wei QS, Zhang J, Hong GJ, et al. Icariin promotes osteogenic differentiation of rat bone marrow stromal cells by activating the ERα-Wnt/β-catenin signaling pathway[J]. Biomed Pharmacother, 2016, 84: 931–939. DOI:10.1016/j.biopha.2016.09.107 |
| [17] | Sabio G, Davis RJ. TNF and MAP kinase signalling pathways[J]. Semin Immunol, 2014, 26(3): 237–245. DOI:10.1016/j.smim.2014.02.009 |
| [18] | Liu LB, Zhang YQ, Guo SR. Preparation and in vitro release behavior of 5-fluorouracil loaded sustained release microspheres by S/O/W method[J]. Chin Pharm J, 2009, 4: 205–208. |
| [19] | Mao S, Guo C, Shi Y, et al. Recent advances in polymeric microspheres for parenteral drug delivery-part 1[J]. Expert Opin Drug Deliv, 2012, 9(9): 1161–1176. DOI:10.1517/17425247.2012.709844 |
 2018, Vol. 44
2018, Vol. 44


