扩展功能
文章信息
- 白世琦, 王育波, 耿任, 李蕴潜
- BAI Shiqi, WANG Yubo, GENG Ren, LI Yunqian
- 颅内多中心少突星形细胞瘤1例报告及文献复习
- Intracranial multicentric astrocytoma: A case report and literature review
- 吉林大学学报(医学版), 2018, 44(02): 408-411
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 408-411
- 10.13481/j.1671-587x.20180238
-
文章历史
- 收稿日期: 2017-07-28
多中心脑胶质瘤(muhicentric glioma)是指同时或先后在不同脑叶或半球出现的2个及以上发生的胶质瘤病灶,且病灶间无法用已知的播散或转移途径(包括联合纤维、脑脊液、室管膜、血管和临近的卫星灶等)来解释的多发性胶质瘤,但可以用已知的播散转移途径解释的多发胶质瘤被称为多局灶胶质瘤(multifoeal glioma)[1]。少突星形细胞瘤是一种混合性胶质瘤[2],颅内多中心少突星形细胞瘤十分罕见[3]。本文作者报道1例颅内多中心少突星形细胞瘤患者的临床资料,并进行文献复习,旨在提高对本病诊治的认识。
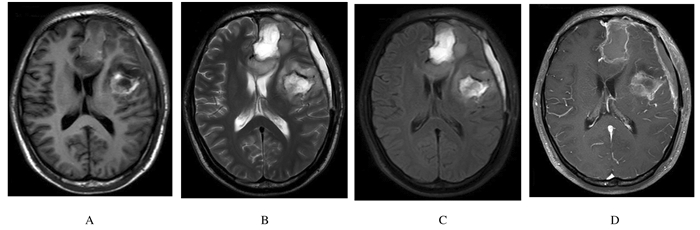
1 临床资料 1.1 病例资料患者,男性,25岁,因“18d前突发抽搐1次”入院。既往身体健康,否认高血压、糖尿病及家族疾病史。神经系统查体未见明显阳性体征。头部磁共振成像(MRI)平扫加增强显示:左侧额叶和胼胝体膝部见团片状混杂异常信号,T1WI呈稍高、稍低及低信号,T2WI呈等及高信号,FLAIR呈高及低信号,大小为5.3 cm×6.4 cm×7.0 cm,DWI呈稍高及低信号,增强扫描明显不均匀强化。左侧额颞叶见囊片状混杂信号影,T1WI呈低信号,T2WI呈不均匀稍高及高信号,FLAIR呈高及低信号,大小为5.0 cm×5.7 cm×6.4 cm,DWI呈低信号,增强扫描未见强化,其内可见血管影通过。双侧脑室前角受压变窄,左侧脑室变窄,中线结构略右移(图 1)。根据病史及辅助检查初步诊断为:左侧额叶和胼胝体膝部占位性病变;左侧额颞叶占位性病变。

|
| A:T1WI; B:T2WI; C:FLAIR; D:Enhanced scanning. 图 1 患者术前头部MRI Figure 1 Head MRI of patient before operation |
|
|
完成术前准备后,行幕上开颅肿瘤切除术,手术采取左侧额颞部切口,首先切除左侧额叶和胼胝体膝部病变,术中见病变与大脑镰及静脉窦关系密切,病变为囊性及实性混合组织,实性组织占大部分,内部可见钙化,仔细分离病变与周围脑组织后将病灶切除。然后切除左侧额颞叶病变,术中见该病变为囊性及实性混合组织,囊性组织占大部分,将病灶切除。将切除的肿瘤组织进行病理学检查。术后患者出现不完全混合性失语,经过对症治疗后逐渐好转。术后头部CT检查显示颅内两处病灶已被切除,中线偏移情况好转。患者恢复良好,出院时建议继续行放疗和化疗。
1.3 病理结果和诊断肿瘤组织病理学检查结果:左侧额叶和胼胝体病变局部的细胞密度增高,细胞异型相对明显。免疫组织化学结果:Ki-67(+5%),P53(+ < 5%),GFAP(-),诊断为少突星形细胞瘤(WHOⅡ-Ⅲ级)。左侧额颞叶肿瘤的组织学表现同上,免疫组织化学结果:Ki-67(+3%),P53(+70%),GFAP(+),诊断为少突星形细胞瘤(WHOⅡ级)。见图 2(插页七)。
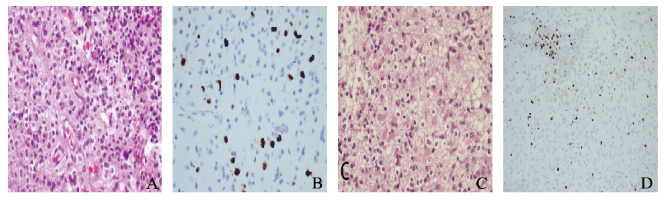
|
| A:HE staining of left frontal and corpus callosum knee lesion, ×400;B:Ki-67 staining of left frontal and corpus callosum knee lesion(+5%), ×400;C:HE staining of left frontal temporal lobe lesion, ×400;D:Ki-67 staining of left frontal temporal lobe lesion(+3%), ×400. 图 2 患者术后肿瘤组织病理形态表现 Figure 2 Pathomorphology of tumor tissue of patient after operation |
|
|
术后1个月复查头部MRI平扫加增强显示:左侧额叶和胼胝体膝部及左侧额颞叶病灶大部分切除,中线结构偏移情况好转。见图 3。
|
| A:T1WI; B:T2WI; C:FLAIR; D:Enhanced scanning. 图 3 患者术后1个月头部MRI Figure 3 Head MRI of patient one month after operation |
|
|
颅内多发胶质瘤发病率较低,在颅内胶质瘤中所占比例为0.5%~20.0%[4], 但各研究[5-7]报道结果不尽相同。研究[3]显示:大部分颅内多中心胶质瘤至少一处为胶质母细胞瘤,而本文作者报道的病例两处病变均为少突星形细胞瘤非常罕见。
Batzdorf等[1]曾提出将颅内多发胶质瘤分为多中心胶质瘤和多灶性胶质瘤,多灶性胶质瘤是指可以用纤维束、脑脊液等已知播散转移途径解释的颅内多发胶质瘤,而多中心胶质瘤间无连接通道,不能用已知播散转移途径解释。但有时多发胶质瘤之间的联系可能是微观的,宏观并不一定可见[8],因此有时无法明确区分多中心胶质瘤与多灶性胶质瘤。近年来,Thomas等[9]提出如果两处病变之间存在传播途径,在MRI FLAIR序列上会显示出沿着传播途径的异常水肿区域。本文作者报道病例的MRI FLAIR信号上并未发现2个病灶之间有水肿区域相连接,而且两处病灶免疫组织化学染色结果有明显的不同,故可以认定本例为多中心少突星形细胞瘤。胶质瘤作为一种恶性肿瘤,其侵袭性较高,容易发生颅内扩散,且有些肿瘤扩散途径是微观的,宏观不可见的,这给多中心胶质瘤的诊断带来了困难。掌握颅内多处病灶间影像学上有无联系(尤其是MRI FLAIR序列)及多处病灶间形态学和病理结果之间的差异,有助于明确是否为多中心胶质瘤。
目前有关多中心胶质瘤的发病机制有多种假说[5, 10-11],其中Wills[10]提出的“两步过程”假说被多数学者所认可,但越来越多的学者认为多中心胶质瘤的发病与胶质瘤细胞的长距离迁移及能力有关[12]。关于多中心少突星形细胞瘤的治疗,大部分学者[6, 13]认为积极手术治疗对延长患者的生存期有利。对于术后是否进行放疗仍存在争议,因其对总生存期的影响无显著意义[14],而且放疗会加重高颅压[15-17],因此对于多中心胶质瘤术后是否进行放疗及放疗的时机应综合考虑。化疗作为一种比较安全且有效的治疗方法,应该被推荐。多中心胶质瘤尤其是多中心少突星形细胞瘤作为一种罕见的疾病,还有很多值得探索的地方。随着更多的病例报道的出现及相关技术的发展,会更清楚地了解其发生机制并做出早期诊断,更全面地了解多中心胶质瘤的进展过程,为患者制订更加完善的治疗方案,从而改善其预后并延长患者的生存期。
| [1] | Batzdorf U, Malamud N. The problem of multicentric gliomas[J]. J Neurosurg, 1963, 20: 122–136. DOI:10.3171/jns.1963.20.2.0122 |
| [2] | Surawicz TS, McCarthy BJ, Kupelian V, et al. Descriptive epidemiology of primary brain and CNS tumors:results from the Central Brain Tumor Registry of the United States, 1990-1994[J]. Neurol Oncol, 1999, 1(1): 14–25. DOI:10.1093/neuonc/1.1.14 |
| [3] | Inoue A, Ohnishi T, Kohno S, et al. A case of multicentric gliomas in both supra-and infratentorial regions with different histology:a case report[J]. World J Surg Oncol, 2016, 14(1): 152. DOI:10.1186/s12957-016-0907-4 |
| [4] | Showalter TN, Andrel J, Andrews DW, et al. Multifocal glioblastoma multiforme:prognostic factors and patterns of progression[J]. Int J Radiat Oncol Biol Phys, 2007, 69(3): 820–824. DOI:10.1016/j.ijrobp.2007.03.045 |
| [5] | Salvati M, Caroli E, Orlando ER, et al. Multicentric glioma:our experience in 25 patients and critical review of the literature[J]. Neurosurg Rev, 2003, 26(4): 275–279. DOI:10.1007/s10143-003-0276-7 |
| [6] | Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97–109. DOI:10.1007/s00401-007-0243-4 |
| [7] | Zamponi N, Rychlicki F, Ducati A, et al. Multicentric glioma with unusual clinical presentation[J]. Childs Nerv Syst, 2001, 17(1/2): 101–105. |
| [8] | Mishra HB, Haran RP, Singh JP, et al. Multicentric gliomas:two case reports and a review of the literature[J]. Br J Neurosurg, 1990, 4(6): 535–539. DOI:10.3109/02688699008993805 |
| [9] | Thomas RP, Xu LW, Lober RM, et al. The incidence and significance of multiple lesions in glioblastoma[J]. J Neuroooncol, 2013, 112(1): 91–97. DOI:10.1007/s11060-012-1030-1 |
| [10] | Wills R. Pathology of tumors[M]. London: Butterworths, 1960: 811. |
| [11] | Reis RM, Herva R, Brandner S, et al. Second primary glioblastoma[J]. J Neuropathol Exp Neurol, 2001, 60(2): 208–215. DOI:10.1093/jnen/60.2.208 |
| [12] | Patil CG, Eboli P, Hu J. Management of multifocal and multicentric gliomas[J]. Neurosurg Clin N Am, 2012, 23(2): 343–350. DOI:10.1016/j.nec.2012.01.012 |
| [13] | Di Russo P, Perrini P, Pasqualetti F, et al. Management and outcome of high-grade multicentric gliomas:a contemporary single-institution series and review of the literature[J]. Acta Neurochir (Wien), 2013, 155(12): 2245–2251. DOI:10.1007/s00701-013-1892-9 |
| [14] | Van den Bent MJ, Afra D, de Witte O, et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults:the EORTC 22845 randomised trial[J]. Lancet, 2005, 366(9490): 985–990. DOI:10.1016/S0140-6736(05)67070-5 |
| [15] | 严勇, 王洪祥, 徐涛, 等. 多中心脑胶质瘤诊治的临床研究[J]. 中华医学杂志, 2015, 95(13): 991–995. DOI:10.3760/cma.j.issn.0376-2491.2015.13.008 |
| [16] | 李东阳, 陈兴国, 王勇, 等. 血清中miRNA对人胶质瘤细胞的影响及临床意义[J]. 中国实验诊断学, 2017, 21(7): 1113–1116. |
| [17] | 谭泓叶, 张晓红, 张海黔. 银纳米粒子对乏氧胶质瘤细胞的影响[J]. 中国医学物理学杂志, 2017, 34(1): 89–94. |
 2018, Vol. 44
2018, Vol. 44


