扩展功能
文章信息
- 蓝永洪, 饶朗毓, 杨智, 黄明媚, 牛海艳, 齐亚灵
- LAN Yonghong, RAO Langyu, YANG Zhi, HUANG Mingmei, NIU Haiyan, QI Yaling
- 妊娠高血压综合征患者胎盘组织中HIF-1α和HSP70的表达及其意义
- Expressions of HIF-1α and HSP70 in placenta tissue of patients withpregnancy-induced hypertension syndrome and their significances
- 吉林大学学报(医学版), 2018, 44(02): 346-349
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 346-349
- 10.13481/j.1671-587x.20180225
-
文章历史
- 收稿日期: 2017-08-24
2. 海南医学院病原生物学教研室, 海南 海口 571199;
3. 海南医学院第一附属医院产科, 海南 海口 570102;
4. 海南医学院组织学与胚胎学教研室, 海南 海口 571199
2. Department of Pathogenic Biology, Hainan Medical College, Haikou 571199, China;
3. Department of Obstetrics, First Affiliated Hospital, Hainan Medical College, Haikou 570102, China;
4. Department of Histology and Embryology, Hainan Medical College, Haikou 571199, China
妊娠高血压综合征(pregnancy-induced hypertension syndrome, PIH)简称妊高征,是妊娠期特有的疾病。在我国妊高征的发生率为9.4%~10.4%,国外为7%~12% [1]。妊高征严重影响母婴健康,是孕产妇和围生儿并发其他疾病或死亡的主要原因[2-3]。目前认为妊高征的病因是滋养细胞侵入子宫蜕膜过浅,造成子宫螺旋小动脉血管重铸障碍,导致胎盘滋养细胞缺血缺氧,产生大量的血管活性物质进入母体循环,损伤母体血管内皮细胞,最终导致孕妇发生高血压、水肿及蛋白尿等临床表现[4-5]。缺氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α)是机体在缺氧情况下被激活的转录因子,对机体内环境的稳定方面有重要的意义。HIF-1α在缺氧情况下不仅能够调节低氧相关基因的转录,而且参与低氧反应的信号传递过程[6]。热休克蛋白70(heat shock protein 70, HSP70)是热休克蛋白家族中含量最多、表达最高的应激蛋白之一,普遍存在于哺乳类动物、植物和微生物内,是生物进化中高度保守的多肽蛋白,人体组织在病理情况下(缺氧、缺血、损伤和感染等)可导致HSP70的过表达[7]。研究[8-9]显示:HSP70的表达具有HIF-1α依赖性;在低氧条件下,HIF-1α通过调节热休克因子1的转录进而提高HSP70的表达水平[10]。关于妊高征患者胎盘组织中HIF-1α和HSP70表达均有相关的研究[11-12],但有关两者表达关系及其临床意义少见报道,因此本研究通过收集妊高征患者的胎盘组织,将其制成石蜡切片,采用免疫组织化学技术检测HIF-1α和HSP70的表达情况,分析二者的表达关系,探讨其在妊高征中的临床意义。
1 资料与方法 1.1 研究对象收集2015年1月-2016年6月海南医学院附属医院妇产科的40例胎盘组织标本,其中妊高征患者22例(妊高征组),年龄为26~44岁,孕周35~39周;正常孕妇18例(对照组),年龄为23~37岁,孕周37~41周。妊高征的诊断标准参考谢幸等[4]主编的《妇产科学》(第8版),所有病例均排除内科并发症及其他产科并发症。均为单胎。
1.2 主要试剂和仪器兔单克隆抗体HIF-1α和HSP70购自英国Abcam公司,免疫组织化学检测试剂PV-6001(山羊抗兔IgG/HRP聚合物)和DAB显色试剂盒均为购自北京中杉金桥生物技术有限公司。组织脱水机(STP120)和石蜡包埋机(Histocentre 3)均购自美国Thermo Fisher公司,手动轮转切片机(RM2235)购自德国Leica公司。
1.3 切片制备所有研究对象产后取1.5 cm×1.0 cm×0.5 cm胎盘组织,避开钙化、出血和梗死区,用4℃生理盐水冲洗血污,置于10%的中性甲醛中固定24 h,常规脱水、包埋,制成5 μm的石蜡切片,用黏附载玻片进行捞片,置于56℃干燥箱烤片。
1.4 免疫组织化学方法二甲苯脱蜡2次,100%、90%和80%乙醇梯度水化,蒸馏水浸泡,PBS浸泡,微波修复抗原20 min,自然冷却后置于3%H2O2溶液以阻断内源性过氧化物酶的活性,PBS洗3次,加正常山羊血清封闭10 min,滴加兔单克隆抗体(HIF-1α或HSP70)置湿盒内4℃中孵育过夜,PBS洗3次,滴加PV-6001孵育20 min,PBS洗3次,DAB显色,镜下观察显色结果,适时终止反应,苏木素复染,80%、90%、100%乙醇梯度脱水,晾干、二甲苯透明,中性树胶封片。
1.5 结果判定标准HIF-1α阳性为滋养细胞和血管内皮细胞的细胞核或细胞质出现棕黄色的颗粒,HSP70阳性为滋养细胞的细胞质或细胞核出现棕黄色的颗粒。显微镜高倍镜(×400)下随机取5个视野,每个视野计数100细胞,根据染色强度和阳性细胞百分比进行评分,其中染色强度:未着色为0分,淡黄色为1分,黄色为2分,棕黄色为3分;阳性细胞百分比:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分。两者分值相乘作为每一例的积分,积分≤3分为阴性(-),>3分为阳性(+) [13]。
1.6 统计学分析采用SPSS17.0统计软件进行统计学分析。2组研究对象胎盘组织中HIF-1α和HSP70阳性表达率比较采用χ2检验,HIF-1α和HSP70表达的相关关系采用Spearman相关分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况与对照组比较,妊高征组患者的孕周减少,收缩压和舒张压上升,胎儿质量下降(P < 0.05),而年龄和胎盘质量比较差异无统计意义(P>0.05)。见表 1。
| (x±s) | |||||||
Group |
n | Age (year) |
Gestational age (week) |
Systolic pressure (P/mmHg) |
Diastolic pressure (P/mmHg) |
Birth weight (m/g) |
Placental weight (m/g) |
| Control | 18 | 31.8±4.3 | 38.7±1.0 | 114.6±8.8 | 72.9±4.2 | 3 116.4±556.2 | 525.0±98.1 |
| PIH | 22 | 34.3±5.2 | 37.0±1.0 | 163.2±19.3 | 97.4±15.7 | 2 414.2±678.3 | 465.7±113.7 |
| t | 1.624 | 5.111 | 9.863 | 6.420 | 3.525 | 0.385 | |
| P | 0.113 | 0.001 | 0.001 | 0.001 | 0.001 | 0.090 | |
HIF-1α阳性染色呈棕黄色颗粒,表达于滋养细胞和血管内皮细胞的细胞核和细胞质,主要表达于细胞核;HSP70阳性染色呈棕黄色颗粒,表达于滋养细胞和血管内皮细胞的细胞核和细胞质,主要表达于细胞质。见图 1(插页七)。
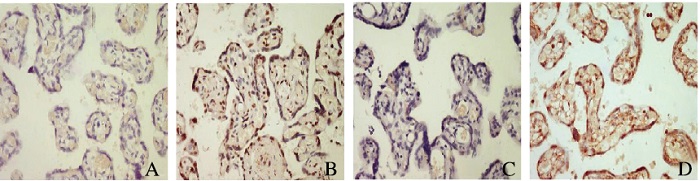
|
| A, B: HIF-1α; C, D: HSP70; A, C: Negative; B, D: Positive. 图 1 2组受试者胎盘组织中HIF-1α和HSP70的表达(免疫组织化学,×400) Figure 1 Expressions of HIF-1α and HSP70 in placenta tissue of subjects in two groups (Immunohistochemistry, ×400) |
|
|
妊高征组患者和对照组孕妇胎盘组织HIF-1α阳性表达率分别为81.8%和38.9%;HSP70阳性表达率分别为95.5%和55.6%。妊高征组患者胎盘组织HIF-1α和HSP70的阳性表达率均明显高于对照组(χ2 =7.785, P < 0.05;χ2 =6.599, P < 0.05)。见表 2和3。妊高征组患者胎盘组织中HIF-1α和HSP70的表达呈正相关关系(r=0.671, P=0.001)。见表 4。
| [n(η/%)] | |||
| Group | n | Negative | Positive |
| Control | 18 | 11(61.1) | 8(38.9) |
| PIH | 22 | 4(18.2) | 18(81.8)* |
| Total | 40 | 15(37.5) | 26(62.5) |
| * P < 0.05 compared with control group. | |||
| [n(η/%)] | |||
| Group | n | Negative | Positive |
| Control | 18 | 8(44.4) | 10(55.6) |
| PIH | 22 | 2(9.1) | 20(90.9)* |
| Total | 40 | 10(25.0) | 30(75.0) |
| * P < 0.05 compared with control group. | |||
| [n(η/%)] | |||
| HIF-1α | n | HSP70 | |
| Negative | Positive | ||
| Negative | 4 | 2(50.0) | 2(50.0) |
| Positive | 18 | 0(0.0) | 18(100.0) |
| Total | 22 | 2(9.1) | 20(90.9) |
| r= 0.671, P=0.001. | |||
HIF-1广泛存在于哺乳动物和人体体内,是一种与缺氧密切相关的转录因子[14]。有文献[15]显示:HIF-1以异源二聚体为主要的存在形式,由α亚基(HIF-1α)和β亚基(HIF-1β)构成。HIF-1α和HIF-1β同属于Bhlh-PAS转录因子家族,其中HIF-1α具有多个有效的转录活化区域,可直接或间接与转录起始复合物反应影响基因转录,是HIF-1转录活性的主要调节单位[16-17],在妊高征中HIF-1α可多途径影响滋养细胞和内皮细胞功能,使胎盘、蜕膜生理性血管重铸障碍; 并妨碍内皮细胞和滋养细胞损伤的再修复,加剧妊高征的病情进展。热休克蛋白(HSP)是生物受到环境中某些因素刺激时发生应激反映而合成的蛋白质,是一类广泛存在于生物体内高度保守的蛋白质[18]。HSP70是在热诱导下合成的一组具有高度保守性的蛋白质,具有分子伴侣和细胞保护等功能[19],妊高征患者胎盘缺血缺氧,导致活性氧的生成增加,HSP70能够保护细胞,防止应激因子所致的蛋白质损伤,启动内源性保护机制,发挥抗损伤的应激保护效应。本研究采用免疫组织化学法对胎盘组织中HIF-1α和HSP70蛋白的表达进行检测,结果显示:妊高征患者胎盘组织中HIF-1α和HSP70的表达明显升高,这与其他的研究[11-12]结果一致,同时HIF-1α和HSP70的表达呈正相关关系。说明妊高征患者胎盘组织缺氧导致HIF-1α呈高表达,能够改善局部组织对缺氧的耐受,但可以增强内皮素-1的表达活性,引起血管痉挛,导致血压升高,还能调控p53[20]、Bcl-2[21]和VEGF[22]的表达,从而引起滋养细胞凋亡和血管内皮损伤,刺激HSP70的产生,起到抗细胞凋亡和保护血管内皮的作用,在妊高征的发生过程可以抵抗缺氧引起的氧化应激一系列反应,但其两者的作用机制以及在妊高征中起到的具体作用需进一步研究。
| [1] | Lydakis C, Beevers M, Beevers DG, et al. The prevalence of pre-eclampsia and obstetric outcome in pregnancies of normotensive and hypertensive women attending a hospital specialist clinic[J]. Int J Clin Pract, 2001, 55(6): 361–367. |
| [2] | Hiett AK, Brown HL, Britton KA. Outcome of infants delivered between 24 and 28 weeks' gestation in women with severe pre-eclampsia[J]. J Matern Fetal Med, 2001, 10(5): 301–304. DOI:10.1080/jmf.10.5.301.304-16 |
| [3] | Bansal YP. Pre-eclampsia/eclampsia:a profile from Pumwani Maternity Hospital, Nairobi, Kenya[J]. East Afr Med J, 1985, 62(10): 691–698. |
| [4] | 谢幸, 苟文丽. 妇产科学[M]. 8版. 北京: 人民卫生出版社,2013: 64-66. |
| [5] | 朱丹, 刘玉萍, 蔡知天, 等. 多普勒超声检测妊高征患者母体循环血流动力学对围产儿结局的诊断价值[J]. 吉林大学学报:医学版, 2005, 31(3): 442–445. |
| [6] | Bracken CP, Whitelaw ML, Peet DJ. The hypoxia-inducible factors:key transcriptional regulators of hypoxic responses[J]. Cell Mol Life Sci, 2003, 60(7): 1376–1393. DOI:10.1007/s00018-003-2370-y |
| [7] | Silver JT, Noble EG. Regulation of survival gene hsp70[J]. Cell Stress Chaperones, 2012, 17(1): 1–9. DOI:10.1007/s12192-011-0290-6 |
| [8] | Yeh CH, Hsu SP, Yang CC, et al. Hypoxic preconditioning reinforces HIF-alpha-dependent HSP70 signaling to reduce ischemic renal failure-induced renal tubular apoptosis and autophagy[J]. Life Sci, 2010, 86(3/4): 115–123. |
| [9] | Huang WJ, Xia LM, Zhu F, et al. Transcriptional upregulation of HSP70-2 by HIF-1 in cancer cells in response to hypoxia[J]. Int J Cancer, 2009, 124(2): 298–305. DOI:10.1002/ijc.v124:2 |
| [10] | Baird NA, Turnbull DW, Johnson EA. Induction of the heat shock pathway during hypoxia requires regulation of heat shock factor hypoxia-inducible factor-1[J]. J Biol Chem, 2006, 281(50): 38675–38681. DOI:10.1074/jbc.M608013200 |
| [11] | 王莹, 陶潜, 鲁晓燕, 等. 妊娠高血压综合征孕妇胎盘组织中血红素氧合酶-1缺氧诱导因子-1α的表达及临床意义[J]. 山西医药杂志, 2017, 46(18): 2242–2244. |
| [12] | 林培红, 胡继芬. 子痫前期患者胎盘组织中HSP70和NF-κB的表达及意义[J]. 中国医药导报, 2016, 13(2): 61–64. |
| [13] | 高新雅, 张伟杰, 崔黎, 等. TM4SF1在乳腺癌组织中的表达及其临床意义[J]. 吉林大学学报:医学版, 2017, 43(6): 1186–1192. |
| [14] | Wenger RH, Gassman M. Oxygen(es) and the hypoxia induced factor-1[J]. Biol Chem, 1997, 378(7): 609–616. |
| [15] | 云芬, 贾永峰, 韩昭, 等. HIF-2α在非小细胞肺癌组织中的表达及其与微血管密度、Ki67和GST-π的关系[J]. 吉林大学学报:医学版, 2016, 42(5): 954–957. |
| [16] | Schumacker PT. Hypoxia-inducible factor-1(HIF-1)[J]. Crit Care Med, 2005, 33(12 Suppl): S423–S425. |
| [17] | 李芳, 关文霞, 任飞, 等. Sirt-1和Hif-1α在慢性阻塞性肺疾病患者外周血单个核细胞中的表达及其意义[J]. 吉林大学学报:医学版, 2015, 41(2): 356–361. |
| [18] | Deniset JF, Pierce GN. Heat Shock Proteins:Mediators of Atherosclerotic Development[J]. Curr Drug Targets, 2015, 16(8): 816–826. DOI:10.2174/1389450116666150416115423 |
| [19] | Bruemmer-Smith S, Stüber F, Schroeder S. Protective functions of intracellular heat-shock protein (HSP) 70-expression in patients with severe sepsis[J]. Intensive Care Med, 2001, 27(12): 1835–1841. DOI:10.1007/s00134-001-1131-3 |
| [20] | 肖娜, 高艳, 敖祥生, 等. 胶质瘤p53、PTEN和IDH与HIF-1α的相关性[J]. 生命科学, 2017, 29(8): 753–757. |
| [21] | 鲍合刚, 肖亮, 孟刚, 等. 涎腺腺样囊性癌中HIF-1α和BCL-2的表达及意义[J]. 临床与实验病理学杂志, 2017(7): 728–732. |
| [22] | 王淑贞, 王秋红. HIF-1α和VEGF在子宫内膜癌中的临床表达及相关性[J]. 实用癌症杂志, 2017, 32(4): 536–538. |
 2018, Vol. 44
2018, Vol. 44


