扩展功能
文章信息
- 黄琦, 沙辉, 陈龙, 吕龙龙, 徐声鸣, 张泽天, 赵松, 靳凤艳, 牛丰
- HUANG Qi, SHA Hui, CHEN Long, LYU Longlong, XU Shengming, ZHANG Zetian, ZHAO Song, JIN Fengyan, NIU Feng
- 多发性骨髓瘤和慢性淋巴细胞白血病患者血浆lncRNA MALAT1、LincRNA-p21和GAS5的表达水平及其诊断意义
- Expression levels of plasma lncRNA MALAT1, LincRNA-p21 and GAS5 in patients with multiple myeloma and chronic lymphocytic leukemia and their diagnostic significances
- 吉林大学学报(医学版), 2018, 44(02): 339-345
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 339-345
- 10.13481/j.1671-587x.20180224
-
文章历史
- 收稿日期: 2017-12-05
2. 吉林大学第一医院肿瘤中心, 吉林 长春 130021
2. Cancer Center, First Hospital, Jilin University, Changchun 130021, China
多发性骨髓瘤(multiple myeloma, MM)是一种以骨组织局灶性、软组织病变和弥漫性骨髓浸润为主要病理特征的骨髓恶性B淋巴细胞疾病,多发于中老年人群,近年来其发病率出现了逐渐增高的趋势。慢性淋巴细胞性白血病(chronic lymphocytic leukemia, CLL)是主要发生在中老年人群的一种成熟淋巴细胞克隆增殖性肿瘤,其特征为外周血、骨髓、脾脏和淋巴结等处的小淋巴细胞聚集。MM与CLL存在着相似的发病机制和演进过程,特别是当MM患者某种首发症状突出时,极易导致与CCL混淆,造成误诊[1-2]。因此,探讨这2种疾病的分子生物学标志物的区别与联系具有重要的临床意义。近年来的研究[3-4]显示:长链非编码RNA(lncRNA)在肿瘤细胞基因表达的调控中发挥着重要的作用,很多种lncRNA在特定肿瘤中呈现特异性的表达,针对lncRNA在肿瘤的诊断、治疗及预后评价中应用价值的研究已成为近年来的热点问题。研究[3, 5]显示:lncRNA MALAT1、LincRNA-p21和GAS5的表达异常可能参与了MM和CLL的病理过程,但国内外目前缺乏将这3种lncRNA作为血液标志物用于MM临床诊断的研究报道,基于这一研究现状,本研究针对MM和CLL患者血浆lncRNA MALAT1、LincRNA-p21和GAS5的表达水平及其诊断意义进行检测和分析,旨在阐明3种lncRNA在MM与CLL鉴别诊断中的意义。
1 资料与方法 1.1 临床资料选取2014年6月—2015年6月本院收治的60例MM患者(MM组)、60例CLL患者(CLL组)和60名健康体检者(对照组)作为研究对象,MM组和CLL组患者均符合吴晓芝主编的《血液病诊断与鉴别诊断图谱(2009年版)》[6]中的相关诊断标准,均表现为B细胞的克隆性增殖,患者均为首诊病例且未接受过任何抗肿瘤治疗;排除并发有活动性传染性疾病、急慢性肝炎、其他种类恶性肿瘤、精神疾患、脑卒中、重要器官器质性病变及入组前1个月有严重创伤或手术史的患者。对照组研究对象均经各项临床检查排除血液系统恶性肿瘤、心肝肾等器官严重损害,各组研究对象的临床资料见表 1和2。所有纳入研究对象均对本研究知情并签署知情同意书,本研究方案经本院医院伦理委员会审核通过。
| (n=60) | |||||
| Group | Age(year) | Gender | |||
| ≥60 | <60 | Male | Female | ||
| Control | 30 | 30 | 42 | 18 | |
| MM | 27 | 33 | 44 | 16 | |
| CLL | 31 | 29 | 46 | 14 | |
| (n=60) | ||||||||||||||||||
| Group | Durie Salmon stage | RAI stage | BINET stage | |||||||||||||||
| 1A | 2A | 2B | 3A | 3B | Unknown | 0 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Unknown | A | B | C | Unknown | |||
| MM | 4 | 11 | 4 | 16 | 12 | 13 | - | - | - | - | - | - | - | - | - | - | ||
| CLL | - | - | - | - | - | - | 10 | 6 | 8 | 2 | 1 | 33 | 17 | 7 | 5 | 31 | ||
| “-”:No data. | ||||||||||||||||||
采集各组研究对象的空腹外周静脉血标本,分离血浆后采用Tripure分离试剂(德国Roche公司)提取血浆总RNA,提取过程按照生产商的产品推荐流程进行,提取物保存于-80℃的冰箱中待测,根据生产商的推荐采用第一链基因cDNA合成试剂盒(美国Themo Scientific公司)、LightCyler 480实时定量PCR仪(德国Roche公司)对血浆标本中的lncRNA MALAT1、LincRNA-p21和GAS5进行扩增和定量检测,以cel-miR-39为内参,初始热启动为10 min,经45个周期的扩增,每个周期包括变性(10s、95℃)、退火(60℃、20s),扩增(72℃、30s)等过程,目的lncRNA的引物序列见表 3。读取目的lncRNA及内参的循环阈值(Ct值),并计算目的lncRNA与cel-miR-39的Ct值差值(△Ct),以2-△△Ct的数值代表目的lncRNA的相对表达水平。
| LncRNA primer | Primer sequence |
| MALAT1 | F 5′-GGATCCTAGACCAGCATGCC-3′ R 5′-AAAGGTTACCATAAGTAAGTTCCA- GAAAA-3′ |
| LincRNA-p21 | F 5′-GGGTGGCTCACTCTTCTGGC-3′ R 5′-TGGCCTTGCCCGGGCTTGTC-3′ |
| GAS5 | F 5′-CTTCTGGGCTCAAGTGATCCT-3′ R 5′-ACGACCAAATCCGTTGACTC-3′ |
应用SPSS 20.0统计软件进行统计学分析。由于目的lncRNA相对表达水平不服从正态分布,故采用中位数+四分位数(M,Q1,Q3)的形式表示,多组间比较采用多组计量数据的秩和检验(Kruskal-Wallis H法),两两比较采用Mann-Whitney U法,应用Bonferroni法调整检验水准,目的lncRNA在CLL和MM诊断中的价值应用受试者工作特征曲线(ROC曲线)进行分析,以ROC曲线下面积(AUC)作为评价诊断价值的指标,取约登指数最大时为最佳筛选界值(Cutoff值)。以P < 0.05为差异有统计学意义(Bonferroni法调整后检验水准为0.017)。
2 结果 2.1 各组研究对象血浆目的lncRNA相对表达水平各组研究对象血浆目的lncRNA相对表达水平比较差异均有统计学意义(χ2=71.903、47.212、45.822,P < 0.05);MM组患者血浆lncRNA MALAT1和GAS5相对表达水平明显高于其他2组(P < 0.05),CLL组患者血浆LincRNA-p21相对表达水平明显低于其他2组(P < 0.05);CLL组与对照组研究对象血浆lncRNA MALAT1和GAS5相对表达水平比较差异无统计学意义(P>0.05);MM组与对照组研究对象血浆LincRNA-p21相对表达水平比较差异亦无统计学意义(P>0.05)。见表 4。
| (n=60) | |||
| Group | MALAT1 | LincRNA-p21 | GAS5 |
| Control | 0.603(0.271,0.942) | 0.836(0.367,0.998) | 0.084(0.059,0.493) |
| MM | 2.002(1.239,2.759)*△ | 0.722(0.495,0.884) | 0.560(0.284,1.165)*△ |
| CLL | 0.615(0.269,0.931) | 0.329(0.188,0.480)*△ | 0.089(0.063,0.480) |
| * P < 0.05 compared with control group;△ P < 0.05 compared with CLL group. | |||
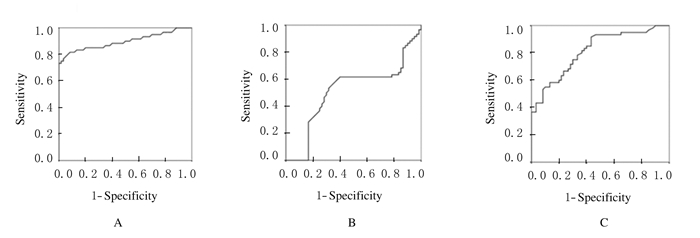
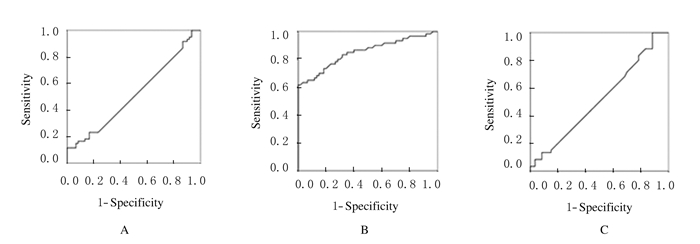
ROC曲线分析显示:在剔除CLL组患者后,MM组患者血浆lncRNA MALAT1和GAS5的AUC分别为0.898和0.815,95%置信区间(CI)分别为0.836~0.959和0.740~0.890,与对角线下面积0.5(对照组)比较差异均有统计学意义(P < 0.05),说明lncRNA MALAT1和GAS5对于MM有诊断价值;而LincRNA-p21对于MM无诊断价值(P>0.05)。见表 5和图 1。在剔除MM组患者后,CLL组患者血浆LincRNA-p21 AUC为0.850,95% CI为0.780~0.921,与对角线下面积0.5(对照组)比较差异有统计学意义(P < 0.05),说明LincRNA-p21对于CLL有诊断价值;而lncRNA MALAT1和GAS5对于CLL无诊断价值(P>0.05)。见表 6和图 2。
| lncRNA primer | AUC | Standard error | P | 95% CI | Cutoff | |
| Low | High | |||||
| MALAT1 | 0.898 | 0.031 | 0.000 | 0.836 | 0.959 | 1.084 |
| LincRNA-p21 | 0.514 | 0.055 | 0.785 | 0.406 | 0.623 | - |
| GAS5 | 0.815 | 0.038 | 0.000 | 0.740 | 0.890 | 0.096 |
| “-”:No data. | ||||||
|
| A:MALAT1; B:LincRNA-p21; C:GAS5. 图 1 目的lncRNA诊断MM的ROC曲线 Figure 1 ROC of target lncRNA in diagnosis of MM |
|
|
| lncRNA primer | AUC | Standard error | P | 95% CI | Cutoff | |
| Low | High | |||||
| MALAT1 | 0.517 | 0.053 | 0.745 | 0.413 | 0.621 | - |
| LincRNA-p21 | 0.850 | 0.036 | 0.000 | 0.780 | 0.921 | 0.627 |
| GAS5 | 0.525 | 0.042 | 0.802 | 0.443 | 0.607 | - |
| “-”:No data. | ||||||
|
| A:MALAT1; B:LincRNA-p21; C:GAS5. 图 2 目的lncRNA诊断CLL的ROC曲线 Figure 2 ROC of target lncRNA in diagnosis of CLL |
|
|
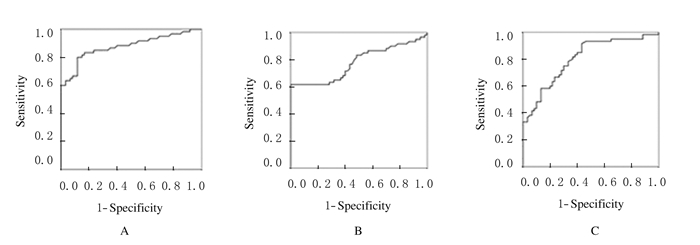
在剔除对照组研究对象后,以CLL组患者为对照病例进行ROC曲线分析,结果显示:MM组患者血浆lncRNA MALAT1、LincRNA-p21和GAS5的AUC分别为0.878、0.778和0.805,95% CI分别为0.814~0.942、0.691~0.865和0.727~0.882,与CLL组比较差异均有统计学意义(P < 0.05),说明其对MM和CLL的鉴别诊断均有价值。见表 7和图 3。
| lncRNA primer | AUC | Standard error | P | 95% CI | Cutoff | |
| Low | High | |||||
| MALAT1 | 0.878 | 0.033 | 0.000 | 0.814 | 0.942 | 1.155 |
| LincRNA-p21 | 0.778 | 0.044 | 0.000 | 0.691 | 0.865 | 0.701 |
| GAS5 | 0.805 | 0.040 | 0.000 | 0.727 | 0.882 | 0.096 |
|
| A:MALAT1; B:LincRNA-p21; C:GAS5. 图 3 目的lncRNA在MM和CLL鉴别诊断中的ROC曲线 Figure 3 ROC of target lncRNA in differential diagnosis of MM and CLL |
|
|
在人类的基因组中,编码蛋白质基因仅占2%,多达70%的人类基因只被转录成RNA,故人类基因组包含更多的非编码RNA信息,在RNA转录本中,除了经典的rRNA和tRNA等“看家”RNA和最近发现并明确定义的微小RNA(microRNAs, miRNAs)外,还包括lncRNA,其长度超过200个核苷酸并具有高度的保守性。目前的研究[5, 7]已证实:哺乳动物的基因组能够编码产生1000多种lncRNA,在人类基因组中已发现了5446个lncRNA相关基因。每种lncRNA均具有一定的结构和生化特性,能够参与细胞核结构和基因表达调控、免疫监视、胚胎干细胞的功能发育等多种生物学过程。研究[3, 8]显示:lncRNA参与肿瘤的发病和进展过程,但这些lncRNA对肿瘤细胞的影响机制并不十分清楚。肿瘤细胞和组织中RNA表达水平具有一定的不稳定性,而且取材较为困难,相比之下,非细胞系统的循环RNA表达水平相对稳定,特别是血浆或血清中RNA检测数据的可重复性更高。虽然目前针对外周循环中tRNA和miRNA表达量的研究较多,而对于循环lncRNA与肿瘤相关性的研究较少,但血液中游离的lncRNA是对于B淋巴细胞性恶性肿瘤具有重要意义的生物学标志物。
研究[8]显示:血液疾病患者的基因异常表达可通过多个相互作用的途径对骨髓瘤细胞、骨髓细胞外基质蛋白和基质细胞表面受体产生影响,从而参与肿瘤的生长、存活、迁移和耐药。本研究选取MALAT1、LincRNA-p21和GAS5作为目的lncRNA,其中,LincRNA-p21被认为是一种具有抑癌活性的lncRNA,LincRNA-p21的命名源于其是邻近p21基因的1个转录抑制因子,能够形成1个复杂并互相作用的RNA复合物,参与抑制肿瘤细胞抑制P53蛋白过程[9]。GAS5作为一种生长抑制特异基因,可对糖皮质激素及其受体发挥抑制作用并对淋巴和乳腺细胞的存活发挥调节作用[10-11]。目前的研究[12-13]已证实:GAS5与前列腺癌、肾细胞癌和非小细胞肺癌等恶性肿瘤的发生和发展均有相关性。MALAT1是转移相关肺腺癌基因1的基因符号,已被证明在中枢神经系统、内分泌系统、免疫系统、生殖系统和淋巴系统等多种组织系统中表达,MALAT1主要在细胞核内表达并对其基因的表达发挥调控作用[14-15]。MALAT1能够在细胞周期的选择性剪接调控中发挥作用,研究[16-17]已证实:MALAT1的过表达与发生在肺、结肠和膀胱等处实体肿瘤的发生具有相关性。
本研究结果显示:MM患者血浆lncRNA MALAT1和GAS5相对表达水平较高,提示血浆lncRNA MALAT1和GAS5的高表达与MM的发病有关,而血浆LincRNA-p21的低表达则与CLL的发病有关,检测上述3种lncRNA的血浆相对表达水平在MM和CLL诊断中具有重要的价值,可作为临床诊断的辅助指标。在本研究中尝试性地计算出3种lnRNA在诊断MM、CLL及MM与CLL鉴别诊断中的Cutoff值,可供进一步研究作为参考。众所周知,p53基因缺失是与MM和CLL等血液系统疾病的发病高度相关的事件,而LincRNA-p21的低表达可导致对p53抑制基因的作用下降,且其下调水平与CLL的疾病分期也具有相关性,这与17p13缺失与CLL的相关性具有一致性[18]。而GAS5和MALAT1的高表达则可对MM的发病发挥促进作用,GAS5的上调可对细胞凋亡发挥抑制作用,使细胞保持更多的细胞周期,而降低MM肿瘤细胞的GAS5表达可提升对于化疗药物的敏感性,白血病细胞的GAS5表达水平也可作为预测淋巴细胞存活率的指标[19]。研究[20]显示:在CLL和MM患者外周血中GAS5表达水平降低,这有待于进一步的研究予以讨论和证实。MALAT1具有一定的组织特异性,MALAT1在B细胞恶性肿瘤组织中的表达水平低于在实体瘤中的表达水平,但很多实体瘤患者外周循环中的MALAT1表达水平并不呈现明显的上调[21]。循环MALAT1与B细胞恶性肿瘤的转移和复发具有更加密切的联系,MM患者血浆MALAT1的高表达可能发挥干扰骨髓微环境、促进骨髓肿瘤细胞的增殖等作用[20, 22-24],但其详细机制还有待进一步的研究。
综上所述,血浆lncRNA MALAT1和GAS5的高表达与MM的发病有关,而血浆LincRNA-p21的低表达与CLL的发病有关,上述3种lncRNA的血浆相对表达水平可作为MM和CLL诊断的辅助指标。
| [1] | 中华医学会血液学分会、中国抗癌协会血液肿瘤专业委员会. 中国慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的诊断与治疗指南(2015年版)[J]. 中华血液学杂志, 2015, 36(10): 809–813. DOI:10.3760/cma.j.issn.0253-2727.2015.10.001 |
| [2] | 曾敏, 羊裔明. 误诊疾病数据库2004-2013年单病种误诊文献研究:多发性骨髓瘤[J]. 临床误诊误治, 2017, 30(1): 31–35. |
| [3] | Luo Y, Wang C, Yong P, et al. Decreased expression of the long non-coding RNA SLC7A11-AS1 predicts poor prognosis and promotes tumor growth in gastric cancer[J]. Oncotarget, 2017, 8(68): 112530–112549. |
| [4] | Li T, Zhu J, Wang X, et al. Long non-coding RNA lncTCF7 activates the Wnt/beta-catenin pathway to promote metastasis and invasion in colorectal cancer[J]. Oncol Lett, 2017, 14(6): 7384–7390. |
| [5] | Sanchez Y, Huarte M. Long non-coding RNAs:challenges for diagnosis and therapies[J]. Nucleic Acid Ther, 2013, 23(1): 15–20. DOI:10.1089/nat.2012.0414 |
| [6] | 吴晓芝. 血液病诊断与鉴别诊断图谱[M]. 北京: 人民卫生出版社,2009. |
| [7] | Jia H, Osak M, Bogu GK, et al. Genome-wide computational identification and manual annotation of human long noncoding RNA genes[J]. RNA, 2010, 16(8): 1478–1487. DOI:10.1261/rna.1951310 |
| [8] | Palumbo A, Anderson K. Multiple myeloma[J]. N Engl J Med, 2011, 364(11): 1046–1060. DOI:10.1056/NEJMra1011442 |
| [9] | Huarte M, Guttman M, Feldser D, et al. A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response[J]. Cell, 2010, 142(3): 409–419. DOI:10.1016/j.cell.2010.06.040 |
| [10] | He X, Chen X, Zhang X, et al. An Lnc RNA (GAS5)/SnoRNA-derived piRNA induces activation of TRAIL gene by site-specifically recruiting MLL/COMPASS-like complexes[J]. Nucleic Acids Res, 2015, 43(7): 3712–3725. DOI:10.1093/nar/gkv214 |
| [11] | Keenan CR, Schuliga MJ, Stewart AG. Pro-inflammatory mediators increase levels of the noncoding RNA GAS5 in airway smooth muscle and epithelial cells[J]. Can J Physiol Pharmacol, 2015, 93(3): 203–206. DOI:10.1139/cjpp-2014-0391 |
| [12] | Lucafo M, De Iudicibus S, Di Silvestre A, et al. Long noncoding RNA GAS5:a novel marker involved in glucocorticoid response[J]. Curr Mol Med, 2015, 15(1): 94–99. DOI:10.2174/1566524015666150114122354 |
| [13] | 张学军, 汤虎成, 刘飞. 长链非编码RNA Gas5在非小细胞肺癌中的表达及意义[J]. 临床肺科杂志, 2015, 20(2): 239–242. |
| [14] | Miyagawa R, Tano K, Mizuno R, et al. Identification of cis-and trans-acting factors involved in the localization of MALAT-1 noncoding RNA to nuclear speckles[J]. RNA, 2012, 18(4): 738–751. DOI:10.1261/rna.028639.111 |
| [15] | Yang F, Yi F, Han X, et al. MALAT-1 interacts with hnRNP C in cell cycle regulation[J]. FEBS Lett, 2013, 587(19): 3175–3181. DOI:10.1016/j.febslet.2013.07.048 |
| [16] | Schmidt LH, Spieker T, Koschmieder S, et al. The long noncoding MALAT-1 RNA indicates a poor prognosis in non-small cell lung cancer and induces migration and tumor growth[J]. J Thorac Oncol, 2011, 6(12): 1984–1992. DOI:10.1097/JTO.0b013e3182307eac |
| [17] | Xu C, Yang M, Tian J, et al. MALAT-1:a long non-coding RNA and its important 3' end functional motif in colorectal cancer metastasis[J]. Int J Oncol, 2011, 39(1): 169–175. |
| [18] | Bao X, Wu H, Zhu X, et al. The p53-induced lincRNA-p21 derails somatic cell reprogramming by sustaining H3K9me3 and CpG methylation at pluripotency gene promoters[J]. Cell Res, 2015, 25(1): 80–92. DOI:10.1038/cr.2014.165 |
| [19] | Williams GT, Mourtada-Maarabouni M, Farzaneh F. A critical role for non-coding RNA GAS5 in growth arrest and rapamycin inhibition in human T-lymphocytes[J]. Biochem Soc Trans, 2011, 39(2): 482–486. DOI:10.1042/BST0390482 |
| [20] | Isin M, Ozgur E, Cetin G, et al. Investigation of circulating lncRNAs in B-cell neoplasms[J]. Clin Chim Acta, 2014, 431: 255–259. DOI:10.1016/j.cca.2014.02.010 |
| [21] | Gutschner T, Hammerle M, Eissmann M, et al. The Noncoding RNA MALAT1 Is a Critical Regulator of the Metastasis Phenotype of Lung Cancer Cells[J]. Cancer Res, 2013, 73(3): 1180–1189. DOI:10.1158/0008-5472.CAN-12-2850 |
| [22] | Wu C, Macleod I, Su A I. BioGPS and MyGene.info:organizing online, gene-centric information[J]. Nucleic Acids Res, 2013, 41(Database issue): D561–565. |
| [23] | 冯超, 田登梅, 刘丽辉, 等. 慢性髓性白血病患者骨髓中Notch信号通路的表达[J]. 郑州大学学报:医学版, 2016, 51(6): 735–739. |
| [24] | 黄婷, 杨桂玲. MicroRNA-21在急性髓系白血病骨髓细胞中的异常表达及意义[J]. 西安交通大学学报:医学版, 2016, 37(1): 98–101. |
 2018, Vol. 44
2018, Vol. 44


