扩展功能
文章信息
- 张丽鹏, 荣春书, 谷一鸣, 傅耀文, 高宝山
- ZHANG Lipeng, RONG Chunshu, GU Yiming, FU Yaowen, GAO Baoshan
- 肾-骨髓联合移植诱导免疫耐受患者外周血B淋巴细胞重构的动态特点及其意义
- Dynamicfeatures of B lymphocyte reconstruction in peripheral blood of patients with immune tolerance induced with combined transplantation of kidney and bone marrow
- 吉林大学学报(医学版), 2018, 44(02): 332-338
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 332-338
- 10.13481/j.1671-587x.20180223
-
文章历史
- 收稿日期: 2017-10-09
2. 长春中医药大学附属医院脑病科, 吉林 长春 130021
2. Department of Neurology, Affiliated Hospital, Changchun University of Chinese Medicine, Changchun 130021, China
B淋巴细胞在器官移植领域具有重要作用。近年来B淋巴细胞在移植免疫耐受中所发挥的作用越来越受到关注。诸多研究[1-12]显示在免疫耐受移植患者中存在独特的B淋巴细胞标志。有研究[4, 6]显示:免疫耐受的移植患者部分免疫球蛋白轻链可变区的基因表达量明显上升。既往多数针对肾移植免疫耐受的研究[1, 4, 7]显示:其研究对象往往是因免疫抑制剂出现严重并发症而被迫停用或免疫抑制剂不耐受的患者,故免疫耐受的准确时间窗很难捕捉,影响了相关研究的准确性。为进一步揭示B淋巴细胞在器官移植诱导免疫耐受中的重构动态及分布特点,本文作者以5例肾-骨髓联合移植患者为研究对象,其中有3例患者成功达到免疫耐受,并完成免疫抑制剂的撤除[13-14]。此类患者由于是操控性免疫耐受,临床治疗的时点、预处理方案的应用、免疫抑制剂撤除的时点及免疫耐受建立的时点均有准确的记录,为研究的一致性及准确性提供了保障。利用这些患者的标本,从细胞表型及基因序列分析方面研究肾-骨髓联合移植患者外周血B淋巴细胞重构的特点,找出不同时点外周血优势B淋巴细胞亚群。为进一步研究B淋巴细胞在器官移植免疫耐受建立中发挥的作用提供依据。
1 资料与方法 1.1 研究对象诊断标准:各种肾脏疾病导致的不可逆的慢性肾脏功能衰竭。入选标准:年龄>18周岁,首次肾脏移植。排除标准:存在严重的心、肺疾病,存在活动性感染,严重的消化系统溃疡,明显的凝血功能异常,并发恶性肿瘤,需多器官移植,对免疫抑制剂不耐受。研究所用标本来自5例接受肾-骨髓联合移植手术的患者。患者接受了人淋巴细胞抗原(human leukocyte antigen,HLA)半相合的肾-骨髓联合移植,患者编码分别为Pt.A、Pt.B、Pt.C、Pt.D和Pt.E。患者一般资料见表 1。
| Patient | Sex | Age(year) | Original disease | Time discontinued immuno-suppression |
Graft survival | Creatinine[cB/(μmol·L-1)] | Urine protein[ρB/(mg·L-1)] | Immuno-suppression |
| A | M | 35 | Alport’s disease | 8 months | >5.0 years | 132.6 | 10 | None |
| B | F | 37 | Reflux uropathy | 8 months | >4.8 years | 70.7 | 20 | None |
| C | F | 36 | FSGS | - | 0.5 years | - | - | NA |
| D | F | 22 | MPGN | 8 months | >4.4 years | 97.2 | 50 | None |
| E | M | 26 | Alport’s disease | 8 months | 3.0 years | - | - | NA(retransplanted) |
| FSGS:Focal segmental glomerular sclerosis; MPGN:Mesangial proliferative glomerular nephritis; “-”:No data.. | ||||||||
术前7d、2d及术后5d和12d分别给予利妥昔单抗,375mg·m-2;术前5 d及4 d环磷酰胺60 mg·kg-1静脉注射;术前2 d抗CD2单克隆抗体0.1 mg·kg-1,移植当日(0d)及术后1d给予0.6 mg·kg-1;术前1d胸腺放射线照射,700cGy;手术当日(0 d),行同种异体肾移植手术,输供者骨髓细胞(2~8)×108kg-1;术前1d开始他克莫司0.1 mg·kg-1·d-1口服,术后逐渐减量应用,至术后8个月时停用;醋酸泼尼松片自手术当日起2 mg·kg-1·d-1口服,至术后20d停用。
1.3 患者随访患者术后依据随访计划定期随访,如少尿、发热、移植肾区疼痛时随时就诊。因Pt.C术后6个月时移植肾功能丧夫终止随访外,其余患者随访时间为3.0~5.0年,平均随访时间为4.3年。
1.4 实验方法外周血B淋巴细胞表型鉴定:外周血单核细胞(peripheral blood mononuclear cell,PBMC)加入APC耦联的抗CD19抗体(英国BectonDickinson公司)、FITC耦联的抗CD24抗体(美国BD Biosciences公司)、APC/Cy7耦联的抗CD27抗体(美国Biolegend公司)、PE耦联的抗CD38抗体(英国BectonDickinson公司),混匀细胞,于4℃避光静置30 min,4℃PBS洗涤2次后,应用FACSVerse流式细胞仪(美国BD Biosciences公司)检测细胞表面标志。B淋巴细胞数量以绝对值表示(个/μL),B淋巴细胞所占比例以百分比(%)表示。重组免疫球蛋白重链可变区(immunoglobulin heavy chain variable region,IGHV)基因分析:从PBMC提取RNA,以RNA为模板合成cDNA,再以合成的cNDA作为模板,用6种分别针对IGHV 6个家族基因(VH1~VH6)的正向引物及共同的恒定反向引物(JH)行PCR。将各时点DNA产物充分混匀,DNA的浓度为10mg·L-1,取100 μL样本,干冰冷冻包装,寄往Beckman-coulter Genomics Services行DNA序列检测。
重组IGHV基因序列及体细胞突变分析:经检测的IGHV应用免疫球蛋白分析软件IgAT分析[15]。利用此软件,每个基因序列中的框架区序列(FR1~FR3)以及互补决定区序列(CDR1~CDR3)均可被鉴别分析。利用基因序列中互补决定区序列3(complementarity determining region 3,CDR3)序列高度变异性的特性,如果诸多DNA序列中含有相同的CDR3序列,则认为这些DNA序列来源于同一个B淋巴细胞克隆,并据此分析B淋巴细胞的基因谱构成。同样,IGHV的高频体细胞突变(somatic hypermutation,SHM)也用IgAT分析软件加以鉴别。计算体细胞突变比例以揭示不同时点外周血B淋巴细胞基因序列突变情况。计算香农指数(Shannon diversity index,SDI),用以反映不同时点B淋巴细胞基因序列的多样性分布。SDI越高,说明基因多样性越强。
1.5 患者预后Pt.C移植术后6个月时因血栓性微血管病移植肾功能丧失,该患者未纳入后续研究。余下的4例患者,免疫抑制剂逐渐减量并于术后8个月停用。Pt.A、Pt.B和Pt.D移植术后4~5年时间内移植肾功能保持稳定。Pt.E停用免疫抑制剂后2个月时出现了急性T淋巴细胞介导的排异反应,重新应用免疫抑制剂,但该患者移植肾功能未恢复。
1.6 统计学分析采用GraphPad Prism 5.0统计软件进行统计学分析。组间IGHV基因序列的SDI比较采用Student t检验。以P < 0.05为差异有统计学意义。
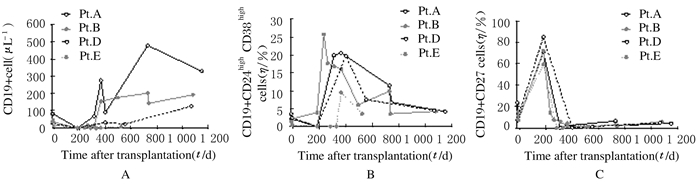
2 结果 2.1 肾-骨髓联合移植患者外周血B淋巴细胞的重构因入组患者移植术前及术后应用了利妥昔单抗,因此几乎清除了外周血中所有B淋巴细胞。如图 1A所示,B淋巴细胞重构的动态变化在患者之间变异较大,Pt.A的B淋巴细胞重构最早,Pt.B和Pt.D外周血B淋巴细胞重构相对较晚,而Pt.E外周血B淋巴细胞重构最晚,术后1年时外周血B淋巴细胞数量仍处于极低水平,此患者术后10个月时发生了移植肾排异反应。除了Pt.E外周血B淋巴细胞重构延迟外,Pt.A、Pt.B和Pt.D均在术后1年左右外周血B淋巴细胞计数基本恢复术前的水平(30~40 μL-1)。尽管患者术后早期外周血B淋巴细胞被完全清除,但术后182 d时点所有患者外周血中均检测到少量B淋巴细胞。本文作者对不同时点每例患者的外周血B淋巴细胞进行了表型鉴定,如图 1B所示,术后182d时,以表达CD19+CD24high CD38high为特征的过渡性B淋巴细胞总体来说比例非常低:182d时,过渡性B淋巴细胞约占Pt.B外周血B淋巴细胞的5%,而Pt.A、Pt.D和Pt.E在这个时间点几乎检测不到过渡性B淋巴细胞。
|
| A: Absolute nubmer of B cells; B: Percentage of translational B lymphocytes; C: Percentage of memory B lymphocytes. 图 1 外周血B淋巴细胞绝对值及B淋巴细胞亚群百分比 Figure 1 Absolute number of B lymphocytes in peripheral blood and percentages of B lymphocyte subsets |
|
|
相反,所有患者术后182d的B淋巴细胞是以表达CD20+CD27+的记忆性B淋巴细胞为主,此时点的记忆性B淋巴细胞占外周血B淋巴细胞的60%~90%(图 1C)。这些记忆性B淋巴细胞很可能是逃脱B淋巴细胞清除剂利妥昔单抗后残留下来的。此后时间点,记忆性B淋巴细胞的百分比快速下降至很低水平。
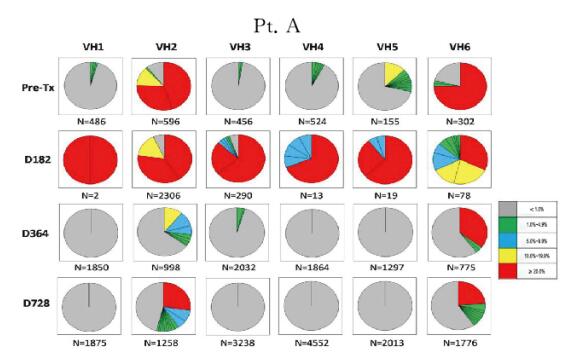
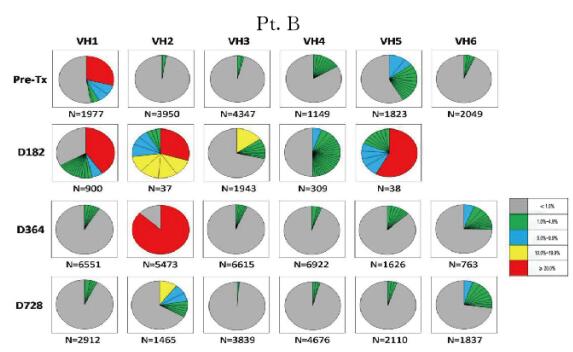
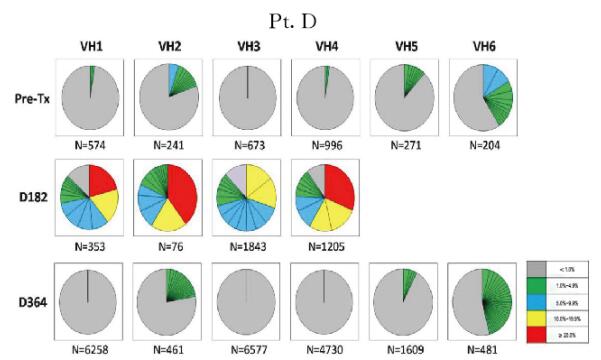
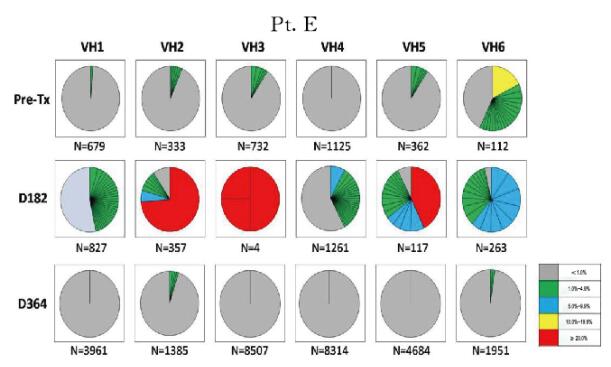
2.2 肾-骨髓联合移植患者外周血B淋巴细胞IGHV基因谱为了从细胞克隆水平评价患者外周血B淋巴细胞的重构特点,本文作者利用下一代基因测序手段从具有代表性的时点标本中获得了2500~28500个可读的基因序列,并分析所有基因序列中的CDR3片段,将具有相同CDR3片段的基因序列重新排列,获得每个时点样本B淋巴细胞基因序列的分布图。如图 2~5(插页六)所示,基因分布图显示了患者移植术后每个时点外周血B淋巴细胞的IGHV家族(VH1~VH6)CDR3序列的分布频数。患者移植术前、术后364d及728d时B淋巴细胞基因图谱呈多样性分布。尽管在移植术后182d时B淋巴细胞计数很低,但本文作者仍依靠此策略从每例患者的标本中获得了足够的B淋巴细胞IGHV基因序列以供分析。结果进一步证实移植术后182d时确实有极少量特定亚群的B淋巴细胞仍存在于患者外周血中。而此时点的B淋巴细胞基因图谱与其他时间点的图谱具有很大差异,B淋巴细胞池中仅存在少量具有优势分布的B淋巴细胞克隆。结合B淋巴细胞表型鉴定的结果综合分析则进一步证实:此时点发现的外周血B淋巴细胞很可能是经利妥昔单抗诱导治疗后残存的记忆性B淋巴细胞。
|
| 图 2 不同时间点Pt. A外周血B淋巴细胞IGHV基因图谱纵向分析 Figure 2 Longitudinal analysis of IGHV genetic map of B lymphocytes in peripheral blood of Pt.A at different time points |
|
|
|
| 图 3 不同时间点Pt.B外周血B淋巴细胞IGHV基因图谱纵向分析 Figure 3 Longitudinal analysis of IGHV genetic map of B lymphocytes in peripheral blood of Pt.B at different time points |
|
|
|
| 图 4 不同时间点Pt.D外周血B淋巴细胞IGHV基因图谱纵向分析 Figure 4 Longitudinal analysis of IGHV genetic map of B lymphocytes in peripheral blood of Pt.D at different time points |
|
|
|
| 图 5 不同时间点Pt.E外周血B淋巴细胞IGHV基因图谱纵向分析 Figure 5 Longitudinal analysis of IGHV genetic map of B lymphocytes in peripheral blood of Pt.E at different time points |
|
|
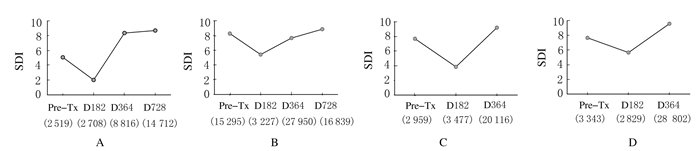
作为IGHV基因序列多样性的直观指标,本文作者计算了多时点基因序列的多样性指数——SDI。结果显示:所有患者在术后182d时点IGHV基因序列的SDI明显低于术前(P=0.004),此指数在术后1年左右逐渐恢复。见图 6。
|
| A:Pt.A; B:Pt.B; C:Pt.D; D:Pt.E. All sequences including identical CDR3 amino acid segments were considered originating from the same clone. 图 6 不同时间点患者外周血B淋巴细胞IGHV基因序列的多样性分析 Figure 6 Diversity analysis of IGHV sequences of B lymphocytes in peripheral blood at different time points |
|
|
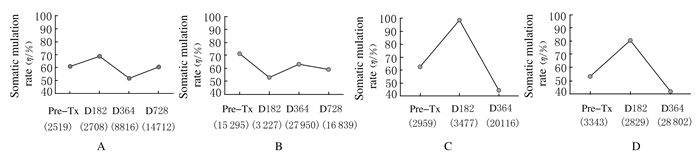
除了Pt.B,其他患者基因序列的体细胞突变率在术后182d时点明显升高(P=0.032),对应了在此时间点上记忆性B淋巴细胞是外周血B淋巴细胞的优势亚群。Pt.B是唯一在术后182d时点检出过渡性B淋巴细胞的患者,由于过渡性B淋巴细胞是幼稚细胞,因此该患者此时点的B淋巴细胞基因序列体细胞突变率呈下降趋势。见图 7。
|
| A:Pt.A; B:Pt.B; C:Pt.D; D:Pt.E. Somatic mutations (SHM) within IGHV sequences were identified using IgAT software. SHM rates were calculated for all time points. The total number of sequences analyzed for each sample was indicated below the time point markers. 图 7 不同时间点患者外周血IGHV基因序列体细胞突变率分析 Figure 7 Analysis of somatic mutation rates of sequences of IGHV in peripheral blood of patients at different time points |
|
|
本研究检测了肾-骨髓联合移植并达到诱导免疫耐受患者B淋巴细胞的重构。这个临床方案为本文作者提供了准确的研究时间窗,以便研究在免疫耐受诱导中B淋巴细胞的分布特性以及鉴别哪种特定B淋巴细胞亚群可能对潜在的免疫耐受机制发挥作用。
本研究结果显示:肾-骨髓联合移植后,患者外周血B淋巴细胞池逐渐恢复重构。在重构过程中,外周血B淋巴细胞计数个体之间差异很大,Pt.B的淋巴细胞重构较早,而Pt.A和Pt.D的B淋巴细胞重构相对较晚;Pt.E的B淋巴细胞重构最晚,此患者移植术后10个月时经历了移植肾排异反应并应用糖皮质激素及抗胸腺细胞免疫球蛋白治疗。细胞表型研究结果显示:尽管器官移植早期外周血B淋巴细胞的绝对计数较低,但呈现出很高比例的表达CD27+的B淋巴细胞。此细胞亚群很可能是利妥昔单抗处理后,未被清除的记忆性B淋巴细胞。由于记忆性B淋巴细胞与未成熟B淋巴细胞相比更易逃脱利妥昔单抗的清除。而在B淋巴细胞极度缺乏时,将出现B淋巴细胞的自适应增殖[16],同时因记忆性B淋巴细胞的自适应增殖效率高于未成熟B淋巴细胞[17],因此移植术后早期表现为以CD20+CD27+为优势亚群的B淋巴细胞。肾移植术后相对较晚的时点,待免疫抑制剂撤除后,过渡性B淋巴细胞的比例及绝对值有较大的波动。第2代测序对所有4例患者术后6个月IGHV基因的分析发现B淋巴细胞的基因图谱分布变化,恰好证实这一点。此时点IGHV基因的高频率体细胞突变进一步证实这些细胞是分化的记忆性B淋巴细胞。尽管存在个体上的差异,但总体来说,移植术后1年时点,随着新产生的未成熟过渡性B淋巴细胞的出现,整体外周血B淋巴细胞组成基本恢复术前状态。这种B淋巴细胞组成的恢复同时伴随有IGHV基因SDI的上升以及突变基因频数的下降。
Blair等[18]研究发现:过渡性B淋巴细胞具有调节功能,尤其是通过分泌IL-10而实现。本研究及其他研究[1, 4-5, 7]均显示:在免疫耐受患者中过渡性B淋巴细胞上升。尽管观察到此现象,但仍不能能认为过渡性B淋巴细胞是一个关键的免疫耐受因素。传统观点认为:外周血中检测到的过渡性B淋巴细胞尚未经历抗原刺激,故不太可能在体内有确切的功能。然而,B淋巴细胞的调节功能需要持续的刺激、使之失去未成熟的表型才能实现。
当然,调节性B淋巴细胞在体内可以从过渡性B淋巴细胞分化而来,但调节性B淋巴细胞在分化过程中将失去未成熟的细胞表面标志。因此很难说外周血标本中检测到的过渡性B淋巴细胞在免疫耐受中起到关键性的作用。相反,患者在免疫耐受诱导过程中,记忆性B淋巴细胞是主要的细胞亚群。以往的研究[1, 4, 7, 19]也曾显示记忆性B淋巴细胞的增加与诱导免疫耐受有关,由于这些研究的主要目标是观察过渡性B淋巴细胞与免疫耐受的关系,因此这些结果并未得到足够的重视。而且有研究[20-21]显示:记忆性B淋巴细胞也具有免疫调节的作用。结合以往相关的研究结果本实验结果表明:记忆性B淋巴细胞很可能在肾-骨髓联合移植患者中参与免疫耐受。但在患者外周血中发现的过渡性B淋巴细胞在免疫耐受建立的时间点很可能并未发挥关键性作用[22]。
本研究利用肾-骨髓联合移植患者的临床标本及资料,充分发挥此类患者临床干预及免疫耐受建立具有准确时间窗的优势,从细胞表型及基因序列分析方面研究肾-骨髓联合移植患者外周血B淋巴细胞重构的组成成分以及分布特点,找出不同时点的外周血优势B淋巴细胞亚群,为进一步研究B淋巴细胞在器官移植免疫耐受建立中发挥的作用提供了依据。
| [1] | Chesneau M, Pallier A, Braza F, et al. Unique B cell differentiation profile in tolerant kidney transplant patients[J]. Am J Transplant, 2014, 14(1): 144–155. DOI:10.1111/ajt.12508 |
| [2] | Chesneau M, Michel L, Dugast E, et al. Tolerant kidney transplant patients produce B cells with regulatory properties[J]. J Am Soc Nephrol, 2015, 26(10): 2588–2598. DOI:10.1681/ASN.2014040404 |
| [3] | Durand J, Huchet V, Merieau E, et al. Regulatory B cells with a partial defect in CD40 signaling and overexpressing granzyme B transfer allograft tolerance in rodents[J]. J Immunol, 2015, 195(10): 5035–5044. DOI:10.4049/jimmunol.1500429 |
| [4] | Newell KA, Asare A, Sanz I, et al. Longitudinal studies of a B cell-derived signature of tolerance in renal transplant recipients[J]. Am J Transplant, 2015, 15(11): 2908–2920. DOI:10.1111/ajt.13480 |
| [5] | Newell KA, Asare A, Kirk AD, et al. Identification of a B cell signature associated with renal transplant tolerance in humans[J]. J Clin Invest, 2010, 120(6): 1836–1847. DOI:10.1172/JCI39933 |
| [6] | Sagoo P, Perucha E, Sawitzki B, et al. Development of a cross-platform biomarker signature to detect renal transplant tolerance in humans[J]. J Clin Invest, 2010, 120(6): 1848–1861. DOI:10.1172/JCI39922 |
| [7] | Shabir S, Girdlestone J, Briggs D, et al. Transitional B lymphocytes are associated with protection from kidney allograft rejection:a prospective study[J]. Am J Transplant, 2015, 15(5): 1384–1391. DOI:10.1111/ajt.13122 |
| [8] | Mathes DW, Chang J, Hwang B, et al. Simultaneous transplantation of hematopoietic stem cells and a vascularized composite allograft leads to tolerance[J]. Transplantation, 2014, 98(2): 131–138. DOI:10.1097/TP.0000000000000204 |
| [9] | Leventhal JR, Elliott MJ, Yolcu ES, et al. Immune reconstitution/immunocompetence in recipients of kidney plus hematopoietic stem/facilitating cell transplants[J]. Transplantation, 2015, 99(2): 288–298. DOI:10.1097/TP.0000000000000605 |
| [10] | Chong AS, Sciammas R. Memory B cells in transplantation[J]. Transplantation, 2015, 99(1): 21–28. DOI:10.1097/TP.0000000000000545 |
| [11] | Massart A, Ghisdal L, Abramowicz M, et al. Operational tolerance in kidney transplantation and associated biomarkers[J]. Clin Exp Immunol, 2017, 189(2): 138–157. DOI:10.1111/cei.2017.189.issue-2 |
| [12] | Mastoridis S, Martinez-Llordella M, Sanchez-Fueyo A. Biomarkers and immunopathology of tolerance[J]. Curr Opin Organ Transplant, 2016, 21(1): 81–87. DOI:10.1097/MOT.0000000000000269 |
| [13] | Kawai T, Sachs DH, Sprangers B, et al. Long-term results in recipients of combined HLA-mismatched kidney and bone marrow transplantation without maintenance immunosuppression[J]. Am J Transplant, 2014, 14(7): 1599–1611. DOI:10.1111/ajt.12731 |
| [14] | Kawai T, Cosimi AB, Spitzer TR, et al. HLA-mismatched renal transplantation without maintenance immunosuppression[J]. N Engl J Med, 2008, 358(4): 353–361. DOI:10.1056/NEJMoa071074 |
| [15] | Rogosch T, Kerzel S, Hoi KH, et al. Immunoglobulin analysis tool:a novel tool for the analysis of human and mouse heavy and light chain transcripts[J]. Front Immunol, 2012, 3: 176. |
| [16] | Woodland RT, Schmidt MR. Homeostatic proliferation of B cells[J]. Semin Immunol, 2005, 17(3): 209–217. DOI:10.1016/j.smim.2005.02.006 |
| [17] | van Zelm MC, Szczepanski T, van der Burg M, et al. Replication history of B lymphocytes reveals homeostatic proliferation and extensive antigen-induced B cell expansion[J]. J Exp Med, 2007, 204(3): 645–655. DOI:10.1084/jem.20060964 |
| [18] | Blair PA, Norena LY, Flores-Borja F, et al. CD19(+)CD24(hi)CD38(hi) B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic Lupus Erythematosus patients[J]. Immunity, 2010, 32(1): 129–140. DOI:10.1016/j.immuni.2009.11.009 |
| [19] | Porcheray F, Wong W, Saidman SL, et al. B-cell immunity in the context of T-cell tolerance after combined kidney and bone marrow transplantation in humans[J]. Am J Transplant, 2009, 9(9): 2126–2135. DOI:10.1111/ajt.2009.9.issue-9 |
| [20] | Iwata Y, Matsushita T, Horikawa M, et al. Characterization of a rare IL-10-competent B-cell subset in humans that parallels mouse regulatory B10 cells[J]. Blood, 2011, 117(2): 530–541. DOI:10.1182/blood-2010-07-294249 |
| [21] | Khoder A, Sarvaria A, Alsuliman A, et al. Regulatory B cells are enriched within the IgM memory and transitional subsets in healthy donors but are deficient in chronic GVHD[J]. Blood, 2014, 124(13): 2034–2045. DOI:10.1182/blood-2014-04-571125 |
| [22] | Rebollo-Mesa I, Nova-Lamperti E, Mobillo P, et al. Biomarkers of tolerance in kidney transplantation:are we predicting tolerance or response to immunosuppressive treatment?[J]. Am J Transplant, 2016, 16(12): 3443–3457. DOI:10.1111/ajt.13932 |
 2018, Vol. 44
2018, Vol. 44


