扩展功能
文章信息
- 张艳霞, 李跃辉, 张丽红, 张年萍, 闫燕艳, 杨小会, 冯湘玲
- ZHANG Yanxia, LI Yuehui, ZHANG Lihong, ZHANG Nianping, YAN Yanyan, YANG Xiaohui, FENG Xiangling
- 沉默HOXA13基因对肝癌HepG2和QGY-7703细胞恶性表型的影响
- Effects of silencing HOXA13 gene on malignant phenotypes of hepatocellular carcinoma HepG2 and QGY-7703 cells
- 吉林大学学报(医学版), 2018, 44(02): 315-320
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 315-320
- 10.13481/j.1671-587x.20180220
-
文章历史
- 收稿日期: 2017-05-02
2. 中南大学基础医学院肿瘤研究所, 湖南 长沙 410078;
3. 中南大学湘雅公共卫生学院, 湖南 长沙 410078
2. Cancer Research Institute, School of Basic Medical Sciences, Central South University, Changsha 410078, China;
3. School of Xiangya Public Health, Central South University, Changsha 410078, China
同源盒(homeobox, HOX)基因最初是在研究果蝇的胚胎发育调控过程中被发现,是形态发生、细胞分化和维持成体细胞稳定的主要调节基因,其绝大多数分散在整个基因组,只有39个HOX基因,即HOX基因家族,有序地排列在特定的染色体上[1]。越来越多的研究显示:HOX基因表达改变与多种实体肿瘤密切相关,如肺癌[2]、乳腺癌[3]和口腔癌[4]等。Cillo等[5]研究发现:HOXA13在肝癌样本中高表达,而在相对应的癌旁组织中低表达,但对于HOXA13在肝癌发生发展过程中的作用目前少有报道。本研究采取RNA干扰技术,使HOXA13基因在肝癌细胞中低表达,进而从基因水平研究HOXA13对肝癌细胞恶性表型的影响。
1 材料与方法 1.1 细胞和主要试剂人肝癌细胞株HepG2和QGY-7703购自中南大学细胞中心。plent-U6-GFP载体(山东维真生物技术有限公司),新生小牛血清(杭州四季青生物工程材料有限公司),嘌呤霉素(研科生物试剂公司),RPMI-1640培养基(美国Gibco公司),细胞培养板、MTT和DMSO(北京鼎国昌盛技术有限责任公司),Lipofectamine 2000 Reagent(上海英维捷基贸易有限公司),Giemsa染料和碘化丙啶(PI)(美国Sigma公司)。
1.2 plent-U6-GFP/si-HOXA13重组载体构建从GenBank中提取HOXA13基因序列(序列号:NM_000522),设计、合成HOXA13基因的干扰序列5′-CAGAATCGTATTGGTTACA-3′,并定向克隆入plent-U6-GFP载体,构建plent-U6-GFP/si-HOXA13重组载体,并以空载体plent-U6-GFP为对照。
1.3 细胞转染将HepG2和QGY-7703细胞接种于24孔细胞培养板;第2天转染,具体操作方法参照脂质体2000(Lipofectamine 2000)产品说明书。A液制备:分别取2 μL Lipofectamine 2000与48 μL无血清RPMI-1640培养基轻轻混匀,37℃、5%CO2培养箱放置5 min;B液制备:分别取1 μg重组质粒plent-U6-GFP/si-HOXA13和1 μg对照质粒plent-U6-GFP与49 μL无血清RPMI-1640培养基轻轻混匀,37℃、5%CO2培养箱放置5 min;将A液和B液混匀,静置25 min;将待转染的HepG2和QGY-7703细胞用D-Hank’ s液洗1次,然后加入450 μL无血清RPMI-1640,再分别将上述A液和B液混合溶液加至板中,混匀后培养4~6h;换新鲜的无抗生素的RPMI-1640,48h后传代,然后加含1 mg·L-1嘌呤霉素的RPMI-1640筛选阳性克隆。
1.4 RT-PCR法鉴定HOXA13干扰效果按FERMENTAS产品说明书进行,具体操作如下:取细胞总RNA 2 μg,加Oligo(dt)18引物1 μL,加无Rnase的去离子水12 μL,轻轻混匀后,70℃、5 min;迅速将取出的PCR管放于冰上冷却,再加入5×Reaction buffer 4 μL,Ribonuclease inhibitor 1 μL和dNTP mix 2 μL,轻轻混匀后,70℃、5 min;再加1 μL RevertAidTMM-MuLV Reverse transcriptase,轻轻混匀,42℃、60 min,70℃、10 min,反应终止后进行PCR。PCR条件:95℃、1 min预变性;95℃、30s,60℃、30s,68℃、90s,循环28次;68℃延伸10 min。PCR扩增产物,采用1% Agaross凝胶(含0.8%Goldview)电泳进行鉴定。人HOXA13引物:正向引物5′-GGCCTTACCACCACCATCAG-3′,反向引物5′-TGGCGTATTCCCGTTCAAGT-3′,扩增产物片段长度为315 bp。GAPDH引物:正向引物5′-AATCCCATCACCATCTTCCA-3′,反向引物5′-CCTGCTTCACCACCTTCTTG-3′,扩增产物片段长度为580 bp。
1.5 Western blotting法鉴定HOXA13干扰效果分别制备5%的浓缩胶和10%的分离胶;样品制备:分别取50 μg蛋白样品,加5%的巯基乙醇,在100℃下煮沸5 min;电泳:先在70V电压下电泳约30 min,然后在100V电压下电泳约2h;转膜:分别将滤纸、SDS-PAGE胶、转印膜、滤纸按负极到正极的顺序放置在转膜装置上,100 mA转膜2h;抗体孵育:将转印后的转印膜置于封闭液中,4℃过夜。将转印膜取出,放于含1:400稀释的Rabbit Anti-Human HOXA13的抗体溶液中,置于恒温摇床上反应2 h,将膜取出漂洗3次,每次3~5 min,再加1:3000稀释的Mouse Anti-Rabbit IgG-HRP的抗体溶液中,置于恒温摇床上反应1h;PBST漂洗3次,每次3~5 min;暗室内进行曝光、显影和定影;胶片扫描。
1.6 实验分组以HOXA13基因沉默的HepG2和QGY-7703细胞(HepG2/si-HOXA13和QGY-7703/si-HOXA13)为实验组,以转染空质粒的HepG2和QGY-7703细胞(HepG2/C和QGY-7703/C)为对照组。
1.7 MTT法检测细胞生长速度各组细胞均按5×103/孔的数量分别接种于96孔板,然后在培养箱中放置24h;分别加MTT(终浓度为5 g·L-1),再继续培养4 h;吸尽上层液体,再分别加入200 μLDMSO,约8 min后,酶标仪490nm处测吸光度(A)值。以A值为纵轴,时间为横轴绘制HepG2/si-HOXA13、QGY-7703/si-HOXA13、HepG2/C和QGY-7703/C细胞生长曲线图,比较2组细胞的生长速度。
1.8 细胞倍增时间检测实验组和对照组细胞以1×103个细胞/孔接种于24孔板,第2天收集细胞并计数。按以下计算公式计算HepG2/si-HOXA13、QGY-7703/si-HOXA13、HepG2/C和QGY-7703/C细胞的平均倍增时间:TD=t[lg2/(lgNt1-lgN0)](TD为细胞倍增时间,t为培养时间,N0、Nt分别代表接种后及培养t小时后的细胞数)。
1.9 平板克隆形成能力检测实验组和对照组细胞均按1000个细胞/孔接种于6孔板,在培养箱中放置2~3周;终止培养后,甲醇固定15 min;Giemsa染色15 min,洗去染色液,空气风干;计算克隆数(多于50个细胞者为1个克隆)。
1.10 细胞周期检测将实验组和对照组细胞以5×104个接种于培养瓶,24 h后,用不完全培养基培养12 h;再换完全培基,第2天收集细胞,用D-Hank’s液将细胞漂洗2次,PI染色25~35 min。流式细胞仪分析细胞周期分布情况。
1.11 统计学分析采用SPSS 13.0统计软件进行统计学分析。对照组和实验组细胞平均倍增时间和克隆形成数均以x±s表示,2组间比较采用方差分析和SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 沉默HOXA13基因细胞系的构建分别将重组质粒plent-U6-GFP/si-HOXA13和对照质粒plent-U6-GFP用Lipofectamine 2000转染HepG2和QGY-7703细胞,经2 mg·L-1嘌呤霉素筛选约14d,挑单克隆扩大培养,首先采用RT-PCR法分别检测HepG2/plent-U6-GFP/si-HOXA13、HepG2/plent-U6-GFP、QGY-7703/ plent-U6-GFP/si-HOXA13和QGY-7703/ plent-U6-GFP细胞中的HOXA13 mRNA表达水平,结果显示:实验组HepG2/plent-U6-GFP/si-HOXA13和QGY-7703/plent-U6-GFP/si-HOXA13细胞中HOXA13 mRNA表达水平明显低于对照组,而对照组HepG2/plent-U6-GFP和QGY-7703/plent-U6-GFP细胞HOXA13 mRNA水平明显无变化(图 1 A和B),分别将HepG2/plent-U6-GFP/si-HOXA13、QGY-7703/ plent-U6-GFP/si-HOXA13、HepG2/ plent-U6-GFP和QGY-7703/ plent-U6-GFP细胞系命名为HepG2/si-HOXA13、QGY-7703/si-HOXA13、HepG2/C和QGY-7703/C。进一步采用Western blotting法分别检测实验组和对照组HepG2/si-HOXA13、QGY-7703/si-HOXA13、HepG2/C和QGY-7703/C细胞中HOXA13蛋白表达水平,结果显示:实验组HepG2/si-HOXA13和QGY-7703/si-HOXA13细胞中HOXA13蛋白表达水平明显低于对照组(图 1 C和D),结果与RT-PCR法检测结果一致。说明沉默HOXA13细胞系建立成功,可用于后续实验。
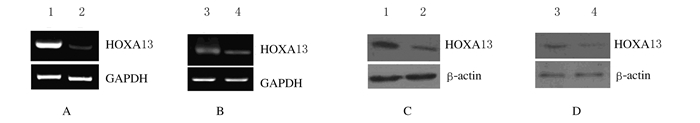
|
| Lane 1:HepG2/C cells; Lane 2:HepG2/si-HOXA13 cells; Lane 3:QGY-7703/C cells: Lane 4:QGY-7703/si-HOXA13 cells. 图 1 RT-PCR (A, B)和Western blotting (C, D)法检测稳定转染plent-U6-GFP/si-HOXA13和plent-U6-GFP细胞中HOXA13表达电泳图 Figure 1 Electrophoregram of expressions of HOXA13 in cells transfected with plent-U6-GFP/si-HOXA13 and plent-U6-GFP detected by RT-PCR(A, B) and Western blotting(C, D) methods |
|
|
与对照组HepG2/C和QGY-7703/C细胞比较,实验组HepG2/si-HOXA13和QGY-7703/si-HOXA13细胞的生长速度明显下降。见图 2。

|
| 图 2 MTT法检测2组HepG2 (A)与QGY-7703 (B)细胞的生长曲线 Figure 2 Growth curves of HepG2(A) and QGY-7703(B) cells in two groups detected by MTT method |
|
|
HepG2/C和HepG2/si-HOXA13细胞平均倍增时间分别为(4.59±0.27)和(6.02±0.86)h;QGY-7703/C和QGY-7703/si-HOXA13细胞平均倍增时间分别为(4.93±0.17)和(6.43±0.66)h;实验组HepG2/si-HOXA13和QGY-7703/si-HOXA13细胞的平均倍增时间明显延长,与对照组比较差异有统计学意义(P < 0.05)。
2.4 2组细胞克隆形成数HepG2/C和HepG2/si-HOXA13细胞克隆形成数分别为(264.00±12.62)和(165.00 ±10.61)个;QGY-7703/C和QGY-7703/si-HOXA13细胞克隆形成数分别为(269.00±4.43)和(215.00±4.50)个;实验组HepG2/si-HOXA13和QGY-7703/si-HOXA13细胞克隆形成数明显低于对照组(P < 0.01)。见图 3。
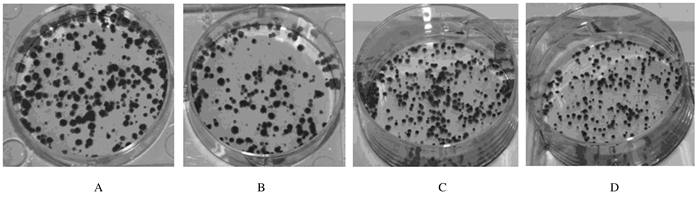
|
| A, B:Control group; C, D:Experimental group; A, C:HepG2 cells; B, D:QGY-7703 cells. 图 3 平板克隆形成实验检测2组细胞的克隆形成能力 Figure 3 Abilities of colony formation of cells in two groups detected by colony formation assay |
|
|
HepG2/si-HOXA13和QGY-7703/si-HOXA13细胞G1/G0期细胞比例分别是(59.90±3.10)%和(55.19±2.10)%;S期细胞比例分别是(25.00±2.17)%和(32.71±2.07)%;G2/M期细胞比例分别是(13.10±1.23)%和(12.10±1.23)%。而HepG2/C和QGY-7703/C细胞G1/G0期细胞比例分别是(52.72±3.26)%和(47.12±2.26)%;S期细胞比例分别是(34.56±2.77)%和(41.78± 2.57)%;G2/M期细胞比例分别是(12.10±1.52)%、(11.10±1.49)%。与对照组比较,实验组HepG2/si-HOXA13和QGY-7703/si-HOXA13细胞G1期比例增多,S期细胞比例减少。见图 4。

|
| A, B Control group; C, D Experimental group; A, C:HepG2 cells; B, D:QGY-7703 cells. 图 4 流式细胞术检测2组细胞的细胞周期 Figure 4 Cell cycles of cells in two groups detected by flow cytometry |
|
|
HOX基因是调控机体发育、细胞增殖与分化的主要分子之一[6],分为HOXA、HOXB、HOXC和HOXD 4种类型,各自排列在一条特定的染色体上[7]。越来越多的研究[8-10]显示:HOX异常与人类许多肿瘤的发生和进展有关联。Vider等[11]研究发现:HOXB6、HOXB8、HOXC8和HOXC9基因在结肠癌细胞CaCo-2和HT-29中表达上调。有研究[12]显示:HOXA1、HOXA5、HOXA10和HOXC6基因在肺癌样本中的表达明显升高,其中以HOXA5和HOXA10基因的差异表达尤为明显。Kanai等[13]发现:HOXA9、HOXB3、HOXB8和HOXB9在肝癌样本中的表达明显升高。Quagliatat等[14]发现HOXA13在肝癌组织中高表达与肝癌预后不良有密切关联。
本实验结果显示:HOXA13基因沉默以后,HepG2和QGY-7703细胞的体外生长速度明显降低,细胞倍增时间明显延长,克隆形成能力也明显降低,表明可能是基因水平的改变导致了HOXA13蛋白表达减少,从基因水平印证了HOXA13可以使肝癌细胞的生长速度明显加快、细胞倍增时间明显缩短、克隆形成能力也明显增加,从而增殖速度加快、成瘤能力增加,加速了肿瘤发生发展的进程,导致其预后不良,与Quagliatat等[14]的研究结果趋势一致。另外,肝癌细胞的生长速度明显加快,细胞倍增时间明显缩短,而血管形成相对不足导致营养供应不足,从而肿瘤更容易发生出血、坏死等继发改变,更容易破坏局部组织和发生远处转移,这也是导致肿瘤不良预后的原因[15]。可见HOXA13可以使肝癌的恶性程度增加。
Gu等[16]研究HOXA13对食管鳞癌的促瘤作用发现:HOXA13沉默后,食管鳞癌细胞的克隆形成能力、裸鼠成瘤能力均明显降低。Li等[7]研究发现,HOXA7基因有效沉默后,HepG2和QGY-7703细胞体外生长速度明显减慢,细胞周期也发生改变,即G1期细胞比例升高,S期细胞比例降低,裸鼠体内成瘤能力也下降,并且发现细胞周期蛋白E1和细胞周期蛋白2表达水平也明显下降。且在正常肝细胞中采用基因重组的方法使HOXA7过表达后,肝细胞的体外增殖速度加快,细胞周期蛋白E1和细胞周期蛋白2水平明显升高。说明HOXA7能促进肝细胞增殖,与细胞周期蛋白E1和细胞周期蛋白2介导有关。本实验中HOXA13基因有效沉默后,HepG2和QGY-7703细胞周期分布发生明显变化,G1期细胞增多,S期细胞减少,可能是HOXA13在HepG2和QGY-7703细胞中的表达具有周期依赖性,以维持HepG2和QGY-7703细胞的有丝分裂,其机制尚需进一步证实。
综上所述,有效沉默HOXA13后,可引起肝癌细胞周期阻滞、细胞倍增时间明显延长和增殖能力明显降低,说明HOXA13在肝癌的发生发展过程中发挥了重要的作用,这为以HOXA13为靶点的肝癌诊断和治疗提供了新的理论依据及靶向策略。
| [1] | 杨小会, 李跃辉, 冯湘玲. 同源异型盒基因甲基化与实体肿瘤的研究进展[J]. 医学临床研究, 2017, 34(9): 1739–1742. |
| [2] | Chang CJ, Chen YL, Hsieh CH, et al. HOXA5 and p53 cooperate to suppress lung cancer cell invasion and serve as good prognostic factors in non-small cell lung cancer[J]. Cancer, 2017, 8(6): 1071–1081. DOI:10.7150/jca.17295 |
| [3] | Xia B, Shan M, Wang J, et al. Homeobox A11 hypermethylation indicates unfavorable prognosis in breast cancer[J]. Oncotarget, 2017, 8(6): 9794–9805. |
| [4] | Xue M, Zhu FY, Chen L, et al. HoxB9 promotes the migration and invasion via TGF-β1/Smad2/Slug signaling pathway in oral squamous cell carcinoma[J]. Am J Transl Res, 2017, 9(3): 1151–1161. |
| [5] | Cillo C, Schiavo G, Cantile M, et al. The HOX gene network in hepatocellular carcinoma[J]. Int J Cancer, 2011, 129(11): 2577–2587. DOI:10.1002/ijc.25941 |
| [6] | Sauvegarde C, Paul D, Bridoux L, et al. Dynamic pattern of HOXB9 protein localization during oocyte maturation and early embryonic development in mammals[J]. PLoS ONE, 2016, 11(10): e0165898. DOI:10.1371/journal.pone.0165898 |
| [7] | Li YH, Yang XH, Fang SJ, et al. HOXA7 stimulates human hepatocellular carcinoma proliferation through cyclin E1/CDK2[J]. Oncol Rep, 2015, 33(2): 990–996. DOI:10.3892/or.2014.3668 |
| [8] | Armas-López L, Piña-Sánchez P, Arrieta O, et al. Epigenomic study identifies a novel mesenchyme homeobox2-GLI1 transcription axis involved in cancer drug resistance, overall survival and therapy prognosis in lung cancer patients[J]. Oncotarget, 2017, 8(40): 67056–67081. |
| [9] | Brechka H, Bhanvadia RR, VanOpstall C, et al. HOXB13 mutations and binding partners in prostate development and cancer:Function, clinical significance, and future directions[J]. Genes Dis, 2017, 4(2): 75–87. DOI:10.1016/j.gendis.2017.01.003 |
| [10] | Li M, Li X, Zhuang Y, et al. Induction of HOXA9 expression in three-dimensional organotypic culture of the Claudin-low breast cancer cells[J]. Oncotarget, 2016, 7(32): 51503–51514. |
| [11] | Vider BZ, Zimber A, Chastre E, et al. Deregulated expression of homeobox-containing genes, HOXB6, B8, C8, C9, and Cdx-1, in human colon cancer cell lines[J]. Biochem Biophys Res Commun, 2000, 272(2): 513–518. DOI:10.1006/bbrc.2000.2804 |
| [12] | Abe M, Hamada J, Takahashi O, et al. Disordered expression of HOX genes in human non-small cell lung cancer[J]. Oncol Rep, 2006, 15(4): 797–802. |
| [13] | Kanai M, Hamada J, Takada M, et al. Aberrant expressions of HOX genes in colorectal and hepatocellular carcinomas[J]. Oncol Rep, 2010, 23(3): 843–851. |
| [14] | Quagliata L, Quintavalle C, Lanzafame M, et al. High expression of HOXA13 correlates with poorly differentiated hepatocellular carcinomas and modulates sorafenib response in in vitro models[J]. Lab Invest, 2018, 98(1): 95–105. DOI:10.1038/labinvest.2017.107 |
| [15] | 沙亮, 何剑波, 李科志, 等. 特异性下调LKB1的表达对肝癌细胞侵袭迁移能力的影响[J]. 临床肝胆病杂志, 2016, 33(5): 875–879. |
| [16] | Gu ZD, Shen LY, Wang H, et al. HOXA13 promotes cancer cell growth and predicts poor survival of patients with esophageal squamous cellcarcinoma[J]. Cancer Res, 2009, 69(12): 4969–4973. DOI:10.1158/0008-5472.CAN-08-4546 |
 2018, Vol. 44
2018, Vol. 44


