扩展功能
文章信息
- 丁振东, 张玉影, 张宇, 钟越, 温娜, 于洪泉, 齐玲
- DING Zhendong, ZHANG Yuying, ZHANG Yu, ZHONG Yue, WEN Na, YU Hongquan, QI Ling
- 五味子多糖对脑肿瘤干细胞的凋亡诱导及生长抑制作用
- Apoptosis induction and growth inhibition effects of Schisandra chinensis polysaccharides on brain tumor stem cells
- 吉林大学学报(医学版), 2018, 44(02): 305-309
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 305-309
- 10.13481/j.1671-587x.20180218
-
文章历史
- 收稿日期: 2017-11-29
2. 吉林大学公共卫生学院卫生毒理学教研室, 吉林 长春 130021;
3. 吉林医药学院病理教研室, 吉林 吉林 132013
2. Department of Hygiene Toxicology, School of Public Health, Jilin University, Changchun 130021, China;
3. Department of Pathology, Jilin Medical University, Jilin 132013, China
脑肿瘤因位于颅内,所处位置极为特殊,一旦发生肿瘤就会对患者的生命产生严重的威胁,同时,也使患者的生活质量明显下降,更给家庭带来了沉重的经济负担[1]。近年肿瘤生物学研究[2-3]显示:脑肿瘤中存在的一小群干细胞是其发生、复发及耐药的源头,目前对其仍缺乏有效的治疗药物。本课题组此前研究[4]发现:五味子多糖(Schisandra chinensis polysaccharide, SCP)和五味子木脂素均能明显抑制胶质瘤细胞生长,且SCP作用于脑肿瘤干细胞(brain tumor stem cells,BTSCs)的机制尚未见相关文献报道。因此本文作者观察SCP对BTSCs生长的作用,且初步阐明其作用机制。
1 材料与方法 1.1 主要试剂和仪器SCP(中国药品生物制品检定所),DMEM/F12细胞培养液、神经培养基、B27和小牛血清(美国Gibco公司),CD133免疫磁珠(美国Miltenyi Biotec公司),碱性成纤维细胞生长因子(bFGF)和表皮生长因子(EGF)(英国PeproTech公司),木瓜蛋白酶(美国Worthington DBA公司),二甲基亚枫(DMSO)和四甲基偶氮唑(MTT)(美国Sigma公司),Bax、Bcl-2和Caspase-3抗体(北京中杉公司)。CB150型CO2培养箱(德国Binder公司),PLUS 384型全自动酶标仪(美国MDC公司),Ⅸ-70型倒置显微镜(日本Olympus公司)。
1.2 细胞培养和观察人脑肿瘤组织由吉林大学第一医院神经外科提供,病理诊断均为Ⅲ-Ⅳ级脑胶质瘤。将瘤组织剪成1 mm×1 mm×1 mm组织块,置入15 mL离心管中,加木瓜蛋白酶10 mL混匀,置37℃水浴45 min,其间不时振荡,3 mL卵类黏蛋白液终止反应。反复吹打,300 g离心5 min,再加入红细胞去除液振荡10 min。再次离心后将细胞用无血清培养液洗涤(神经培养基加入B27、EGF和bFGF均为20 μg·L-1),离心后重悬细胞,台盼蓝计数后将细胞以2×106·25 cm2密度种于培养瓶中,5% CO2、37℃、饱和湿度下培养过夜。
1.3 CD133免疫磁珠筛选BTSCs次日收集细胞将其吹打成单细胞后用70 μm滤器过滤,计数活细胞。用分选缓冲液进行细胞洗涤,800 g离心3 min,将细胞用300μL分选缓冲液重新混匀后加入CD133免疫磁珠100 μL,4℃避光孵育30 min,缓冲液再次洗涤,800 g离心10 min,弃上清后缓冲液进行细胞重悬。500μL缓冲液进行分选柱冲洗,细胞悬液压力过柱,反复用缓冲液冲洗分选柱3次,移分选柱出磁场,最后用1 mL缓冲液洗先选柱,用泵加压,收集的洗液为CD133+细胞,即BTSCs。
1.4 检测干细胞表面抗原收集生长的神经球,800 g低速离心3 min,PBS液洗涤沉淀,将神经球转移至1.5 mL离心管中,4%多聚甲醛固定,0.3% Triton X-100通透细胞。5%驴血清室温封闭1 h,一抗(Nestin 1:200;CD133 1:100)4℃过夜,加入相应的二抗(Tex-Red或FITC 1:200),室温下避光孵育1 h。DAPI染核后封片,次日用荧光显微镜观察,拍照。
1.5 细胞生长能力分析将BTSCs制成单细胞悬液,按细胞密度为5×103个/孔接种于96孔板,置于37℃、5% CO2及饱和湿度条件下培养过夜。次日,加入SCP(用含5%小牛血清的培养基配制,浓度分别为0、200、400和800μg·L-1),每组设5个复孔,加药24 h,每孔加入MTT 20 μL,继续在培养箱中孵育4 h,弃上清后每孔加入150μL DMSO,振荡混匀后酶标仪检测各孔490 nm处吸光度(A)值,计算细胞增殖率。细胞增殖率=(用药组A值/对照组A值)×100%。
1.6 细胞凋亡率测定将BTSCs机械分离成单细胞悬液,将细胞以5×105个/孔密度种于6孔板中,置于5%CO2、37℃培养箱中过夜。实验分为对照组(0μg·L-1)和SCP组(药物浓度为800μg·L-1),作用24h后离心收集细胞。PBS洗涤细胞后,用1:4 binding buffer缓冲液190μL重悬细胞,调整细胞浓度,加入FITC标记的Annexin Ⅴ FITC 5μL和20mg·L-1 PI 10μL,置冰上10 min,流式细胞仪检测各样品中每10 000个细胞中的凋亡细胞,计算细胞凋亡率,软件分析得出结果。
1.7 各组BTSCs中Bax、Bcl-2和Caspase-3蛋白表达各剂量SCP作用于BTSCs,留取上清液,将包被液与上清1:1比例包被,4℃过夜,次日封闭后加入Bax、Caspase-3、Bcl-2(1:1000),4℃过夜。加入二抗(1:1000),37℃水浴1h,显色自动酶标仪490nm处测定A值。以A值表示Bax、Bcl-2和Caspase-3蛋白表达水平。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组BTSCs的增殖率、凋亡率及Bax、Bcl-2和Caspase-3蛋白表达水平以x±s表示,各组间均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 神经球CD133和Nestin表达情况CD133免疫磁珠分选后的细胞在培养液中呈悬浮生长,约6 h开始形成小神经球,随培养时间延长神经球逐渐增大,约3d形成典型的神经球。免疫荧光染色法检测CD133和Nestin表达显示:神经球中CD133和Nestin均呈明显阳性表达。见图 1(插页五)。
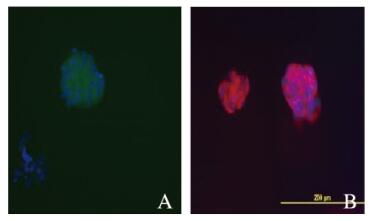
|
| 图 1 免疫荧光法检测神经球中CD133(A)和Nestin(B)表达(Bar=200 μm) Figure 1 Expressions of CD133(A) and Nestin(B) in neuroshperes detected by immunofluorescence method(Bar=200 μm) |
|
|
与对照组比较,200、400和800 mg·L-1SCP组SCP作用于BTSCs 24 h时,BTSCs的增殖率下降,尤其400和800 mg·L-1 SCP组细胞增殖率明显下降(P<0.05)。见表 1。
| (n=5, x±s, η/%) | ||
| Group | Dose(mg·L-1) | Proliferation rate |
| Control | 0 | 100.00±3.77 |
| SCP | 200 | 86.79±9.20 |
| 400 | 77.35±7.43* | |
| 800 | 73.58±7.41* | |
| *P < 0.05 compared with control group. | ||
800 mg·L-1SCP组SCP作用BTSCs 24 h时,细胞凋亡率为(9.28±2.35)%,与对照组(0.00%±0.27%)比较差异有统计学意义(P < 0.05)。见图 2。
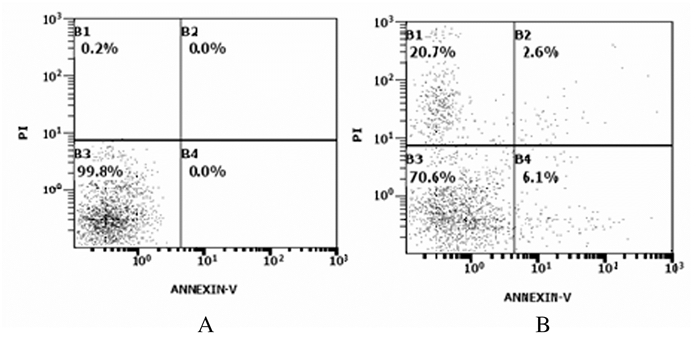
|
| A:Control group; B:800 mg·L-1 SCP group. 图 2 流式细胞术检测各组BTSCs凋亡率 Figure 2 Apoptotic rates of BTSCs in various groups detected by flow cytometry |
|
|
ELISA法检测结果显示:与对照组比较,各剂量SCP组BTSCs中Bax蛋白表达水平升高(P < 0.05),800 mg·L-1 SCP组Bcl-2蛋白表达水平降低(P < 0.05),各剂量SCP组Bax/Bcl-2比值明显升高(P < 0.05)。与对照组比较,各剂量SCP组Caspase-3蛋白表达水平升高,800 mg·L-1 SCP组差异有统计学意义(P < 0.01)。见表 2。
| (n=5, x±s) | |||||
| Group | Dose(mg·L-1) | Bax | Bcl-2 | Bax/Bcl-2 | Caspase-3 |
| Control | 0 | 0.71±0.06 | 2.34±0.10 | 0.31±0.06 | 1.60±0.48 |
| SCP | 200 | 1.26±0.04* | 2.20±0.02 | 0.57±1.28* | 1.73±0.49 |
| 400 | 1.41±0.09* | 2.18±0.26 | 0.64±0.03* | 1.75±0.25 | |
| 800 | 1.42±0.07* | 1.55±0.01* | 0.91±0.05* | 2.05±0.48** | |
| *P < 0.05, ** P < 0.01 compared with control group. | |||||
胶质瘤是中枢神经系统最为常见的原发性肿瘤,恶性程度极高[5]。近年来,恶性肿瘤发病率呈逐年上升的趋势,在脑肿瘤中以恶性胶质瘤发病率的升高最为明显[6]。一项多中心进行的分类调查[7]表明:中国的原发性脑肿瘤发病率为22.52/10万。其中,脑胶质瘤占29.78%。因此,如何有效地控制甚至治愈胶质瘤是亟待解决的难题。
五味子是一种五味俱全、五行相生的果实,其能对人体五脏——心、肝、脾、肺及肾发挥平衡作用。有研究[8]显示:五味子抗肿瘤活性主要集中在木脂素和多糖成分。20世纪90年代,众多学者从五味子水溶液中分离得到SCP,并对其药理活性进行了研究,发现其在保肝、提高免疫力、抗疲劳和抗肿瘤等[9-13]方面有广泛的应用前景。黄玲等[9]研究SCP抑瘤率及其对免疫器官的影响发现:SCP能抑制S180荷瘤的增长,并且呈现剂量依赖关系,抑瘤率可以达到74.5%。虽然已有SCP抗肿瘤的相关报道,但尚未见有关SCP对BTSCs生长的作用和机制的研究报道。
本课题组分离、提取原代脑胶质瘤细胞,利用CD133免疫磁珠分选法获得CD133+细胞,并进行神经球干细胞表面标记物CD133和Nestin检测,证实所用细胞为BTSCs。不同剂量SCP作用BTSCs时:200、400和800 mg·L-1SCP均可以抑制细胞的生长,尤其400和800 mg·L-1SCP组BTSCs的增殖率明显下降。以上结果表明:不同剂量SCP均可抑制BTSCs的生长,并且呈现明显的剂量效应。
细胞凋亡是广泛存在于生理和病理状态下的有序的受一系列基因严格控制的程序化死亡,是级联式基因表达的结果,肿瘤的发生可能是肿瘤细胞凋亡受阻所致[15-16]。本课题组采用Annexin Ⅴ-PI分析BTSCs凋亡率发现:与对照组比较,800 mg·L-1 SCP组细胞凋亡率明显升高;表明SCP可以诱导BTSCs发生凋亡。目前,在细胞凋亡研究中占主要地位的有2个信号途径,即线粒体途径和死亡受体途径[14]。在线粒体途径中Bax与Bcl-2始终倍受关注,两者的比值决定了细胞是否发生凋亡[17-19]。而Caspases家族是凋亡的主要执行者,其中,Caspases-3是其中最为关键的因子之一,其负责对凋亡最后阶段的关键性蛋白的酶切[20-22]。本实验结果显示:随着SCP剂量的升高,各剂量SCP组细胞中Bax蛋白和Caspase-3蛋白表达水平明显升高,Bcl-2蛋白表达水平减少,Bax/Bcl-2比值升高。因此SCP通过上调Bax/Bcl-2的比值促使BTSCs促凋亡因子占优势,活化Caspase-3增加,引起BTSCs发生凋亡,从而抑制了BTSCs的生长。
本实验针对五味子中抗癌多糖成分,研究SCP对BTSCs生长的抑制作用。通过研究发现其可剂量依赖性地抑制BTSCs的增殖。进一步研究发现:SCP诱导BTSCs凋亡可能是原因之一。但SCP抑制BTSCs的机制还需要深入研究。
| [1] | Wei W, Shin YS, Xue M, et al. Single-cell phosphoproteomics resolves adaptive signaling dynamics and informs targeted combination therapy in glioblastoma[J]. Cancer Cell, 2016, 29(4): 563–573. DOI:10.1016/j.ccell.2016.03.012 |
| [2] | Qi L, Bellail AC, Rossi MR, et al. Heterogeneity of primary glioblastoma cells in the expression of caspase-8 and the response to TRAIL-induced apoptosis[J]. Apoptosis, 2011, 16(11): 1150–1164. DOI:10.1007/s10495-011-0645-6 |
| [3] | Qi L, Ren K, Fang F, et al. Over expression of BCL2 and low expression of caspase 8 related to TRAIL resistance in brain cancer stem cells[J]. Asian Pac J Cancer Prev, 2015, 16(12): 4849–4852. DOI:10.7314/APJCP.2015.16.12.4849 |
| [4] | 温娜, 唐泽波, 袁瑞, 等. 五味子粗多糖对脑胶质瘤细胞生长的作用[J]. 中国老年学杂志, 2013, 33(12): 2837–2838. DOI:10.3969/j.issn.1005-9202.2013.12.046 |
| [5] | 师蔚, 郭振宇. 脑胶质瘤发病机制、诊断与治疗的研究进展[J]. 中华神经医学杂志, 2007, 6(9): 869–871. |
| [6] | Qi L, Yu HQ, Zhang Y, et al. A Comprehensive meta-analysis of genetic associations between key polymorphic loci in DNA repair genes and glioma risk[J]. Mol Neurobiol, 2017, 54(2): 1314–1325. DOI:10.1007/s12035-016-9725-5 |
| [7] | Jiang T, Tang GF, Lin Y, et al. Prevalence estimates for primary brain tumors in China:a multi-center cross-sectional study[J]. Chin Med J, 2011, 124(17): 2578–2583. |
| [8] | Chiu PY, Lam PY, Yan CW, et al. Schisandrin B protects against solar irradiation-induced oxidative injury in BJ human fibroblasts[J]. Fitoterapia, 2011, 82(4): 682–691. DOI:10.1016/j.fitote.2011.02.010 |
| [9] | 黄玲, 陈玲, 张振. 五味子多糖对荷瘤鼠瘤体抑制作用的病理学观察[J]. 中药材, 2004, 27(3): 202–203. |
| [10] | 任丽佳, 李林, 殷放宙, 等. 五味子抗肿瘤活性成分及作用机制研究进展[J]. 中国药理学通报, 2012, 28(1): 140–142. |
| [11] | 甘露. 五味子多糖对肝癌小鼠肿瘤生长及免疫功能的调节作用[J]. 免疫学杂志, 2013, 29(10): 867–870. |
| [12] | 栗爽, 李慧婷, 单会娇, 等. 五味子粗多糖抗疲劳药理作用的研究[J]. 实用中医内科杂志, 2009, 23(4): 27–28. |
| [13] | 苗明三. 五味子多糖对衰老模型小鼠的影响[J]. 中国医药学报, 2002, 17(3): 187–188. |
| [14] | Hardwick JM, Chen YB, Jonas EA. Multipolar functions of Bcl-2 proteins link energetics to apoptosis[J]. Trends Cell Biol, 2012, 22(6): 318–328. DOI:10.1016/j.tcb.2012.03.005 |
| [15] | Liu ZL, Jin BJ, Cheng CG, et al. Apatinib resensitizes cisplatin-resistant non-small cell lung carcinoma A549 cell through reversing multidrug resistance and suppressing ERK signaling pathway[J]. Eur Rev Med Pharmacol Sci, 2017, 21(23): 5370–5377. |
| [16] | Dai H, Ge S, Guo J, et al. Development of novel bis-pyrazole derivatives as antitumor agents with potent apoptosis induction effects and DNA damage[J]. Eur J Med Chem, 2018, 143: 1066–1076. DOI:10.1016/j.ejmech.2017.11.098 |
| [17] | Reed JC. Proapoptotic multidomain Bcl-2/Bax-family proteins mechanisms physiological roles and therapeutic opportunities[J]. Cell Death Differ, 2006, 13(8): 1378–1386. DOI:10.1038/sj.cdd.4401975 |
| [18] | 李军, 王国荣, 张秀芹, 等. 二苯乙烯苷对同型半胱氨酸诱导血管内皮细胞凋亡及bcl-2、bax、caspase-3表达的影响[J]. 中国病理生理杂志, 2013, 29(4): 743–747. |
| [19] | 马永臻. Bax、Bcl-2和Caspase-3在食管癌的表达及临床意义[J]. 中国老年学杂志, 2017, 37(14): 3484–3486. DOI:10.3969/j.issn.1005-9202.2017.14.046 |
| [20] | Zuo JH, Sun CH, Gao H, et al. Role of Bcl-2 and Bax in parotid gland atrophy[J]. Eur Rev Med Pharmacol Sci, 2017, 21(23): 5315–5320. |
| [21] | Liang X, Ni X, Wang Y, et al. Jinhong tablet reduces damage of intestinal mucosal barrier in rats with acute biliary infection via Bcl-2/Bax mRNA and protein regulation[J]. Evid Based Complement Alternat Med, 2017, 2017: 1–9. |
| [22] | 左俐俊, 任亚萍. 小鼠不同动情周期子宫内膜组织中Bcl-2、Bax和Caspase-9蛋白的表达[J]. 郑州大学学报:医学版, 2016, 51(2): 183–186. |
 2018, Vol. 44
2018, Vol. 44


