扩展功能
文章信息
- 杨昕祺, 王广红, 糜心雅, 安丽萍, 杜培革, 王曼力
- YANG Xinqi, WANG Guanghong, MI Xinya, AN Liping, DU Peige, WANG Manli
- 脑蛋白水解物对H2O2诱导的PC12细胞氧化损伤的修复作用及其胃漂浮片处方的优化
- Repair effect of brain protein hydrolysate on H2O2-induced oxidative damage in PC12 cells and optimization of formulation of its stomach floating tablets
- 吉林大学学报(医学版), 2018, 44(02): 286-291
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 286-291
- 10.13481/j.1671-587x.20180215
-
文章历史
- 收稿日期: 2017-11-15
由动物脑组织中提取分离所得,内含小分子多肽、神经营养因子和游离氨基酸等活性成分[1]。研究[2-3]显示:BPH可跨过血脑屏障作用于中枢神经系统,具有增加脑活性、保护神经细胞免受缺血、低氧和神经毒素等损害的作用,并对神经退行性疾病有良好疗效。BPH中含有的肽类及氨基酸等有效物质,在小肠中上部无菌部位通过主动转运被小肠上皮细胞吸收,因此滞留时间越长吸收越好[4-5]。目前国内外对BPH的剂型研究仅限于注射剂和片剂,剂型过于单一而常规片剂通过无菌部位时间仅为2~3 h,对多数口服制剂来说胃肠滞留时间相对过短,因此许多药物未被释放完全就已通过吸收部位,导致生物利用度不高,并且由于胃排空的个体差异较大,使某些药物的药效差异显著[6-8]。本研究通过BPH在人工胃液、肠液处理后对H2O2诱导的PC12细胞氧化损伤修复作用的对比,制备BPH胃漂浮片剂,观察其胃肠滞留时间,并运用星点设计-效应面法优化BPH胃漂浮片处方,为该成分的有效利用提供参考。
1 材料与方法 1.1 主要试剂与仪器BPH (长春长庆药业),BPH片(黑龙江江世药业有限公司),PC12细胞(通派上海生物科技有限公司),十八醇(湖南尔康制药股份有限公司,批号:105220140801),羟丙甲纤维素HPMC-K4M (安徽山河药用辅料股份有限公司,批号:F20072003),聚丙烯酸树脂Ⅱ (安徽山河药用辅料股份有限公司,批号:F20090001),乳糖(曲阜市天利药用辅料有限公司,批号:20110106),硬脂酸镁(郑州亨多宝化工有限公司,批号:G20130358),微晶纤维素(曲阜市天利药用辅料有限公司,批号:20140305),MTT (北京鼎国昌盛生物技术有限责任公司, 批号:51L10156),H2O2 (沈阳市华东试剂厂,批号:20121009),胎牛血清(天津市灏洋生物制品科技有限公司)。TDP-5型单冲压片机(长沙市云麓区中南制药机械厂),电热恒温水浴锅(上海博讯实业有限公司医疗设备厂),MODEL LD310-2电子天平(沈阳龙腾电子有限公司),SY-6D型片剂四用测定仪(常州锐品精密仪器有限公司),实验室微型喷雾干燥机L-117 (北京来亨科贸有限公司技术开发中心)。
1.2 细胞培养PC12细胞由上海生物科技有限公司提供。PC12细胞采用含10% FBS的DMEM在37℃、5% CO2的培养箱中常规培养。
1.3 BPH对正常PC12细胞的作用取对数生长期的PC12细胞(1.0×105mL-1)分为正常对照组和给药组,另设空白对照组。正常对照组和给药组每孔加入100 μL细胞悬液,接种到96孔板中,空白对照组只加100 μL培养基,设置3个复孔。24 h后空白对照组、正常对照组每孔加入100 μL培养基,给药组加入100 μL不同浓度(20、40、60和120 mg·L-1) BPH,再培养24 h后加20 μL、0.5 g·L-1的MTT,培养2 h,去除培养液,各孔分别加入100 μL DMSO,37℃下孵育5min,于酶标仪550 nm处测定吸光度(A)值,计算细胞活力。细胞活力=(给药组A值-空白对照组A值)/(正常对照组A值-空白对照组A值)×100%。
1.4 H2O2诱导PC12细胞氧化损伤模型的建立取对数生长期的PC12细胞分为正常对照组和模型组,另设空白对照组。正常对照组和模型组每孔加入100 μL细胞悬液,空白对照组加100 μL培养基,设置3个复孔。24 h后向模型组加入梯度浓度(100、200、300、400和500 μmol·L-1)的H2O2溶液100 μL,空白对照组和正常对照组每孔加入培养基100 μL,采用MTT法,在1、2、3、4和5 h时检测A值,计算细胞活力。选择细胞活力为65%时的条件为最佳损伤条件。
1.5 BPH在不同条件下对PC12细胞氧化损伤的作用取对数生长期的PC12细胞分为BPH组、人工胃液处理的BPH(GBPH)组、人工肠液处理的BPH (IBPH)组、人工胃液处理的BPH片(GBPH-T)组和人工胃液处理的BPH漂浮片(GBPH-FT)组,接种到96孔板中,设置3个复孔,每孔加入100 μL细胞悬液;另设空白对照组,只加100 μL培养基。24 h后空白对照组和正常对照组每孔加入100 μL培养基,其余各组加入以上处理的BPH 100 μL,浓度为20、40、60、80和100 mg·L-1,再培养24h后用300 μmol·L-1的H2O2损伤3 h,采用MTT法于酶标仪550 nm处检测A值,计算细胞活力,细胞活力越高氧化损伤修复水平越高。
1.6 BPH胃漂浮片的制备将BPH喷成固体粉末。十八醇在60℃熔融,加入丙烯酸树脂Ⅱ号和HPMC-K4M质量的2/3立即用16目筛制粒,剩余的HKMC-K4M与乳糖、微晶纤维素和BPH湿法制粒。2次制得的粒混合后干燥,整粒,加0.3%硬脂酸镁,压片。
1.7 体外漂浮性能的观察取6片放入(37±0.5) ℃的人工胃液中,模拟胃蠕动。记录起漂时间与持续漂浮时间,观察漂浮性。每片的起漂时间均<5 s,持续漂浮时间>8 h,说明漂浮性能良好。
1.8 体外释放度的测定建立标准曲线:精密称取对照品,用人工胃液配成浓度为1.02、2.03、4.06、8.13、16.25和32.50 mg·L-1的标准溶液,于254 nm波长处测定A值,以A值对浓度(C)进行线性回归,其方程为A=0.0158C+0.1943;r2=0.9991 (n=6)。对照品为1.02~32.50 mg·L-1,其A值与浓度具有良好的线性关系。释放度测定方法:根据《中国药典》2015年版四部释放度测定法[9]第一法进行测定。转速50 r·min-1,温度(37±0.5) ℃,人工胃液1000 mL为溶出介质,分别在第2、5和8 h取样20 mL,过0.45 μm微孔滤膜,于254 nm测A值,代入标准曲线方程,求出浓度并计算累计释放度。累计释放度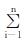
由预实验确定BPH 20 mg、乳糖10 mg和微晶纤维素20mg为固定含量。十八醇(X1)、HPMC-K4M (X2)和丙烯酸树脂Ⅱ号(X3)质量为考察因素,其8 h的累计释放度为指标,用Design-expert 8.0.6 Trial按水平编码表进行3因素3水平试验。模型拟合:根据显著性(P < 0.05)以及R2,优选出二次模型方程为最佳拟合方程。并对其各项系数进行方差分析。响应面及优化处方[10]:根据拟合方程,固定一个变量后对其余2个变量以8 h总释放度对其影响做曲面图和等高线图。
1.10 处方验证进行3次平行实验,验证最佳处方的可行性。比较8 h总释放度的预测值和实测值。
1.11 统计学分析采用SPSS 16.0统计软件进行统计学分析。所有计量资料均符合正态分布,各组细胞活力水平以x ±s表示,多组样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
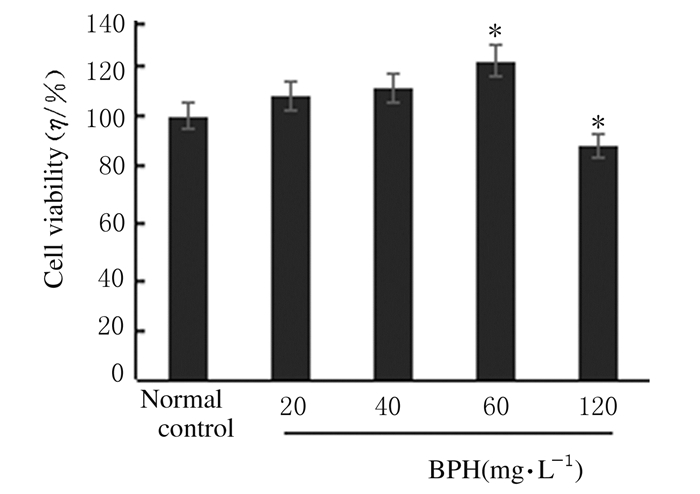
2 结果 2.1 BPH作用下各组PC12细胞活力与正常对照组比较,60 mg·L-1BPH组细胞活力明显升高(121.17%±1.80%) (P < 0.05),120 mg·L-1BPH组细胞活力时明显降低(89.61%±1.70%)(P < 0.05)。见图 1。
|
| *P < 0.05 vs normal control group. 图 1 MTT法检测各组PC12细胞活力 Figure 1 Viabilities of PC12 cells in various groups detected by MTT assay |
|
|
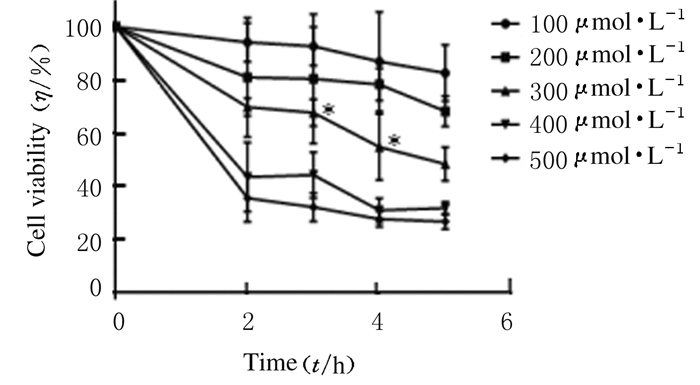
与正常对照组比较,300 μmol·L-1H2O2组损伤3 h时,细胞活力为(65.37%±0.90%) (P < 0.05),为最佳条件,其他各组细胞活力均未达到65%。见图 2。
|
| *P < 0.05 vs normal control group. 图 2 H2O2作用下各组PC12细胞活力 Figure 2 Viabilities of PC12 cells in various groups after treated with H2O2 |
|
|
与模型组比较,60 mg·L-1BPH组和GBPH-FT组细胞活力明显升高(P < 0.01),IBPH组和GBPH组细胞活力升高(P < 0.05);与BPH组比较,IBPH组细胞活力降低(P < 0.05),GBPH组细胞活力差异无统计学意义(P>0.05);与GBPH-T组比较,GBPH-FT组细胞活力明显升高(P < 0.05)。见表 1。
| (n=3, x±s, η/%) | ||||||
| Group | Cell viability | |||||
| (mg·L-1) 0 | 20 | 40 | 60 | 80 | 100 | |
| Model | 65.37±0.90 | - | - | - | - | - |
| BPH | - | 79.61±1.98 | 83.69±3.27* | 96.37±1.78** | 87.10±3.14* | 82.47±3.56 |
| GBPH | - | 73.23±2.13 | 79.77±3.16 | 89.43±2.64* | 81.56±2.23 | 78.64±0.17 |
| IBPH | - | 70.65±3.54 | 74.68±1.89 | 82.83±2.24*△ | 77.45±1.66 | 74.32±1.64 |
| GBPH-T | - | 71.46±1.64 | 76.15±4.69 | 85.23±3.14* | 79.68±1.16 | 76.65±2.13 |
| GBPH-FT | - | 75.61±3.25 | 80.35±0.67 | 93.53±2.45**# | 83.93±4.36 | 80.31±3.61 |
| *P < 0.05,* * P < 0.01 vs model group;△P < 0.05vs BPH group;#P < 0.05 vs GBPH-T group.“-”:No data. | ||||||
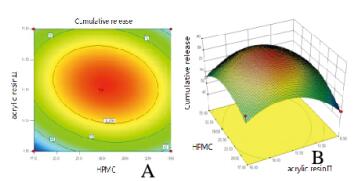
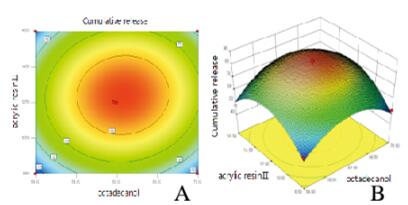
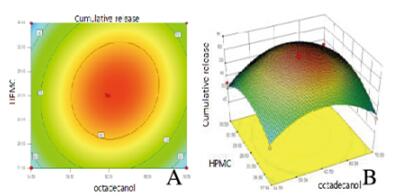
根据星点设计实验水平编码表和实验结果以及曲面图和等高线图,t检验在P < 0.05水平上简化得到拟合方程:y=-1170.29515+31.17345X1+6.52281X2+28.42872X3+0.047361X1X2+0.048359X1X3-0.11451X2X3-0.26182X12-0.14885X22-0.10181X32(R2=0.9636),F=20.60,P=0.0003<0.05,表明该模型高度显著,失拟度和拟合度良好,实验误差小,有较高的可信度[11-12]。可用其对BPH胃漂浮片的工艺进行分析和预测。通过对回归模型方程计算,最大释放率为85.4377%;BPH胃漂浮片最佳处方为HPMC-K4M27 mg,十八醇63 mg,丙烯酸树脂Ⅱ号13 mg,BPH 20 mg,乳糖10 mg,微晶纤维素20 mg,硬脂酸镁0.4 mg。水平编码表见表 2,实验结果见表 3,方差分析见表 4。曲面图和等高线图见图 3~5(插页五)。
| Horizontal coding | Factor | ||
| X1(mg) | X2 (mg) | X3(mg) | |
| 1 | 70.5 | 35.5 | 16.5 |
| 0 | 62.5 | 26.0 | 12.5 |
| -1 | 54.5 | 17.5 | 8.5 |
| Test number | X1 | X2 | X3 | Cumulative release(η/%) |
| 1 | -1 | 1 | 0 | 55.13 |
| 2 | -1 | -1 | 0 | 52.67 |
| 3 | 0 | 1 | -1 | 51.79 |
| 4 | 0 | 0 | 0 | 85.76 |
| 5 | 0 | 0 | 0 | 86.83 |
| 6 | 0 | -1 | 1 | 67.34 |
| 7 | 0 | 0 | 0 | 85.16 |
| 8 | 1 | -1 | 0 | 50.68 |
| 9 | -1 | 0 | -1 | 48.91 |
| 10 | 0 | 0 | 0 | 83.13 |
| 11 | 0 | 0 | 0 | 84.76 |
| 12 | -1 | 0 | 1 | 47.63 |
| 13 | 1 | 0 | -1 | 50.76 |
| 14 | 1 | 1 | 0 | 66.78 |
| 15 | 1 | 0 | 1 | 56.71 |
| 16 | 0 | 1 | 1 | 55.67 |
| 17 | 0 | -1 | -1 | 46.97 |
| Source of variance | SS | DF | MF | F | P |
| Model | 3741.33 | 9 | 415.70 | 20.60 | 0.000 3 |
| A-X1 | 47.78 | 1 | 47.78 | 2.37 | 0.167 8 |
| B-X2 | 17.14 | 1 | 17.14 | 0.85 | 0.387 4 |
| C-X3 | 97.16 | 1 | 97.16 | 4.81 | 0.064 3 |
| X1X2 | 46.51 | 1 | 46.51 | 2.30 | 0.172 8 |
| X1X3 | 9.58 | 1 | 9.58 | 0.47 | 0.513 1 |
| X2X3 | 67.98 | 1 | 67.98 | 3.37 | 0.109 1 |
| X12 | 1 182.23 | 1 | 1 182.23 | 58.57 | 0.000 1 |
| X22 | 612.04 | 1 | 612.04 | 30.32 | 0.000 9 |
| X32 | 1 308.55 | 1 | 1 308.55 | 64.83 | 0.000 1 |
| Residual | 141.29 | 7 | 20.18 | - | - |
| Lack of fit test | 133.86 | 3 | 44.62 | 24.04 | 0.005 1 |
| Pure error | 7.42 | 4 | 1.86 | - | - |
| Total error | 3 882.62 | 16 | - | - | - |
| “-”:No data. | |||||
|
| 图 3 y=f (X2,X3)等高线(A)和响应曲面(B) Figure 3 y=f (X2, X3)contour lines(A) and response surfaces(B) |
|
|
|
| 图 4 y=f (X1,X3)等高线(A)和响应曲面(B) Figure 4 y=f (X1, X3)contour lines(A) and response surfaces(B) |
|
|
|
| 图 5 y=f (X1,X2)等高线(A)和响应曲面(B) Figure 5 y=f (X1, X2)contour lines(A) and response surfaces(B) |
|
|
药物累积释放度的实测值与预测值偏差 < 5%,非常接近,BPH胃漂浮片漂浮滞后时间均 < 5 s,持续漂浮时间>8 h。见表 5。
| (η/%) | |
| Factor | Q8h |
| Predicted value | 85.437 7 |
| Actual value | 87.461 3±2.600 0 |
| Deviation | 2.4 |
BPH含有的成分具有修复脑神经元的作用,能够促进脑蛋白合成和突触形成,诱导神经元分化进而改善神经元代谢,并可增加脑内葡萄糖及氧的利用, 促进脑功能的恢复[13-14]。研究[15-16]表明:PC12细胞源于生成神经系统的外胚层,具有某些神经元的特征,是比较理想的细胞模型,主要用于评价各类药物对神经元氧化损伤的影响。因此本研究选用PC12细胞并建立H2O2对PC12细胞氧化损伤模型,结果表明:在60 mg·L-1浓度时BPH不仅对正常PC12细胞有很好的增殖作用,而且对损伤细胞有明显的修复作用,同时与人工肠液相比,人工胃液环境处理的BPH的修复作用与BPH对损伤细胞修复作用最为接近,证明BPH在胃环境下可以稳定存在,使BPH胃漂浮片剂的研制成为可能。
BPH相对分子质量小并易被肾小球滤过,导致体内循环的半衰期过短,这样不仅达不到疗效还需要多次注射给药才能稳定药效,造成治疗成本高并且患者顺应性差[17]。而本文作者研制的BPH胃漂浮片剂可以充分延长胃滞留时间,从而提高小肠上皮细胞吸收药物,释放的药物以溶液状态大量到达无菌部位,通过主动转运跨越生物膜,促进细胞的代谢调节功能,能很好地提高生物利用度,从而减少多次给药降低治疗成本并提高患者顺应性,在神经退行性疾病治疗中具有较强的应用潜力。本实验运用的星点设计-效应面法在药学领域是新型的设计实验方法,实验次数少且精确度高,能科学有效处理处方辅料因素的影响[18]。根据星点设计-响应面法拟合方程(P < 0.05,R2=0.9636),模型显著性及拟合度良好,实验误差小,方差分析结果显示:十八醇是影响漂浮片的体外释放的最显著因素,HPMC-K4M和丙烯酸树脂Ⅱ号分别次之。制成的漂浮片可持续漂浮8 h,充分延长了胃内滞留时间,体外释放率可达85.4377%,释放充分而且药效与BPH片对比能得到更好的利用。与BPH片比较,研制成的漂浮片剂与在人工胃环境中能更好地抑制H2O2引起的PC12细胞活力降低。
处方中HPMC-K4M在漂浮片中含量越少, 漂浮片的密度越低、十八醇密度较低、质量小, 且越多在水中越呈不溶性, 在HPMC-K4M形成的凝胶体制中, 一定程度上起助漂作用[19];丙烯酸树脂Ⅱ号可用于增加药物的稳定性,改变药物的释放性能[20];乳糖作为致孔剂并有水溶性,可增加药物的缓释作用[21]。本实验为今后的BPH活性探讨及其胃漂浮制剂处方优化和辅料研究等提供了参考。
| [1] | 魏婧, 马玉玲, 邵晓彤, 等. 脑蛋白水解物对小鼠记忆巩固能力的影响及机制[J]. 中国老年学杂志, 2015, 35(9): 2362–2365. |
| [2] | Liu Z, Zhou T, Ziegler A, et al. Oxidative stress in neurodegenerative diseases:From molecular mechanisms to clinical applications[J]. Oxid Med Cell Longev, 2017, 2017: 2525967. |
| [3] | Acosta SA, Tajiri N, Sanberg PR, et al. Increased amyloid precursor protein and tau expression manifests as key secondary cell death in chronic traumatic brain injury[J]. Cell Physiol, 2017, 232(3): 665–677. DOI:10.1002/jcp.25629 |
| [4] | 李倩. 反刍动物小肽的吸收及营养生理研究进展[J]. 广东农业科学, 2011, 38(16): 99–101, 110. DOI:10.3969/j.issn.1004-874X.2011.16.038 |
| [5] | 张婵, 侯威, 王成涛, 等. 高F值活性肽的生物活性、制备技术及吸收评价技术的研究进展[J]. 食品安全质量检测学报, 2014, 5(1): 131–135. |
| [6] | Bomma R, Swamy Naidu RA, Yamsani MR, et al. Development and evaluation of gastroretentive norfloxacin floating ablets[J]. Acta Pharm, 2009, 59(2): 211–221. |
| [7] | 吴黛丽. 脑蛋白水解物制剂的质量标准及不良反应[J]. 生物技术世界, 2015(7): 136. |
| [8] | 卢芳, 井月娥, 任燕冬, 等. 星点设计-效应面法优化复方拜颤停片剂的处方[J]. 中国中医药信息杂志, 2016, 23(7): 87–91. |
| [9] | 国家药典委员会. 中华人民共和国药典:四部[M]. 北京: 中国医药科技出版社,2015: 通则0931. |
| [10] | 杜娟, 林宁. 星点设计-效应面法优化尼可地尔胃漂浮缓释片制剂处方[J]. 中国医院药学杂志, 2016, 36(4): 293–296. |
| [11] | 王双双, 刘睿, 何新. 星点设计-效应面法优化桔梗泡腾片的处方[J]. 中国实验方剂学杂志, 2016, 22(12): 23–27. |
| [12] | Raza A, Bukhari NI, Karim S, et al. Floating tablets of minocycline hydrochloride:Formulation, in-vitro evaluation and optimization[J]. Future J Pharmaceut Sci, 2017, 3(2): 131–139. DOI:10.1016/j.fjps.2017.05.001 |
| [13] | 王月古, 陈鸣. 脑蛋白水解物治疗缺血性脑血管病的临床疗效及对神经功能的影响分析[J]. 中国处方药, 2017, 15(7): 72–73. |
| [14] | Rah YC, Yoo MH, Choi J, et al. In vivo assessment of hair cell damage and developmental toxicity caused by gestational caffeine exposure using zebrafish (Danio rerio) models[J]. Neurotoxicol Teratol, 2017, 64: 1–7. DOI:10.1016/j.ntt.2017.08.003 |
| [15] | 刘静波, 刘文超, 徐梦蕾, 等. 基于PC12细胞模型分析大豆蛋白水解物对神经元氧化损伤的保护作用[J]. 现代食品科技, 2015, 31(4): 8–12, 57. |
| [16] | Zeng Z, Xu J, Zheng W. Artemisinin protects PC12 cells against β-amyloid-induced apoptosis through activation of the ERK1/2 signaling pathway[J]. Redox Biol, 2017, 12: 625–633. DOI:10.1016/j.redox.2017.04.003 |
| [17] | 张荣华. 脑蛋白水解物类药物研究进展[J]. 大家健康:学术版, 2013(19): 206–207. |
| [18] | 胡静, 周卫. 星点设计-效应面法对帕利哌酮渗透泵控释片处方的优化[J]. 中国医院药学杂志, 2016(16): 1369–1374. |
| [19] | Patel SG, Bummer PM. Development of a robust method for simultaneous quantification of polymer(HPMC) and surfactant(dodecyl β-D-maltoside) in nanosuspensions[J]. AAPS Pharm Sci Tech, 2016, 17(5): 1182–1191. DOI:10.1208/s12249-015-0451-5 |
| [20] | 李樾, 刘艳林, 贺瑞玲, 等. 首批聚丙烯酸树脂Ⅱ国家标准物质的研制与建立[J]. 药物分析杂志, 2013, 33(3): 514–516. |
| [21] | Tan S, Jiang T, Ebrahimi A, et al. Effect of spray-drying temperature on the formation of flower-like lactose for griseofulvin loading[J]. Eur J Pharm Sci, 2018, 111: 534–539. DOI:10.1016/j.ejps.2017.10.040 |
 2018, Vol. 44
2018, Vol. 44


