扩展功能
文章信息
- 刘杰, 布文奂, 赵欢, 李杏, 孟琳, 董悦, 孙宏晨
- LIU Jie, BU Wenhuan, ZHAO Huan, LI Xing, MENG Lin, DONG Yue, SUN Hongchen
- 叶酸-聚乙烯亚胺复合碳点的跨膜机制和胞内分布
- Transmembrane mechanism and intracellular trafficking of folic acid-polyethyleneimine carbon dots
- 吉林大学学报(医学版), 2018, 44(02): 254-259
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 254-259
- 10.13481/j.1671-587x.20180209
-
文章历史
- 收稿日期: 2017-07-27
2. 吉林大学口腔医院口腔病理科, 吉林 长春 130021;
3. 佳木斯大学口腔医院正畸科, 黑龙江 佳木斯 154007
2. Department of Oral Pathology, Stomatology Hospital, Jilin University, Changchun 130021, China;
3. Department of Orthodontics, Stomatology Hospital, Jiamusi University, Jiamusi 154007, China
碳点(carbon dots, CDs)是一种新型的纳米材料,具有尺寸较小、比表面积较大、表面活性良好和生物毒性较低等优点,被越来越广泛地应用到生物医学领域。许多碳点具有光致发光的特点,可被用于生物传感和生物成像中[1]。在转基因治疗领域,碳点作为一种非病毒载体,不易与染色体整合,免疫反应少,易于制备,还具有细胞成像的功能,与病毒载体相比具有诸多优势[2]。目前针对纳米材料跨膜转运和胞内分布的研究[3-4]较多,但是对碳点跨成骨细胞膜转运的机制和胞内分布的研究尚未见报道,这可能是碳点作为一种基因载体在骨缺损治疗中应用的难点[5]。本实验以叶酸和聚乙烯亚胺(polyethelenimice, PEI)为原料,通过一步完成的水热法合成荧光碳点,阐明碳点进入小鼠前成骨细胞系MC3T3-E1的方式以及在细胞内的分布,为碳点作为一种非病毒载体在转基因治疗中的应用提供实践基础。
1 材料与方法 1.1 细胞系、主要试剂和仪器小鼠前成骨细胞系MC3T3-E1(Gibco公司,美国)。高糖DMEM培养基粉、胎牛血清(FBS)和青霉素-链霉素溶液(Gibco公司,美国),4-羟乙基哌嗪乙磺酸(HEPES)、胰蛋白酶粉剂、MTT粉剂、活性氧(ROS)染剂、叶酸和PEI(相对分子质量为1800)(Sigma-Aldrich公司,美国),细胞器染剂和细胞凋亡试剂盒(Invitrogen公司,美国),细胞周期试剂盒(七海生物公司,中国)。倒置荧光显微镜及照相系统(Olympus公司,日本),酶标仪(RT-6000,深圳雷杜生命科学技术有限公司)。
1.2 细胞培养MC3T3-E1细胞系培养在含有10%胎牛血清、100U·mL-1青霉素和100 mg·L-1链霉素的高糖DMEM培养基中,在温度为37℃、5%CO2条件下培养,每2~3 d培养基换液。
1.3 碳点制备称取2 g叶酸溶于20 mL去离子水中,滴加1 mol·L-1的NaOH助溶,随后向澄清的黄色溶液中加入3 mL的PEI(相对分子质量为1800),于200℃无氧条件下反应5h,冷却至室温后3000 r·min-1离心30 min,去上清,用0.22 μm的滤器抽滤去除较大的颗粒,随后渗析3d,每12~24 h换水,冻干后即可获得粉末状的叶酸-PEI复合碳点。
1.4 MTT法检测细胞增殖率将处于对数生长期的MC3T3-E1细胞系在胰酶消化后离心重悬,以每孔4000个细胞的密度接种到96孔板内,在37℃、5%CO2孵箱内孵育24h。然后换液使培养基中碳点的浓度为0、50、100、150、200、250、300、350、400和450 mg·L-1,每个剂量设置6个复孔,同时设置调零孔以减少误差。分别培养24和48h后在各孔加入20 μL的MTT液(5000 mg·L-1),37℃孵育4 h后弃去培养基,每孔加入150μL二甲基亚砜(DMSO)并在摇床上混匀,酶标仪在490 nm波长处检测吸光度(A)值,并按照公式计算细胞增殖率。细胞增殖率=实验组A值/空白对照组A值×100%。
1.5 流式细胞术检测细胞周期将处于对数生长期的MC3T3-E1细胞系在胰酶消化后离心重悬,以每孔8×104个细胞的密度接种至6孔板内,在37℃、5%CO2孵箱内孵育24h。换液使碳点组碳点的浓度为100 mg·L-1,实验组和空白对照组各有3个复孔。24h后胰酶消化并离心,PBS冲洗2次后用70%乙醇在4℃固定2h以上,用含碘化丙啶和RNase A的染液37℃避光染色30min,流式细胞仪检测(激发波长488nm,检测红色荧光),以处于各周期细胞数占总细胞数的百分比来表示结果。
1.6 流式细胞术检测细胞凋亡将处于对数生长期的MC3T3-E1细胞系在胰酶消化后离心重悬,以每孔8×104个细胞的密度接种至6孔板内,在37℃、5%CO2孵箱内孵育24h。将MC3T3-E1细胞系分为空白对照组、叶酸组和碳点组。换液使碳点组碳点的浓度为100 mg·L-1,实验组和空白对照组各有3个复孔,同时设置3个其他的孔来帮助流式设门。24h后胰酶消化并离心(使用原来含血清的培养基终止胰酶消化以保留培养基中未贴壁的细胞),PBS冲洗后使用碘化丙啶和Annexin Ⅴ-FITC对细胞进行染色,30 min内流式细胞仪检测,Annexin Ⅴ-FITC为绿色荧光,碘化丙啶为红色荧光。以正常细胞、坏死细胞、早期凋亡和晚期凋亡细胞数占总细胞数的百分构成比来表示。
1.7 流式细胞术检测细胞ROS水平将处于对数生长期的MC3T3-E1细胞系在胰酶消化后离心重悬,以每孔8×104个细胞的密度接种至6孔板内,在37℃、5%CO2的孵箱内孵育24h。换液使叶酸组和碳点组浓度均为100 mg·L-1,各组均设有3个复孔,同时设置1个未染色的孔来消除细胞背底荧光的干扰,染色后上流式细胞仪通过FITC通道来检测荧光强度。以叶酸组和碳点组荧光强度与空白对照组荧光强度的比值来表示细胞ROS水平。
1.8 显微细胞成像将处于对数生长期的MC3T3-E1细胞系在胰酶消化后离心重悬,以每孔8×104个细胞的密度接种至放置有盖玻片的6孔板内,在37℃、5%CO2的孵箱内孵育24h。换液使碳点的终浓度为100 mg·L-1,在37℃、5%CO2的孵箱里再继续孵育4h,PBS冲洗后用4%甲醛37℃固定15min,应用倒置荧光显微镜使用紫外光激发进行观察和拍照。统一碳点的浓度为80 mg·L-1,各组分别共孵育0、15、30、60、120和240 min后用PBS冲洗,并用4%甲醛37℃固定15 min,应用倒置荧光显微镜观察和拍照。
1.9 检测碳点内吞的途径将处于对数生长期的MC3T3-E1细胞系在胰酶消化后离心重悬,以每孔8×104个细胞的密度接种到放置有盖玻片的6孔板内,在37℃、5%CO2孵箱内孵育24 h。设置阴性对照组(无碳点)和空白对照组(100 mg·L-1的碳点),每组3个复孔,同时利用制霉菌素抑制胞膜窖途径[6]和诺考达唑抑制巨胞饮作用[7],4℃孵育来抑制能量依赖性的内吞作用,无血清条件下预处理45min后加入碳点和血清使碳点终浓度为100 mg·L-1,再孵育1h后胰酶消化、离心重悬并上流式细胞仪检测蓝色荧光强度。以碳点加各种抑制剂组碳点的细胞摄取率与空白对照组碳点的细胞摄取率的比值来表示结果。
1.10 检测碳点在细胞内的定位将处于对数生长期的MC3T3-E1细胞系在胰酶消化后离心重悬,以每孔8×104个细胞的密度接种到放置有盖玻片的6孔板内,在37℃、5%CO2孵箱内孵育24 h。换液使碳点终浓度为100 mg·L-1,共孵育1h后换液,然后对各细胞器进行染色。内质网在37℃染色30min后在37℃、4%甲醛中固定2min;线粒体在37℃染色30min后在37℃、4%甲醛中固定15min;溶酶体在37℃染色60min后在37℃固定15min;高尔基体在37℃、5%CO2孵箱孵育过夜染色(≥16h)后于室温用4%甲醛固定30min。PBS冲洗后上荧光倒置显微镜观察拍照,蓝色荧光的是碳点,红色荧光表示各细胞器,紫色荧光表示碳点分布至相应细胞器上。
1.11 统计学分析采用SPSS10.00统计软件进行统计学分析。各组细胞增殖率、各周期细胞比例、ROS水平和碳点摄取率以x±s表示,各组样本均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 碳点的细胞毒性和细胞增殖率在MTT实验中,与空白对照组比较,不同浓度碳点组在24h时未表现出细胞毒性,100~450 mg·L-1碳点组细胞增殖率差异均有统计学意义(P<0.05);当碳点浓度达到450 mg·L-1时,细胞增殖率仍高于空白对照组(P<0.05);在48h时间点时,随着碳点浓度的增加,细胞增殖率先增高后降低,当碳点浓度达到350 mg·L-1时,细胞增殖率仅有空白对照组的68.4%(P<0.05),表现出明显的细胞毒性。细胞周期检测结果显示:与空白对照组比较,100 mg·L-1碳点组细胞共孵育后24h细胞从G0期和G1期向S期转变增加,并且G2期和M期细胞比例也升高。见表 1和2。
| (n=4, x±s, η/%) | ||
| Group | Proliferation rate | |
| (t/h) 24 | 48 | |
| Blank control | 100.00±9.28 | 100.00±7.36 |
| CDs(mg·L-1) | ||
| 50 | 107.16±3.56 | 117.84±0.75* |
| 100 | 123.78±2.09* | 171.37±4.81* |
| 150 | 134.10±9.31* | 146.86±9.19* |
| 200 | 149.86±13.89* | 146.08±6.53* |
| 250 | 163.61±17.74* | 112.94±9.04 |
| 300 | 143.27±12.24* | 92.16±10.44 |
| 350 | 126.65±6.91* | 68.63±12.64* |
| 400 | 120.63±4.71* | 68.14±23.84* |
| 450 | 122.92±2.87* | 67.55±4.20* |
| *P < 0.05 compared with blank control group. | ||
| (n=3, x±s, η/%) | |||
| Group | Percentage of cells | ||
| G0 and G1 phase | S phase | G2 and M phase | |
| Blank control | 44.25±0.60 | 39.62±0.51 | 14.60±0.35 |
| CDs | 41.82±1.40* | 41.07±0.45* | 15.54±1.10 |
| *P < 0.05 compared with blank control group. | |||
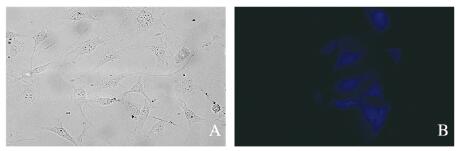
碳点被紫外光激发可以发射蓝色荧光,因此可被用于细胞成像,并且在相同的曝光时间内蓝色荧光的荧光强度越高,表示有越多的碳点被细胞摄取。碳点被细胞摄取后主要分布在细胞质中,能够较好地显示细胞的形态。见图 1(插页四)。
|
| A: Visible light; B:Ultraviolet light. 图 1 碳点在MC3T3-E1细胞内的成像(×400) Figure 1 Imaging of CDs in MC3T3-E1 cells(×400) |
|
|
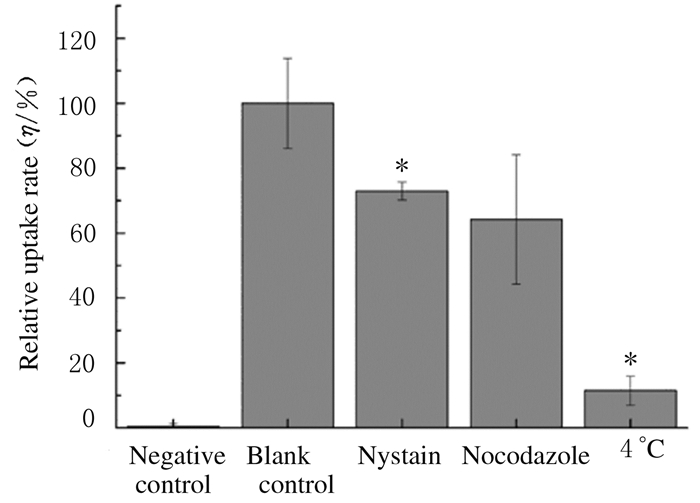
抑制剂实验结果显示:阴性对照组无碳点,因此几乎检测不到荧光,摄取率几乎为0;空白对照组有碳点但未应用抑制剂,相对摄取率为100%;当采用胞膜窖的抑制剂制霉菌素作用于细胞时,与空白对照组比较,制霉菌素组细胞摄取碳点量减少(P<0.05);当用巨胞饮的抑制剂诺考达唑抑制巨胞饮途径时,细胞摄取碳点的量也减少,但差异无统计学意义(P>0.05);当将细胞置于4℃以抑制能量依赖性的内吞途径时,与空白对照组比较,细胞摄取碳点量明显减少(P<0.05),但尚有碳点能够被细胞摄取。各组MC3T3-E1细胞摄取碳点的定量分析结果见图 2。
|
| 图 2 各组MC3T3-E1细胞摄取碳点的定量分析 Figure 2 Quantitative analysis of CDs uptaken in MC3T3-E1 cells in various groups |
|
|
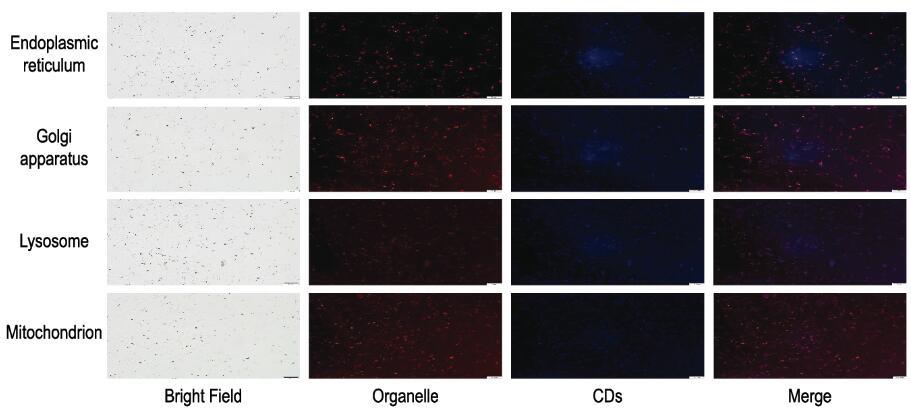
碳点被紫外光激发可以发射蓝色荧光,各细胞器的染色剂在绿光激发下可以发射红色荧光,当蓝色荧光与红色荧光重叠产生紫色荧光时,可以说明碳点在细胞器上分布的情况[8-10]。倒置荧光显微镜下观察:碳点的蓝色荧光与线粒体的红色荧光较好重叠,提示碳点能够在线粒体上较多地分布;碳点的蓝色荧光与溶酶体的红色荧光较好重叠,提示碳点能够在溶酶体上较多地分布;碳点的蓝色荧光与内质网的红色荧光不完全重叠,提示碳点能够在内质网上分布;碳点的蓝色荧光与高尔基体的红色荧光重叠得较差,提示碳点在高尔基体上分布较少或者细胞内高尔基体的数量较少。见图 3(插页四)。
|
| 图 3 碳点在MC3T3-E1细胞各细胞器上的分布(×100) Figure 3 Distribution of CDs in different organelles of MC3T3-E1 cells(×100) |
|
|
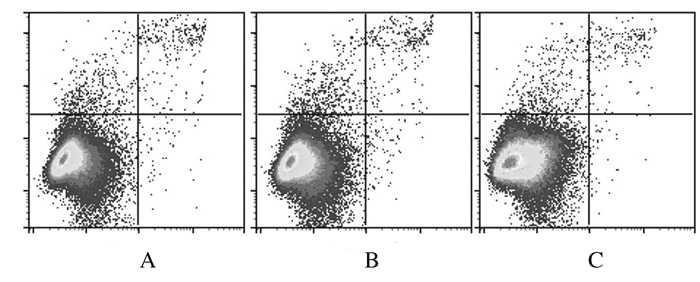
空白对照组细胞构成比:正常细胞98.45%,早期凋亡细胞0.53%,晚期凋亡细胞0.37%,坏死细胞0.65%;叶酸组细胞构成比:正常细胞98.07%,早期凋亡细胞0.73%,晚期凋亡细胞0.41%,坏死细胞0.79%;碳点组细胞构成比:正常细胞98.52%,早期凋亡细胞0.37%,晚期凋亡细胞0.33%,坏死细胞0.77%。与空白对照组比较,叶酸组和碳点组MC3T3-E1细胞凋亡构成比无明显变化。见图 4。
|
| A:Control group; B: Folic acid group; C: CDs group. 图 4 各组MC3T3-E1细胞凋亡率 Figure 4 Apoptotic rates of MC3T3-E1 in various groups |
|
|
与空白对照组(100%)比较,叶酸组和碳点组细胞中ROS水平明显降低(P<0.05)。叶酸组细胞中ROS水平下降到空白对照组的60.05%,碳点组细胞中ROS水平下降到空白对照组的42.78%。
3 讨论创伤、感染、肿瘤、骨髓炎手术清创以及各种先天性疾病导致的骨缺损是临床上常见的问题[11],传统疗法存在诸多不足,因此寻找一种新型有效的治疗方法非常必要[12]。转基因方法治疗骨缺损是当前研究热点,其中miRNAs对细胞增生、分化、凋亡和代谢均具有显著影响[13-14]。单纯基因不稳定,极易被细胞内酶降解,因此需要良好的基因载体保护基因到达相应位置来发挥其功能。病毒作为传统的基因载体,在多种细胞中显示了较高转染效率。然而,病毒存在的毒性和免疫原性等问题限制了其在转基因治疗中的应用。碳点作为一种非病毒载体,表面具有多种功能基团,易于修饰,可以通过不同的功能化改变其表面电荷,使其带有正电,有利于结合带负电的基因,保护基因不被降解,同时也有助于与带负电的细胞膜表面结合,促进治疗基因进入细胞[15]。碳点携带促成骨基因用于骨损伤治疗,可以保护基因不被生物系统中的酶降解、避免病毒引起的免疫原性,增强治疗效果。
作为一种基因载体,碳点跨细胞膜转运的途径和胞内分布对基因在细胞内的转归有着十分重要的意义[10]。目前关于纳米粒子跨膜机制和胞内转运的研究较多。细胞摄取纳米粒子的途径较多,但都是基于细胞膜内陷形成的细胞内囊泡而实现的。细胞通过形成的囊泡来包绕纳米粒子,进而将其转运到细胞内,这种能量依赖性的内吞途径主要包括吞噬作用、网格蛋白介导的胞饮作用、小窝蛋白介导的胞饮作用(胞膜窖)和巨胞饮作用[16-17]。细胞内常见的细胞器有内质网、线粒体、溶酶体和高尔基体,不同的细胞器在细胞的代谢以及发挥生物功能中发挥着不同的作用。因此,明确碳点内吞的途径以及其在细胞内的转运方式,对了解碳点作为一种基因载体在细胞内发挥的作用具有重要的意义。但是碳点作为一种新型的纳米粒子,目前少有这方面内容的报道。
本研究以叶酸和PEI为原料,通过水热法合成的碳点能够在紫外光激发下发射蓝色荧光,并能进入细胞进行细胞成像。碳点对细胞的毒性较小,在低浓度时具有一定的促进细胞增殖的作用,浓度较高时则能抑制细胞的增殖。此外碳点对细胞的凋亡无影响,还能显著降低细胞中ROS水平。碳点能够通过胞膜窖途径和非能量依赖性途径内吞进入细胞,然后分布到内质网、高尔基体、溶酶体和线粒体这些细胞器上去。
综上所述,本研究中的碳点生物相容性较好,不良反应少,能通过多种途径有效地进入细胞,并能分布至各个细胞器上,为所载基因在细胞内发挥生物学功能提供了理论基础。碳点有潜力成为一种性能优良的基因载体来应用于转基因治疗。
| [1] | Zhu S, Meng Q, Wang L, et al. Highly photoluminescent carbon dots for multicolor patterning, sensors, and bioimaging[J]. Angew Chem Int Ed Engl, 2013, 52(14): 3953–3957. DOI:10.1002/anie.v52.14 |
| [2] | Liu C, Zhang P, Zhai X, et al. Nano-carrier for gene delivery and bioimaging based on carbon dots with PEI-passivation enhanced fluorescence[J]. Biomaterials, 2012, 33(13): 3604–3613. DOI:10.1016/j.biomaterials.2012.01.052 |
| [3] | Zhao F, Zhao Y, Liu Y, et al. Cellular uptake, intracellular trafficking, and cytotoxicity of nanomaterials[J]. Small, 2011, 7(10): 1322–1337. DOI:10.1002/smll.201100001 |
| [4] | Liu P, Sun Y, Wang Q, et al. Intracellular trafficking and cellular uptake mechanism of mPEG-PLGA-PLL and mPEG-PLGA-PLL-Gal nanoparticles for targeted delivery to hepatomas[J]. Biomaterials, 2014, 35(2): 760–770. DOI:10.1016/j.biomaterials.2013.10.020 |
| [5] | 董悦, 郑嵘, 布文奂, 等. 碳点在成骨细胞系内跨膜转运机制的研究[J]. 北京口腔医学, 2017, 25(2): 71–75. |
| [6] | Iversen TG, Skotland T, Sandvig K. Endocytosis and intracellular transport of nanoparticles:present knowledge and need for future studies[J]. Nano Today, 2011, 6(2): 176–185. DOI:10.1016/j.nantod.2011.02.003 |
| [7] | Gao H, Yang Z, Zhang S, et al. Ligand modified nanoparticles increases cell uptake, alters endocytosis and elevates glioma distribution and internalization[J]. Sci Rep, 2013, 3: 2534. DOI:10.1038/srep02534 |
| [8] | Zhang Z, Zhou L, Zhou Y, et al. Mitophagy induced by nanoparticle-peptide conjugates enabling an alternative intracellular trafficking route[J]. Biomaterials, 2015, 65: 56–65. DOI:10.1016/j.biomaterials.2015.06.029 |
| [9] | Walker WA, Tarannum M, Vivero-Escoto JL. Cellular endocytosis and trafficking of cholera toxin B-modified mesoporous silica nanoparticles[J]. J Mater Chem B, 2016, 4(7): 1254–1262. DOI:10.1039/C5TB02079D |
| [10] | Zhou N, Zhu S, Maharjan S, et al. Elucidating the endocytosis, intracellular trafficking, and exocytosis of carbon dots in neural cells[J]. RSC Adv, 2014, 4(107): 62086–62095. |
| [11] | Dahlin C, Linde A, Gottlow J, et al. Healing of bone defects by guided tissue regeneration[J]. Plast Reconstr Surg, 1988, 81(5): 672–676. DOI:10.1097/00006534-198805000-00004 |
| [12] | Desiderio V, Tirino V, Papaccio G, et al. Bone defects:Molecular and cellular therapeutic targets[J]. Int J Biochem Cell Biol, 2014, 51: 75–78. DOI:10.1016/j.biocel.2014.03.025 |
| [13] | Doherty GJ, McMahon HT. Mechanisms ofendocytosis[J]. Annu Rev Biochem, 2009, 78: 857–902. DOI:10.1146/annurev.biochem.78.081307.110540 |
| [14] | Pucadyil TJ, Schmid SL. Conserved functions of membrane active GTPases in coated vesicle formation[J]. Science, 2009, 325(5945): 1217–1220. DOI:10.1126/science.1171004 |
| [15] | 布文奂, 唐琪, 辛颖, 等. 荧光碳点在疾病诊治中的应用[J]. 生命的化学, 2015, 35(5): 609–614. |
| [16] | Zhao F, Zhao Y, Liu Y, et al. Cellular uptake, intracellular trafficking, and cytotoxicity of nanomaterials[J]. Small, 2011, 7(10): 1322–1337. DOI:10.1002/smll.201100001 |
| [17] | Iversen TG, Skotland T, Sandvig K. Endocytosis and intracellular transport of nanoparticles:present knowledge and need for future studies[J]. Nano Today, 2011, 6(2): 176–185. DOI:10.1016/j.nantod.2011.02.003 |
 2018, Vol. 44
2018, Vol. 44


