扩展功能
文章信息
- 黄晓巍, 徐岩, 韩冬, 林贺, 律广富, 李晓华, 曲晓波, 张冰
- HUANG Xiaowei, XU Yan, HAN Dong, LIN He, LYU Guangfu, LI Xiaohua, QU Xiaobo, ZHANG Bing
- 鹿茸多肽介导心肌干细胞分化对终末心肌分化基因ANP和MLC-2v表达的影响
- Effect of differentiation of cardiac stem cells mediated by pilose antler polypeptides on expressions of terminal myocardial differentiation genes ANP and MLC-2v
- 吉林大学学报(医学版), 2018, 44(02): 249-253
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 249-253
- 10.13481/j.1671-587x.20180208
-
文章历史
- 收稿日期: 2017-10-12
2. 长春中医药大学药学院临床药学与中药药理教研室, 吉林 长春 130117;
3. 北京中医药大学中药学院临床中药系, 北京 100102
2. Department of Clinical Pharmacy and Traditional Chinese Medicine Pharmacology, School of Pharmacy, Changchun University of Traditional Chinese Medicine, Changchun 130117, China;
3. Department of Clinical Chinese Materia, School of Chinese Materia Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
心肌细胞损伤是冠心病等各类心脏疾病的病理基础,但心肌细胞的再生能力较弱,一旦心肌受损,很难在短时间内自行恢复心肌功能。通过干细胞分化再生心肌细胞,实现心肌损伤的修复是心脏功能恢复的重要途径。心肌组织中存在成体心肌干细胞(cardiac stem cells,CSC),CSC是目前最有希望修复心肌损伤的干细胞类型[1-2]。目前CSC的移植存在许多问题,临床应用受限,动员自体CSC,诱导其向心肌细胞分化改善心功能是比较可行的方案,许多中药有效成分具有干细胞诱导剂的作用,且具有不良反应少的特点[3-5]。鹿茸味甘、咸,性温补阳,归肝、肾经,禀纯阳之质,含生发之气,具有壮元阳、益精血、温通心阳、滋补肾精之功效,是中医临床采用温通心阳法治疗冠心病的核心药材之一[6-7]。鹿茸多肽是鹿茸的有效成分,有明显促进细胞再生作用。本研究通过体外细胞实验观察鹿茸多肽介导CSC分化对终末心肌分化基因心房钠尿肽(atrial natriuretic polypeptide,ANP)和心肌肌凝蛋白轻链2(myosin light chain 2v,MLC-2v)表达的影响,并探讨其作用机制。
1 材料与方法 1.1 实验动物清洁级新生Wistar大鼠,雄性,由吉林大学实验动物中心提供,动物许可证号:SCXK(吉)2013-0001。
1.2 药品、主要试剂和仪器鹿茸多肽(长春中医药大学药学院自制,批号:20150417,纯度>97%),5-氮胞苷(中国上海阿拉丁试剂有限公司,批号:B1412007,纯度>98%)。胰蛋白酶(美国Sigma公司,批号:T0303),胶原酶(北京索莱宝公司,批号:C8140),DMEM和胎牛血清(美国Gibco公司,批号:12491-015、1009-141),CEM培养基(自制,DMEM 180 mL、胎牛血清20 mL、L-谷氨酰胺2.58 mg、β-巯基乙醇1.4 μL),琼脂糖和DNA上样缓冲液(上海碧云天公司,货号:ST004L、D0071),AxyPrep总RNA小量制备试剂盒(美国Axygen公司,货号:AP-UN-MS-RNA-50),DMA Ladder、ANP Elisa kit和MLC-2v Elisa kit(上海生工生物工程有限公司,货号:B600109、D730358、D710117),PrimeScriptTM RT Master Mix和SYBR® Premix Ex TaqTM Ⅱ(大连宝生物工程有限公司,货号:RR036A、RR82LR)。CO2孵箱(日本三洋公司,型号:MCO-17),倒置显微镜(日本Olympus公司,型号:IX71),低温离心机(德国Heraeus公司,型号:Biofuge primp R),荧光定量PCR仪(美国Stratagene公司,型号:Mx3000),凝胶成像系统(美国Aplegen公司,型号:Omegalum C);流式细胞仪(美国Beckman Coulter公司,型号:Gallios)。
1.3 大鼠CSC分离提取和原代培养取刚出生2d的健康Wistar大鼠的心脏于培养皿内,去除结缔组织并挤压出多余的血液,用PBS多次漂洗干净后,转移至无菌玻璃瓶中,将其剪成大小约为1 mm×1 mm×1 mm的块状物,反复吹打组织块弃去上清液,并用PBS清洗心脏组织至澄清,吸出PBS。加入0.25%胰蛋白酶(含0.20% EDAT)1 mL,消化5 min,吸弃上清液,再加入0.1%胶原酶1 mL,消化5 min;消化步骤重复3次。将消化好的心脏组织块,静置1 min,吸取上清液至1.5 mL离心管内,800 r·min-1离心2 min。吸去上清液,加入CEM培养基1 mL,反复轻轻吹打,将细胞悬液转移至细胞培养瓶内,置于37℃、5% CO2培养箱中孵育。
1.4 大鼠CSC的传代培养取生长状态良好的CSC,弃去培养液,加入0.25%胰蛋白酶(含0.02%EDTA)1~2 mL,放置37℃、5% CO2培养箱内2~3 min,镜检细胞形态由梭形变为圆形,贴壁松弛,立即加入等量的细胞培养液终止消化作用,用移液器吹打培养瓶底,以致心肌细胞脱离瓶壁,将细胞悬液转移至1.5 mL离心管,800r·min-1离心5 min,弃去上清液,加入细胞培养液,吹打成细胞悬液,转入新的细胞培养瓶中,放置在37℃、5% CO2培养箱内进行培养。
1.5 c-Kit细胞免疫荧光鉴定分析取传代培养状态良好、呈对数生长的CSC,PBS漂洗后,经0.05%胰蛋白酶消化后,将细胞悬液接种于24孔板中,细胞密度为1×105cm-2。置37℃、5% CO2培养箱中培养48h后,PBS漂洗3次,加入4%多聚甲醛300 μL,室温固定20 min,PBS漂洗3次;加入山羊血清(封闭液)200 μL,室温孵育60 min,PBS漂洗3次;加入一抗200 μL,4℃孵育过夜;PBS漂洗3次,加入二抗200 μL,37℃避光孵育60 min;PBS漂洗3次,加入200 μL Hoechst33342浸染5~10 min,弃去。荧光倒置显微镜检测荧光表达并拍照。采用流式细胞术检测CSC特异性表面标志物c-Kit和CD34的表达,以c-Kit阳性细胞表达占全部细胞百分比表示心肌干细胞纯度。
1.6 CSC分组和药物诱导分化将传代培养状态良好、呈对数生长的CSC经胰酶消化,制成细胞密度为1×108L-1的单细胞悬液,分成12个培养瓶培养。药物诱导细胞共分4组:空白对照组(加等量缓冲液)、5-氮胞苷(终浓度3 μmol·L-1)、鹿茸多肽组(终浓度800 mg·L-1)和联合组(3 μmol·L-1 5-aza+800 mg·L-1鹿茸多肽),各组待80%细胞贴壁后,加入相应药物诱导,37℃、5%CO2培养箱中培养48 h。
1.7 ELISA法检测各组细胞上清液中MLC-2v和ANP表达水平收集各组细胞上清液,按上海生工生物工程有限公司提供的ANP和MLC-2v Elisa kit说明书检测各组细胞上清液中ANP和MLC-2v的表达水平,测定450 nm波长处吸光度(A)值。
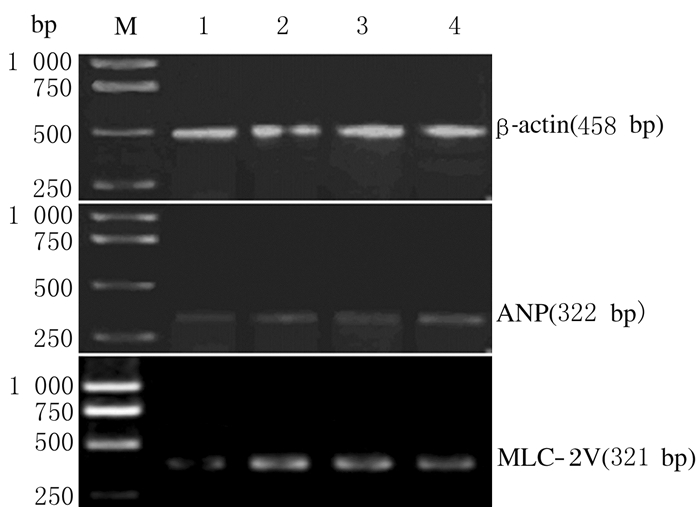
1.8 RT-PCR法检测各组细胞中ANP和MLC-2v mRNA表达水平按AxyPrep总RNA小量制备试剂盒说明书提取各组细胞总RNA;然后按照逆转录试剂盒操作步骤将mRNA逆转录合成cDNA(反应条件:37℃孵育60 min,85℃孵育5 min,冰浴5 min);再通过普通PCR扩增仪,以cDNA为模板,获得目的基因。PCR反应体系:模板1 μL、上游引物1 μL、下游引物1 μL、2×Taq PCR Master Mix 12.5 μL、DDH2O 9.5 μL。反应条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,扩增30个循环后,72℃延伸5 min,4℃保存。内参β-actin的引物,上游序列:5′-GTCCCTGTATGCCTCTGGTC-3′,下游序列:5′-GGTCTTTACGGTTGTCAACG3′(458 bp);目的基因ANP的引物,上游序列:5′-TGAGCTTCCTCCTTTTACTG-3′,下游序列:5′-CTCAGCTTGCTTTTTAGGAG-3′(322 bp);MLC-2v引物序列:上游引物5′-GCACCTAAGAAAGCAAAGAA-3′,下游引物:5′-AGGGTCAAACACTTTGAATG-3′(321 bp)。采用1.2%琼脂糖凝胶电泳对PCR产物进行分析,通过凝胶成像系统,对电泳结果进行拍照、记录结果。以目的基因与内参β-actin的灰度值之比表示mRNA表达水平。
1.9 统计学分析采用SPSS 17.0软件进行统计学分析。各组细胞中ANP和MLC-2v mRNA表达水平以x±s表示,多组样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
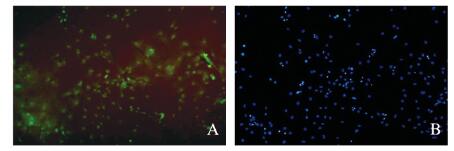
2 结果 2.1 c-Kit细胞免疫荧光鉴定分析在IX71倒置荧光显微镜下观察可见:c-Kit抗原偶联的FITC呈绿色荧光表达,c-Kit抗原表达的CSC见图 1A(插页四);通过Hoechst33342荧光染色,染成蓝色的细胞核见图 1B(插页四)。
|
| A:CSC expressing c-Kit antigen; B:Hoechst33342 fluorescence staining. 图 1 CSC特异性表面标志物c-Kit的表达(×200) Figure 1 Expression of specific surface marker c-Kit of CSC(×200) |
|
|
P0代细胞c-Kit阳性细胞较少、CD34阳性细胞和杂细胞相对较多,随着细胞传代次数增加,c-Kit阳性细胞百分比明显升高;到P3代时,大多数细胞均为c-Kit阳性,而CD34阳性细胞和杂细胞百分比共占约4.8%,说明细胞经过4次传代后得到纯化的CSC。见表 1。
| (n=3, x±s,η/%) | |||
| Cell | c-Kit | CD34 | Parenchyma cells |
| P0 | 6.23±1.38 | 32.78±4.08 | 60.98±6.20 |
| P1 | 13.26±2.76 | 15.90±2.89 | 71.84±5.45 |
| P2 | 50.83±4.25 | 5.28±1.98 | 44.02±5.02 |
| P3 | 95.27±3.08 | 2.08±0.32 | 2.73±0.59 |
与空白对照组比较,5-氮胞苷组、鹿茸多肽组和联合组细胞上清液中ANP及MCL-2v表达水平明显升高(P < 0.05)。见表 2。
| [n=3, x±s, ρB/(ng·L-1)] | ||
| Group | ANP | MLC-2v |
| Blank control | 248.63±28.36 | 32.98±5.60 |
| 5-Azacytidine | 378.25±52.58* | 48.05±4.68* |
| Pilose antler polypeptides | 306.28±43.50* | 45.22±5.39* |
| Combined | 422.58±50.06* | 58.65±6.03* |
| *P < 0.05 compared with blank control group. | ||
与空白对照组比较,5-氮胞苷组、鹿茸多肽组和联合组ANP和MCL-2v mRNA表达水平明显升高(P < 0.05)。见图 2和表 3。
|
| M:DNA ladder; Lane 1:Blank control group; Lane 2:5-Aza cytidine group; Lane 3:Pilose antler polypeptides group; Lane 4:Combined group. 图 2 RT-PCR法检测各组细胞中ANP和MCL-2v mRNA表达电泳图 Figure 2 Electrophoregram of expressions of ANP and MCL-2v mRNA in cells in various groups detected by RT-PCR method |
|
|
| (n=3, x±s) | ||
| Group | ANP mRNA | MCL-2v mRNA |
| Blank control | 0.53±0.13 | 0.69±0.15 |
| 5-Azacytidine | 0.77±0.11* | 1.10±0.24* |
| Pilose antler polypeptides | 0.71±0.10* | 0.93±0.21* |
| Combined | 0.88±0.14* | 0.91±0.25* |
| *P < 0.05 compared with blank control group. | ||
心肌损伤伴随临床多种疾病的发生和发展,保护和增加心肌细胞数目对维持心肌结构的完整和心脏功能的稳定有积极的意义,药物诱导多能干细胞分化为心肌细胞进而修复受损心肌是国内外研究[8-10]的热点。研究[11]表明:胚胎干细胞、间充质干细胞和脂肪干细胞等在不同条件下均可诱导分化为心肌细胞,但存在诱导条件相对复杂、稳定性差等缺点。CSC是存在于心脏中的自体心肌干细胞,在正常状态下基本处于“休眠”状态,一旦心肌受损或心脏功能发生病理学改变,其在短时间内快速分化为心肌细胞,对于修复受损心肌具有重要意义[12]。
目前干细胞移植技术尚不成熟,使用适当的药物诱导促进干细胞分化成为可行方案。化学合成药如5-氮胞苷是经典的干细胞诱导剂,可以诱导多种干细胞分化,但作为化学药物,其具有一定的毒性,长期使用可能诱导细胞变异甚至死亡[13-14]。中药单体或有效成分作为干细胞诱导剂与化学合成药物相比,具有种类多、来源广和效果明显的特点,且少有毒性报道[15-16]。中医临床上治疗冠心病多采用温通心阳法,而鹿茸是核心药材之一,鹿茸多肽是鹿茸主要药效学物质,具有明显促进细胞再生作用[17]。ANP是利钠利尿肽,为心脏循环激素,由心房心肌细胞合成、分泌,而MLC-2v特定表现在心室细胞中,二者在胚胎心脏发育形成过程中起很重要的作用[18-21]。
本研究结果显示:鹿茸多肽可以明显提高CSC中ANP和MLC-2v表达水平,提示其可以作为干细胞诱导剂促进CSC分化,且与5-氮胞苷联合应用可以在一定程度上降低其毒性。
| [1] | 李天, 邹远康, 李子超, 等. 诱导多能干细胞与转分化在心肌再生中的研究进展[J]. 心脏杂志, 2017, 29(1): 109–111. |
| [2] | 黄晓巍, 徐岩, 刘玥欣, 等. 鹿茸多肽对心肌干细胞凋亡和线粒体膜稳定性的影响[J]. 中国组织工程研究, 2017, 21(9): 1426–1431. DOI:10.3969/j.issn.2095-4344.2017.09.021 |
| [3] | 陈芸, 吕湛. 心肌干细胞与心肌微环境研究进展[J]. 心血管病学进展, 2016, 37(4): 415–419. |
| [4] | 陈梓欣, 冼绍祥. 中药及小分子化合物促胚胎干细胞及诱导多能干细胞向心肌细胞分化的研究进展[J]. 中华中医药杂志, 2016, 31(9): 3653–3657. |
| [5] | 李宁, 李应福, 谢兴文, 等. 中药诱导骨髓间充质干细胞的定向分化:研究与进展[J]. 中国组织工程研究, 2016, 20(1): 135–139. DOI:10.3969/j.issn.2095-4344.2016.01.024 |
| [6] | 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 化学工业出版社,2015: 323-324. |
| [7] | 秦丹凤, 侯平. 温补心肾法治疗缓慢性心律失常简况[J]. 实用中医内科杂志, 2016, 30(6): 109–111. |
| [8] | 姜辉, 王辉山, 汪曾炜, 等. 体外诱导人骨髓间充质干细胞转化为心肌样细胞的基因表达[J]. 沈阳部队医药, 2010(1): 5–7. |
| [9] | TakahashiY, Tomotsune D, Takizawa S, et al. New model for cardiomyocyte sheet transplantation using a virus-cell fusion technique[J]. World J Stem Cells, 2015, 7(5): 883–893. DOI:10.4252/wjsc.v7.i5.883 |
| [10] | 马健, 唐海沁, 翟志敏, 等. 人骨髓间充质干细胞体外纯化及心肌样细胞定向诱导分化后的特征分析[J]. 中国老年学杂志, 2007, 27(9): 817–820. |
| [11] | 徐岩, 李朝政, 李智萌, 等. 鹿茸多肽诱导心肌干细胞分化为心肌细胞研究进展[J]. 长春中医药大学学报, 2016, 32(3): 653–655. |
| [12] | 赵翠花, 李彦明, 钟晓鸣, 等. 糖原合成酶激酶3β过表达心肌干细胞移植治疗心肌梗死[J]. 中国组织工程研究, 2016, 20(41): 6203–6208. DOI:10.3969/j.issn.2095-4344.2016.41.019 |
| [13] | 李宁, 李应福, 谢兴文, 等. 中药诱导骨髓间充质干细胞的定向分化:研究与进展[J]. 中国组织工程研究, 2016, 20(1): 135–139. DOI:10.3969/j.issn.2095-4344.2016.01.024 |
| [14] | 陈伟, 王丽娜, 姜艳芳, 等. 5-氮杂胞苷对骨髓间充质干细胞向肌细胞增殖及分化的影响[J]. 吉林大学学报:医学版, 2006, 32(1): 39–42. |
| [15] | Zhu D, Qu L, Zhang X, et al. Icariin-mediated modulation ofcell cycle and p53 during cardiomyocyte differentiation inembryonic stem cells[J]. Eur J Pharmacol, 2005, 514(2/3): 99–110. |
| [16] | 陈梓欣, 冼绍祥. 中药及小分子化合物促胚胎干细胞及诱导多能干细胞向心肌细胞分化的研究进展[J]. 中华中医药杂志, 2016, 31(9): 3653–3657. |
| [17] | 秦丹凤, 侯平. 温补心肾法治疗缓慢性心律失常简况[J]. 实用中医内科杂志, 2016, 30(6): 109–111. |
| [18] | 黄玉洁. miR-218调控小鼠胚胎干细胞体外定向分化心肌细胞研究[D]. 杭州: 浙江大学, 2015. |
| [19] | 蔡敏, 杨兴嫕, 史锁芳. "益气化瘀、温阳利水方"治疗肺心病的作用机理[J]. 中成药, 2015, 37(10): 2267–2271. |
| [20] | 刘源, 王海萍, 吕洋, 等. 不同浓度Wnt-u诱导骨髓间充质干细胞向心肌样细胞定向分化的实验研究[J]. 西安交通大学学报:医学版, 2017, 38(2): 199–205. |
| [21] | 林永青, 梁硕, 张海峰, 等. 维生素C联合内皮素-1促进胚胎干细胞向心肌细胞分化及机制[J]. 中国老年学杂志, 2016, 36(17): 4148–4151. DOI:10.3969/j.issn.1005-9202.2016.17.005 |
 2018, Vol. 44
2018, Vol. 44


