扩展功能
文章信息
- 马鸿云, 庄新明, 许维国, 刘一
- MA Hongyun, ZHUANG Xinming, XU Weiguo, LIU Yi
- 载阿霉素和顺铂的透明质酸纳米粒子对小鼠移植性乳腺癌的抑制作用
- Inhibitory effects of hyaluronic acid nanoparticles loading doxorubicin and cisplatin on allograft breast cancer in mice
- 吉林大学学报(医学版), 2018, 44(02): 243-248
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 243-248
- 10.13481/j.1671-587x.20180207
-
文章历史
- 收稿日期: 2017-11-05
2. 中国科学院长春应用化学研究所 中科院生态环境高分子材料重点实验室, 吉林 长春 130022
2. Key Laboratory of Polymer Ecomaterials, Changchun Institute of Applied Chemistry, Chinese Academy of Sciences, Changchun 130022, China
乳腺癌是目前世界上最常见的女性恶性肿瘤之一,近年来发病率呈逐年上升趋势[1]。有资料[2]显示:中国乳腺癌发病率占全球发病率的12.2%,死亡率占全球的9.6%。乳腺癌恶性程度高,极具侵袭性,多数患者就诊时已发生转移[3],特别是骨转移,可造成骨骼肌肉组织持续丢失[4],引起疼痛、病理性骨折及关节活动受限等一系列继发症状。病程晚期患者往往丧失自理能力,生活质量差,存活率低。因此,找到一种更为安全有效的治疗方法是临床亟待解决的难题之一,并已经成为治疗晚期乳腺癌的迫切需要。
目前临床上尚缺乏有效的乳腺癌治疗措施,其主要的治疗手段包括病灶广泛切除、内分泌治疗、双膦酸盐治疗、放射治疗和化学治疗等[5]。其中,化学治疗起着十分重要的作用,但由于其严重的不良反应和耐药性的发生,临床应用受到很大限制。为了改善目前的情况,研究者[6]开发了多种聚合物纳米颗粒来作为药物运载体,并利用其靶向性、刺激反应释放等优点,有效提高了乳腺癌的治疗效果。目前,聚合物纳米粒子治疗乳腺癌等恶性肿瘤的研究[7-8]已有报道。透明质酸(hyaluronic acid, HA)具有CD44受体靶向性[9-11],可以积累聚集于乳腺癌组织中,增加局部药物水平,提高抗肿瘤效率。本研究以HA为原料合成靶向纳米粒子,旨在通过研究HA纳米粒子对小鼠4T1乳腺癌的抑制、体内代谢及微观病理的影响,探讨其对4T1肿瘤的杀伤作用及其生物安全性,为HA纳米粒子在乳腺癌治疗方面的应用提供依据。由于乳腺癌具有高度侵袭性和转移性,晚期常发生骨转移,本研究目前仅为前期研究,后续将会进一步探讨搭载阿霉素(doxorubicin,DOX)和顺铂(cisplatin,CDDP)的HA纳米粒子HACDDP-DOX在乳腺癌骨转移方面的应用。
1 材料与方法 1.1 实验动物、细胞、主要试剂和仪器4~5周的雌性BALB/c小鼠(长春生物制品研究所有限责任公司),动物许可证号:SCXK(吉)2016-0008。实验用4T1乳腺癌细胞系(中国科学院典型培养物保藏委员会细胞库,上海)。HA(相对分子质量为100 000,华熙福瑞达生物医药有限公司),盐酸阿霉素(北京华丰联博科技有限公司),CDDP(山东铂源制药有限公司),青霉素和链霉素(华北制药股份有限公司),抗增殖细胞蛋白Ki-67抗体(Ki-67,西格玛奥德里奇贸易有限公司,上海),半胱氨酸天冬氨酸蛋白酶3(Caspase-3,美国艾碧康生物有限公司)。Milli-Q水净化设备(美国密理博有限公司),Uv-Vis型分光光度计(日本岛津),透射电子显微镜(TEM,日本电子株式会社),动态光散射仪(DLS,美国Wyatt公司),光学显微镜(日本尼康显微镜光学仪器公司),激光共聚焦显微镜LSM 780(德国蔡司公司),体内荧光成像仪(美国Cambridge研究和仪器公司)。
1.2 HACDDP-DOX的绿色合成和粒径测量绿色合成是指采用无毒、无害的原料、催化剂和溶剂,选择具有高选择性、高转化率,不生产或少生产对环境有害的副产品合成,其目的是从根本上消除或减少环境污染[12]。本研究中HACDDP-DOX纳米粒子合成过程以水作为溶剂,无毒性原料和催化剂参与,降低了纳米粒子的有机毒性。具体合成过程如下:称取300 mg HA,溶于50 mL去离子水中,搅拌10 min。然后称取30 mg DOX溶解于5 mL去离子水中,待溶解充分,逐滴加入HA溶液中(3~4滴·min-1),搅拌过夜。随后,将一定量的CDDP溶液逐滴加入到上述体系,37℃搅拌72 h。通过透析法[截留相对分子质量(MWCO)3500]透析24 h去除额外游离的药物,最后将溶液冻干,得到HACDDP-DOX粉末[13]。所有过程均需避光处理。DOX和CDDP的载药量(DLC)和载药率(DLE)通过紫外光谱法和电感耦合等离子体原子发射光谱法测定。DLC和DLE通过以下公式计算[14]:DLC=纳米粒子负载药物的质量/载药纳米粒子的质量×100%, DLE=纳米粒子负载药物的质量/总投入药的质量×100%。
纳米粒子的粒径通过TEM和DLS测定。TEM测试:将10.0 μL浓度为0.1 g·L-1的载药纳米粒子溶液滴到铜网上,室温下干燥,将样品置于TEM下观察,测试电压100 kV。DLS测试:将载药纳米粒子溶于pH值为7.4的PBS溶液中,利用Wyatt QELS装置在25℃下测定。
1.3 体外释放实验载药纳米粒子的释放表现在PBS中进行,将1.0 mg的HACDDP-DOX分别溶解于10 mL pH值分别为5.5、6.8和7.4的PBS中,将溶液转移到MWCO3500的透析袋中, 然后将透析袋放入盛有100.0 mL不同pH值的PBS的烧杯中,放入37℃震荡恒温箱中恒温震荡,模拟体内药物释放环境。在规定的时间点取出2.0 mL释放液,再补充加入2.0 mL PBS。利用UV-Vis分光光度计通过标准曲线法测定DOX的释放量。
1.4 HACDDP-DOX稳定性实验将0.5 mg的HACDDP-DOX分别溶解于5 mL pH值分别为5.5、6.8和7.4的PBS中配制成0.1 g·L-1溶液。再将溶液转移到DLS样品瓶中,分别在规定时间点用Wyatt QELS装置检测其粒径随时间的变化。
1.5 HACDDP-DOX体内肿瘤抑制实验选取4~5周的雌性BALB/c小鼠,所有小鼠的饲养过程符合吉林大学动物管理和使用委员会的相关制度。将2.0×106个4T1细胞悬浮于100.0 μL PBS后,原位注射到BALB/c小鼠的第2对乳房脂肪垫以建立小鼠4T1乳腺癌模型。当肿瘤体积增大至约80 mm3时将小鼠随机平均分成3组(n=8),分别用DOX浓度相同粒径为(80.0±17.4) nm的HACDDP-DOX纳米粒子、游离DOX/CDDP以及作为对照组的PBS通过尾静脉注射进行治疗;DOX浓度相同,均为5 mg·kg-1,每4d治疗1次,共治疗3次。治疗前一天开始,每天测量小鼠体质量和肿瘤体积,共持续13d。肿瘤体积采用以下公式计算[15]:V=(L×S2)/2。其中,L和S(mm)分别为肿瘤的最大和最小直径,实验利用游标卡尺进行测量。
1.6 病理学和免疫组织化学检测在最后一次治疗后第3天,分别收集小鼠体内的肿瘤组织和主要器官(心、肝、脾、肺和肾)。经过固定、切片和染色后用光学显微镜观察切片,确定肿瘤大小和脏器损伤情况,以分析纳米粒子在体内对肿瘤的抑制情况和生物安全性。HE染色评估脏器损伤情况及肿瘤抑制情况。肿瘤空白片进行免疫荧光染色,检测Ki-67表达情况,以反映肿瘤组织增殖情况;检测Caspase-3水平以反映肿瘤组织凋亡情况。肿瘤免疫荧光通过激光共聚焦显微镜成像、观察,并采用Image J 1.8.0软件进行半定量分析。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。所有实验至少重复3次,DOX释放量、肿瘤体积和小鼠体质量以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 HACDDP-DOX纳米粒子的特征HA中的羧基可为DOX与CDDP通过静电和金属螯合作用提供结合位点,使得HA能够相互交联形成聚合物纳米粒子,增加DOX的载药效率,DOX的DLC和DLE分别为5.4%和52.3%。HACDDP-DOX纳米粒子的TEM和DLS检测结果显示:HACDDP-DOX纳米粒子粒径(Dh:流体力学直径)分布均匀,为(80.0±17.4)nm(图 1A)。HACDDP-DOX稳定性实验:HACDDP-DOX可以在pH值为7.4环境中保持较长时间(>3d)的稳定性,而在pH值为6.8和5.5酸性环境中粒径增大、膨胀和裂解(图 1B和C)。HACDDP-DOX在pH值为6.8和5.5条件下较pH值为7.4环境下更易释放DOX(图 1D)。

|
| A: Typical TEM micrograph of HACDDP-DOX nanoparticles(The insets showed the Dh value); B:Stability of HACDDP-DOX nanoparticles in different pH buffers over time; C: Dh values of HACDDP-DOX nanoparticles in different pH buffers at 48 h; D:Release behavior of DOX from HACDDP-DOX nanoparticles in different pH PBS. *P < 0.05, * *P < 0.01 compared with pH 7.4 group. 图 1 HACDDP-DOX纳米粒子的特征 Figure 1 Characteristics of HACDDP-DOX nanoparticles |
|
|
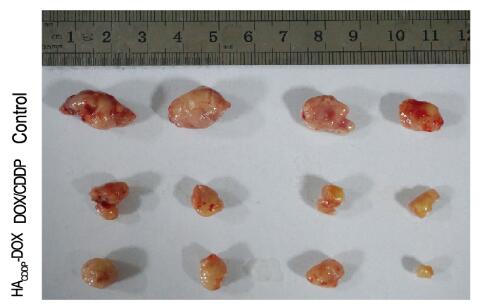
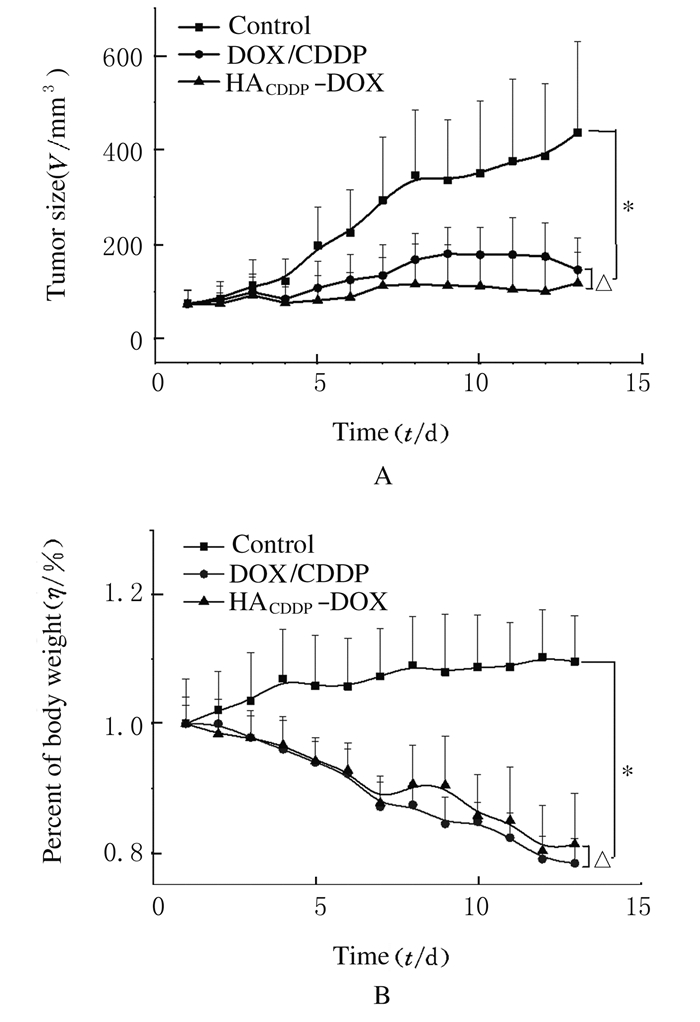
以小鼠乳腺癌(4T1)肿瘤为模型,通过肿瘤体积测量观察HACDDP-DOX的抑瘤效果。与对照组比较,在13 d的治疗期内HACDDP-DOX组4T1肿瘤体积的抑制效果最好(P < 0.01),其次是DOX/CDDP(P < 0.01)。DOX制剂对4T1肿瘤体积的抑制具有以下顺序:HACDDP-DOX > DOX/CDDP(P < 0.05)。与对照组比较,DOX/CDDP组小鼠体质量明显下降(P < 0.01);HACDDP-DOX组小鼠体质量降低(P < 0.05),但小于DOX/CDDP组。见图 2(插页三)和图 3。
|
| 图 2 各组小鼠肿瘤体积大体观察 Figure 2 Gross observation of tumor volumes of mice in various groups |
|
|
|
| A:Tumor volume; B: Body weight.*P<0.01 compared with control group; △P<0.05 compared with DOX/CDDP group. 图 3 各组小鼠肿瘤体积和体质量 Figure 3 Tumor volumes and body weights of mice in various groups |
|
|
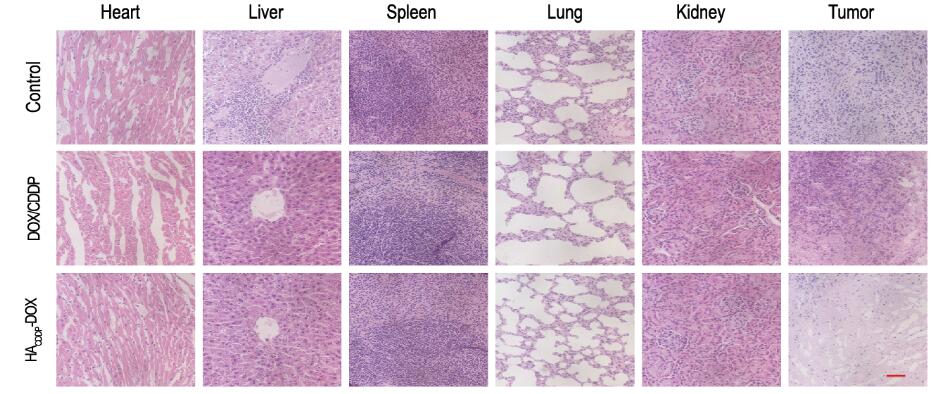
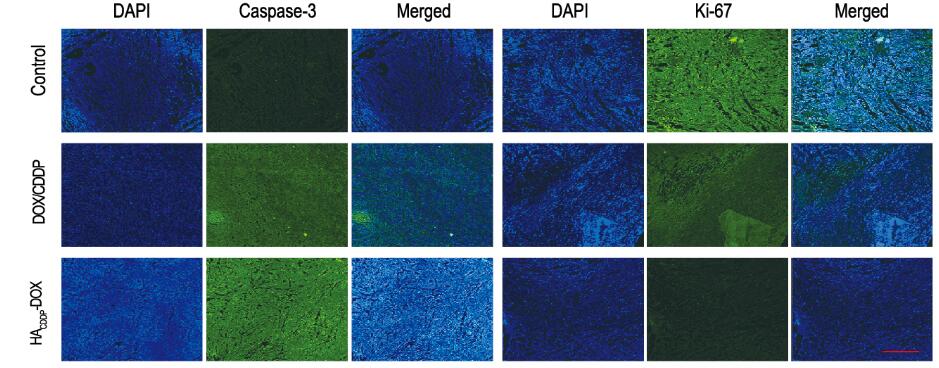
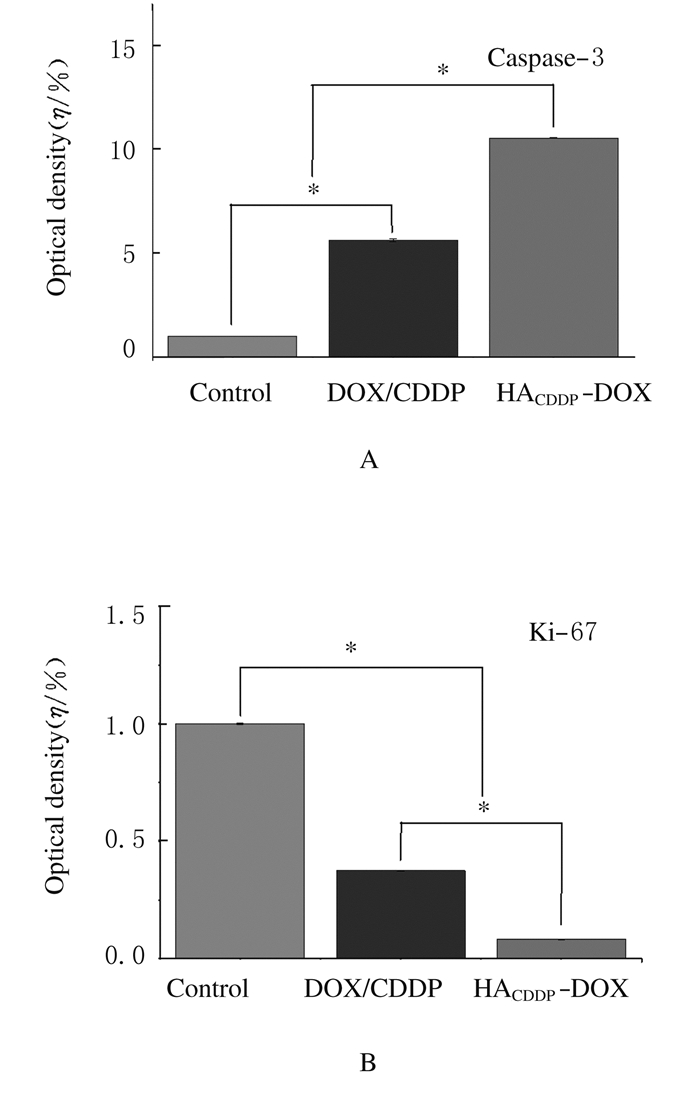
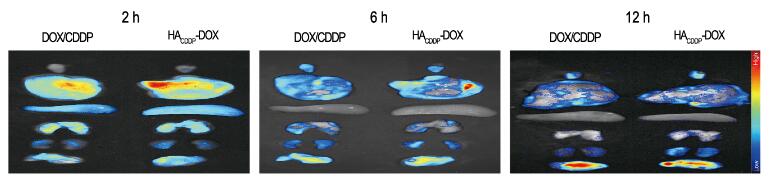
对照组小鼠肝脏中央静脉旁有肿瘤转移灶,且对照组和DOX/CDDP组小鼠肺泡间隔明显增宽,而HACDDP-DOX组小鼠未出现上述情况(图 4,见插页三)。肿瘤的病理组织学检测结果显示:HACDDP-DOX组和DOX/CDDP组肿瘤组织均有坏死,HACDDP-DOX组肿瘤组织坏死程度明显重于DOX/CDDP组。肿瘤免疫荧光检测结果显示:与DOX/CDDP组比较,HACDDP-DOX组Caspase-3荧光强度明显增强,而Ki-67荧光减弱,半定量结果表明:Caspase-3活性明显升高(P < 0.01),而Ki-67活性明显下降(P < 0.01)。见图 5(插页三)和图 6。生物荧光成像进一步分析在注射药物不同时间(2、6和12h)后DOX在体内脏器的组织分布情况发现:随着时间推移,DOX可有效聚集于乳腺癌肿瘤部位,而非体内正常器官。见图 7(插页四)。
|
| 图 4 各组小鼠内脏组织和肿瘤组织病理学表现(HE, Bar=200 μm) Figure 4 Pathology of visceral organ and tumor tissues of mice in various groups (HE, Bar=200 μm) |
|
|
|
| 图 5 各组小鼠乳腺癌组织免疫荧光染色结果(Bar=50 μm) Figure 5 Immunoflurorscence staining results of breast cancer tissue of mice in various groups(Bar=50 μm) |
|
|
|
| *P < 0.01 compared with control group. 图 6 各组小鼠乳腺癌组织中Caspase-3(A)和Ki-67(B)的表达 Figure 6 Expression levels of Caspase-3(A) and Ki-67(B) in breast cancer tissue of mice in various groups |
|
|
|
| 图 7 DOX在各组小鼠体内生物荧光显像 Figure 7 Biofluorescence imaging of DOX in mice in various groups |
|
|
近年来,随着纳米医学的迅猛发展,纳米技术已经成为21世纪的关键技术之一,推动了多个研究领域的迅猛发展,特别是癌症精准治疗领域。HA具有较好的生物相容性和CD44受体靶[9-11]向性,可以积累聚集于CD44受体过表达的乳腺癌等肿瘤组织中,靶向释放化疗药物,提高抗肿瘤效率。本研究选择以HA作为原料通过绿色合成途径合成载药纳米粒子HACDDP-DOX,并通过荷瘤小鼠尾静脉注射HACDDP-DOX以验证、探讨其对4T1乳腺癌的靶向抑制作用。
与传统化疗药物比较,聚合物纳米粒子负载的抗肿瘤药物具有明显的优点:①刺激反应释放;②联合、协同治疗[16];③跨越生物屏障[17];④靶向治疗[18];⑤增强肿瘤积累;⑥延长循环时间等。HACDDP-DOX纳米粒子可以通过CD44受体靶向性积累于肿瘤组织中,并在肿瘤等酸性条件下刺激反应性释放搭载药物,增强治疗效果。通过体内生物荧光成像分析HACDDP-DOX经由尾静脉注入体内2、6和12 h后DOX的分布情况显示:随着时间延长,HACDDP-DOX在乳腺肿瘤组织中聚集增多,这可能是由于药物载体与肿瘤表面CD44受体的主动靶向作用,而这也是其靶向性的药理学基础。此外,HACDDP-DOX组肝脏荧光强度在注射后2和6h较高,提示肝脏为其主要代谢器官,纳米粒子可被Kupffer吞噬细胞吞噬清除。体外释放实验及稳定性实验证实:HACDDP-DOX能够在肿瘤等酸性条件下膨胀、裂解,响应性释放DOX,这也进一步为其提高抗肿瘤效果提供了理论基础。
本研究中小鼠乳腺癌抑制曲线和体质量变化曲线结果显示:HACDDP-DOX纳米粒子对4T1乳腺癌的抑制效果最好。与对照组比较,DOX/CDDP组小鼠体质量明显下降,肿瘤体积明显缩小;HACDDP-DOX组小鼠体质量也减轻,但小于DOX/CDDP组。上述结果表明相对于DOX/CDDP来说,天然高分子纳米化可以明显减小游离化疗药物的系统毒性,提高其安全性。DOX和CDDP作为传统化疗药物可引起包括消化道反应、骨髓抑制和肝肾功能损害等在内的严重不良反应,且长期应用会导致肿瘤耐药性的出现[19-21]。本文作者通过HE染色对体内主要脏器和肿瘤组织进行了病理学分析,进一步证实了HACDDP-DOX纳米粒子的生物安全性,可有效降低化疗药物对肝脏、肺脏等主要脏器的损伤。4T1肿瘤是一种高转移性肿瘤[22],肿瘤病理学分析显示:HACDDP-DOX纳米粒子能够引起肿瘤组织坏死,同时有效抑制4T1肿瘤的转移。Ki-67是在细胞G1、S、G2和M期出现的核抗原,由于其半衰期短,因此可以准确反映细胞的增殖活性。本研究免疫荧光染色显示:应用HACDDP-DOX纳米粒子后,肿瘤Ki-67活性明显下降,说明肿瘤增殖受到抑制。此外,免疫荧光染色还显示HACDDP-DOX组Caspase-3活性明显升高,且Caspase-3在凋亡早期阶段即被激活,并裂解相应的胞质胞核底物,执行凋亡功能[23],说明HACDDP-DOX诱导了肿瘤细胞凋亡的发生。
综上所述,HACDDP-DOX纳米粒子可以有效靶向于4T1乳腺癌,在降低化疗药物系统毒性的同时增加肿瘤局部的药物水平,明显抑制乳腺癌生长。本研究虽然证实HACDDP-DOX纳米粒子能够靶向积累于肿瘤组织,但未对其在体内的代谢进行定量分析,其对乳腺癌细胞的抑制作用及细胞内代谢分子生物学机制有待进一步研究。
| [1] | DeSantis CE, Fedewa SA, Goding Sauer A, et al. Breast cancer statistics, 2015:Convergence of incidence rates between black and white women[J]. CA Cancer J Clin, 2016, 66(1): 31–42. DOI:10.3322/caac.21320 |
| [2] | Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7): e279–e289. DOI:10.1016/S1470-2045(13)70567-9 |
| [3] | Bertucci F, Birnbaum D. Distant metastasis:not out of reach any more[J]. J Biol, 2009, 8(3): 28. DOI:10.1186/jbiol128 |
| [4] | Kubo Y, Naito T, Mori K, et al. Skeletal muscle loss and prognosis of breast cancer patients[J]. Support Care Cancer, 2017, 25(7): 2221–2227. DOI:10.1007/s00520-017-3628-5 |
| [5] | Gnant M, Harbeck N, Thomssen C. St. Gallen/Vienna 2017:A brief summary of the consensus discussion about escalation and de-escalation of primary breast cancer treatment[J]. Breast Care(Basel), 2017, 12(2): 102–107. |
| [6] | Peer D, Karp JM, Hong S, et al. Nanocarriers as an emerging platform for cancer therapy[J]. Nat Nanotechnol, 2007, 2(12): 751–760. DOI:10.1038/nnano.2007.387 |
| [7] | Wang DG, Wang TT, Xu ZA, et al. Cooperative treatment of metastatic breast cancer using host-guest nanoplatform coloaded with docetaxel and siRNA[J]. Small, 2016, 12(4): 488–498. DOI:10.1002/smll.v12.4 |
| [8] | Yu HJ, Guo CY, Feng B, et al. Triple-layered pH-responsive micelleplexes loaded with siRNA and cisplatin prodrug for NF-Kappa B targeted treatment of metastatic breast cancer[J]. Theranostics, 2016, 6(1): 14–27. DOI:10.7150/thno.13515 |
| [9] | Zhao YQ, Zhang T, Duan SF, et al. CD44-tropic polymeric nanocarrier for breast cancer targeted rapamycin chemotherapy[J]. Nanomedicine, 2014, 10(6): 1221–1230. DOI:10.1016/j.nano.2014.02.015 |
| [10] | Camacho KM, Kumar S, Menegatti S, et al. Synergistic antitumor activity of camptothecin-doxorubicin combinations and their conjugates with hyaluronic acid[J]. J Control Release, 2015, 210: 198–207. DOI:10.1016/j.jconrel.2015.04.031 |
| [11] | Bano F, Banerji S, Howarth M, et al. A single molecule assay to probe monovalent and multivalent bonds between hyaluronan and its key leukocyte receptor CD44 under force[J]. Sci Rep, 2016, 6: 34176. DOI:10.1038/srep34176 |
| [12] | Ahmed S, An nu, Chaudhry SA, et al. A review on biogenic synthesis of ZnO nanoparticles using plant extracts and microbes:A prospect towards green chemistry[J]. J Photochem Photobiol B Biol, 2017, 166: 272–284. DOI:10.1016/j.jphotobiol.2016.12.011 |
| [13] | 谷学源. 以顺铂为交联剂基于透明质酸为载体的纳米药物对CD44高表达的乳腺癌的治疗的研究[D]. 沈阳: 中国医科大学, 2016. |
| [14] | Guo H, Xu W, Chen J, et al. Positively charged polypeptide nanogel enhances mucoadhesion and penetrability of 10-hydroxycamptothecin in orthotopic bladder carcinoma[J]. J Control Release, 2017, 259: 136–148. DOI:10.1016/j.jconrel.2016.12.041 |
| [15] | Schmid D, Park CG, Hartl CA, et al. T cell-targeting nanoparticles focus delivery of immunotherapy to improve antitumor immunity[J]. Nat Commun, 2017, 8(1): 1747. DOI:10.1038/s41467-017-01830-8 |
| [16] | Rejinold NS, Baby T, Chennazhi KP, et al. Multi drug loaded thermo-responsive fibrinogen-graft-poly(N-vinyl Caprolactam) nanogels for breast cancer drug delivery[J]. J Biomed Nanotechnol, 2015, 11(3): 392–402. DOI:10.1166/jbn.2015.1911 |
| [17] | Kolter M, Ott M, Hauer C, et al. Nanotoxicity of poly(n-butylcyano-acrylate) nanoparticles at the blood-brain barrier, in human whole blood and in vivo[J]. J Control Release, 2015, 197: 165–179. DOI:10.1016/j.jconrel.2014.11.005 |
| [18] | Oh SS, Lee BF, Leibfarth FA, et al. Synthetic aptamer-polymer hybrid constructs for programmed drug delivery into specific target cells[J]. J Am Chem Soc, 2014, 136(42): 15010–15015. DOI:10.1021/ja5079464 |
| [19] | Ansari L, Shiehzadeh F, Taherzadeh Z, et al. The most prevalent side effects of pegylated liposomal doxorubicin monotherapy in women with metastatic breast cancer:A systematic review of clinical trials[J]. Cancer Gene Ther, 2017, 24(5): 189–193. DOI:10.1038/cgt.2017.9 |
| [20] | Florea AM, Busselberg D. Cisplatin as an anti-tumor drug:cellular mechanisms of activity, drug resistance and induced side effects[J]. Cancers (Basel), 2011, 3(1): 1351–1371. DOI:10.3390/cancers3011351 |
| [21] | Pezeshki Z, Maleki M, Talebi A, et al. Age and gender related renal side effects of cisplatin in animal model[J]. Asian Pac J Cancer Prev, 2017, 18(6): 1703–1705. |
| [22] | Yu PF, Huang Y, Xu CL, et al. Downregulation of CXCL12 in mesenchymal stromal cells by TGFbeta promotes breast cancer metastasis[J]. Oncogene, 2017, 36(6): 840–849. DOI:10.1038/onc.2016.252 |
| [23] | Pu X, Storr SJ, Zhang Y, et al. Caspase-3 and caspase-8 expression in breast cancer:caspase-3 is associated with survival[J]. Apoptosis, 2017, 22(3): 357–368. DOI:10.1007/s10495-016-1323-5 |
 2018, Vol. 44
2018, Vol. 44


