扩展功能
文章信息
- 田大川, 李海乐, 肖大伟, 周山健, 苏永蔚, 刘丹平, 綦惠
- TIAN Dachuan, LI Haile, XIAO Dawei, ZHOU Shanjian, SU Yongwei, LIU Danping, QI Hui
- 联合应用软骨再生支架与突变型HIF-1α修饰BMSCs分泌的外泌体对晚期软骨缺损修复的促进作用
- Promotion effect of cartilage regenerated scaffolds combined with exosomes derived from mutant type of HIF-1α modified BMSCs in repairing advanced cartilage defects
- 吉林大学学报(医学版), 2018, 44(02): 216-222
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 216-222
- 10.13481/j.1671-587x.20180203
-
文章历史
- 收稿日期: 2017-06-17
2. 河南省漯河市 中心医院创伤骨科, 河南 漯河 462000;
3. 北京市创伤骨科研究所, 北京 100035
2. Department of Traumatologyand Orthopedics, Central Hospital of Luohe City, Henan Province, Luohe 462000, China;
3. Beijing Institute of Traumatology and Orthopedics, Beijing 100035, China
骨性关节炎(osteoarthritis,OA)终末期往往造成关节缺损且易累及软骨下骨,主要表现为软骨组织退变,其发病机制尚不明确[1]。由于关节软骨本身缺乏血供,因此关节软骨组织发生损伤后依靠自体修复的能力有限[2]。近年来,组织工程技术为软骨缺损修复提供了新途径,软骨再生支架材料的应用现已成为软骨再生领域的热点[3]。OA患者的软骨组织处在低氧和炎症的环境中,研究[4]显示:骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)来源的外泌体在炎症抑制方面有显著作用。外泌体是真核细胞内多泡体与来源细胞膜融合后分泌到细胞外的膜性小囊泡,直径为60~100nm,表面富含胆固醇、神经鞘磷脂和神经酰胺等脂类物质,其内载有蛋白质、mRNA和microRNA等生物信息,在细胞微环境中发挥重要作用。实验[5-6]证实:突变型低氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)可以诱导BMSCs向软骨细胞方向分化,生理状态下表达的HIF-1α在常氧状态下容易降解,要在软骨缺损处有稳定表达,必须有在常氧状态下不易被降解的活性HIF-1α存在,在此基础上通过使基因三点突变而产生一种在常氧下不易降解的HIF-1α。但是并无联合应用软骨再生支架与突变型HIF-1α修饰的BMSCs分泌的外泌体(BMSCs-ExoMU)能更有效促进晚期软骨缺损修复的相关报道。因此,本实验联合应用真皮来源的软骨再生支架和BMSCs-ExoMU共同作用于打破兔膝关节软骨下骨的动物模型,探讨软骨再生支架联合BMSCs-ExoMU对晚期软骨缺损修复的作用机制,并将在细胞水平上探讨在白细胞介素1β(interleukin-1β,IL-1β)诱导的炎症环境中BMSCs-ExoMU对软骨细胞的作用机制。
1 材料与方法 1.1 实验动物、主要试剂和仪器4周龄清洁级新西兰兔6只,用于制备软骨细胞和间充质干细胞;2个月龄清洁级新西兰兔12只,用于动物实验,所有实验兔均由锦州医科大学动物实验中心提供,动物合格证号:SCXK(辽)2014-0004。表达人突变型HIF-1α的重组腺病毒[ad-HIF-1α,含绿色荧光蛋白(GFP)基因](上海吉凯基因化学技术有限公司), 胰蛋白酶、小牛血清和DMEM/F12培养基(美国Gibco公司),兔抗AKT、p-AKT、p-ERK、p38、p-p38抗体和鼠抗ERK抗体及二抗(英国Abcam公司),兔Ⅱ型胶原酶、白细胞介素1-β和细胞膜红色荧光探针(Dil)(美国Sigma-Aldrich公司),HE、蕃红O、油红O、阿尔新蓝、茜素红染色试剂盒和兔间充质干细胞成脂肪、成骨诱导液(北京索莱宝生物科技有限公司),软骨再生支架(北京积水潭医院组织工程研究所)。超速离心机(日本Olympus公司),凝胶成像仪和凝胶成像分析仪ChemiDocMP(美国Bio-Rad公司),凝胶电泳装置JM-250(大连迈捷科贸有限公司),正置显微镜和倒置荧光显微镜(德国Leica公司)。
1.2 细胞培养、细胞转染和鉴定软骨细胞提取:将4周龄新西兰兔处死,取双侧膝关节软骨组织,消毒后转移入超净台内,剪碎软骨组织成1 mm×1 mm×1 mm小块置于离心管中室温400 g离心5 min,去上清,加入胰酶置于细胞培养箱中,30 min后400 g离心,弃上清,冷PBS清洗后加入0.2%Ⅱ型胶原酶,置于细胞培养箱,30 min后取出,室温400 g离心5 min,去上清,加入胶原酶并置于培养箱,分别在4、8和12h收集上清100 g离心5 min,并用8 mL含15%小牛血清的DMEM/F12完全培养基冲悬,接种于培养皿中置于37℃、5%CO2孵箱中培养,每2d换液1次,待细胞稳定增殖后进行阿尔新蓝染色,倒置显微镜下观察被染软骨细胞。BMSCs提取:分离兔后肢股骨和胫骨于洁净培养皿中,消毒后移入超净台并加入冷PBS浸泡,切断股骨和胫骨两端,用10 mL完全培养基冲洗骨髓腔直至骨头变白。得到混合液接种于培养皿中,置于37℃、5%CO2孵箱中培养,每2d换液1次。待细胞长满皿底80%时,胰酶消化离心,1:2传代,取对数生长期细胞进行实验,再对第3代BMSCs经成脂肪和成骨方向诱导并进行油红O与茜素红染色,倒置显微镜下观察被染细胞。BMSCs鉴定完成后,取第3代BMSCs为实验对象,长至培养皿底面积的80%时计数,接种于6孔板内(3×106个/孔),待细胞稳定增殖后,将感染复数(multiply of infection,MOI)值为150的ad-HIF-1α加入到6孔板中,24h后倒置荧光显微镜下观察BMSCs内GFP的表达。
1.3 提取外泌体上述传代生长的BMSCs与突变型HIF-1α修饰的BMSCs长至培养皿底面积约90%,弃培养液,PBS冲洗3次,加入含1%青链霉素DMEM/F12无血清培养基,培养24h后收集条件培养液于4℃保存。收集细胞条件培养液至300 mL后超速离心机梯度离心。首先300 g、4℃离心15 min去除残余细胞;然后2000 g、4℃离心15 min再次去除细胞;10000 g离心30 min去除细胞碎片;上清液用0.22 μm过滤器滤过并100000 g离心1 h,去上清后用PBS清洗1次后再次100000 g离心1 h,去上清并用100 μL PBS冲悬,参照相关文献[4],BCA法测定外泌体水平。4℃保存1周或-20℃低温保存备用。
1.4 外泌体形态观察及鉴定 1.4.1 透射电镜观察滴10 μL外泌体悬液于载样铜网上,室温静置使样本干透,透射电镜下观察外泌体形态特征。
1.4.2 Western blotting法检测外泌体表面特异性蛋白的表达收集野生型HIF-1α和突变型HIF-1α修饰的BMSCs来源的条件培养基各300 mL,梯度超速离心得到的外泌体用100 μLPBS冲悬,采用Western blotting法检测外泌体特异性表面蛋白CD63和CD81表达。
1.5 荧光显微镜下观察软骨细胞在体外摄取外泌体将Dil工作液分别加入至含有10 μL(1 μg· μL-1)BMSCs-ExoWT和BMSCs-ExoMUEP管(1.5 mL)中并置于37℃、5%CO2孵箱30min,再100000 g离心1h,弃上清并用PBS冲洗1次,再100000 g离心1h,弃上清并用20 μL PBS冲悬。将悬液加入至软骨细胞不含血清的培养基中并放入37℃、5%CO2孵箱2、4和8h,采用荧光显微镜下观察软骨细胞摄取外泌体。
1.6 Western blotting法检测在IL-1β介导的炎症环境中软骨细胞中p38、p-p38、AKT、p-AKT、ERK和p-ERK蛋白表达常规胰酶消化第3代软骨细胞,吹打均匀接种至6孔板中,待细胞在孔中稳定增殖后,弃上清,用PBS冲洗3次,去除PBS后每孔分别加入1 mL(不含IL-1β和外泌体、含有10 μg·L-1 IL-1β、含有10 μg·L-1IL-1β+80 mg·L-1 BMSCs-ExoWT、含有10 μg·L-1IL-1β+80 mg·L-1 BMSCs-ExoMU)DMEM/F12无血清培养基,分别作为空白组、炎症组、BMSCs-ExoWT组和BMSCs-ExoMU组。置于细胞培养箱,24h后收集细胞,加入裂解液后提取总蛋白,BCA法检测蛋白水平。SDS-PAGE凝胶分离细胞蛋白,并转至PVDF膜,室温下5%的BSA封闭90 min后,按预染Marker剪裁转印膜,分别加入单克隆抗体4℃摇床过夜。次日TBST洗脱3次,加入二抗室温孵育1 h,再次洗脱3次后ECL法显影。所得结果采用Image-J进行分析,计算软骨细胞中p38、p-p38、AKT、p-AKT、ERK和p-ERK表达水平。
1.7 Hoechst33342染色法在荧光显微镜下检测软骨细胞凋亡小体胰酶消化对数期生长的第3代软骨细胞,吹打均匀并接种至6孔板,待细胞生长状态稳定后,弃上清,用PBS冲洗3次,去除PBS后每孔分别加入1mL(不含IL-1β和外泌体、含有10 μg·L-1IL-1β、含有10 μg·L-1 IL-1β+80 mg·L-1BMSCs-ExoWT、含有10 μg·L-1IL-1β+80 mg·L-1BMSCs-ExoMU)DMEM/F12无血清培养基,分别为空白组、炎症组、BMSCs-ExoWT组和BMSCs-ExoMU组。置于37℃、5%CO2孵箱,培养24 h后进行Hoechst33342染色,荧光显微镜下观察各组细胞内凋亡小体数目。
1.8 动物实验 1.8.1 细胞/软骨再生支架体外培养上述传代生长的BMSCs与BMSCsMU,长至约为培养皿底面积65%时,弃培养液,PBS冲洗1次,常规胰酶消化制备细胞悬液2 mL,密度为5×107mL-1,将软骨支架放置于6 cm培养皿中并加入细胞悬液,移至37℃、5%CO2孵箱培养5 h后,加入7mLDMEM/F12完全培养基,48 h后扫描电镜下观察软骨再生支架上BMSCs黏附情况。
1.8.2 造模实验兔耳缘静脉注射10%水合氯醛进行麻醉,把手术区域周围毛剃净,碘伏消毒,常规铺巾。将兔右后肢膝关节纵行切开皮肤及关节腔,用手摇钻在股骨髁间受力处钻一直径为6 mm深达软骨下骨的圆形孔洞,造成晚期膝关节软骨缺损的动物模型。造模后将12只实验兔随机分为4组:空白组(注射500 μL生理盐水于关节腔内)、支架组(注射500 μL生理盐水并在缺损处填充软骨支架)、支架+BMSCs-ExoWT组(注射500 μL浓度为20 mg·L-1的BMSCs-ExoWT并填充软骨支架)和支架+BMSCs-ExoMU组(注射500 μL浓度为20 mg·L-1的BMSCs-ExoMU并填充软骨支架)。术后6周处死实验兔并取材,观察软骨缺损愈合程度。
1.8.3 软骨缺损修复的组织学观察对各组膝关节软骨进行大体形态观察,软骨标本经10%多聚甲醛固定、10%乙二胺四乙酸脱钙4周、石蜡包埋、切片(2~5 μm)后进行HE和蕃红O染色,镜下观察软骨修复程度。
1.9 统计学分析采用SPSS 19.0统计软件进行统计学分析。各组软骨细胞中蛋白表达水平和凋亡小体数目均以x±s表示,组间比较采用单因素方差分析,两两比较采用SNK-q检验。所有体外实验均重复3次。以P < 0.05为差异有统计学意义。
2 结果 2.1 细胞转染与鉴定BMSCs经成骨诱导后茜素红染色镜下观察:部分细胞内钙结节被染成红色;BMSCs经成脂肪诱导后油红O染色镜下观察:部分细胞内出现被染橘红色脂肪滴。软骨细胞阿尔新兰染色镜下观察:细胞呈淡蓝色。BMSCs转染4h后荧光显微镜下观察:细胞内有GFP表达。见图 1(插页一)。
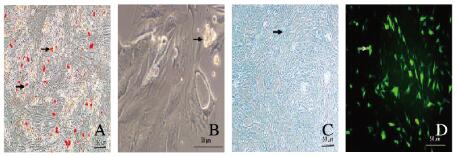
|
| A: BMSCs osteogenic induction(Aizarin red staining); B: BMSCs adipogenic induction(Oil red dye O); C: Alcian blue dyed chondrocytes; D: BMSCs transfection. 图 1 BMSCs和软骨细胞鉴定及BMSCs的转染(×100) Figure 1 Identification of BMSCs and chondrocytes and transfection of BMSCs (×100) |
|
|
透射电镜下观察收集的外泌体,其形态多为近圆形,有完整膜结构,内有低电子密度小颗粒(图 2A)。Western blotting法结果显示: BMSCs-ExoWT和BMSCs-ExoMU均表达了外泌体表面特异性分子标志物CD63和CD81(图 2B)。
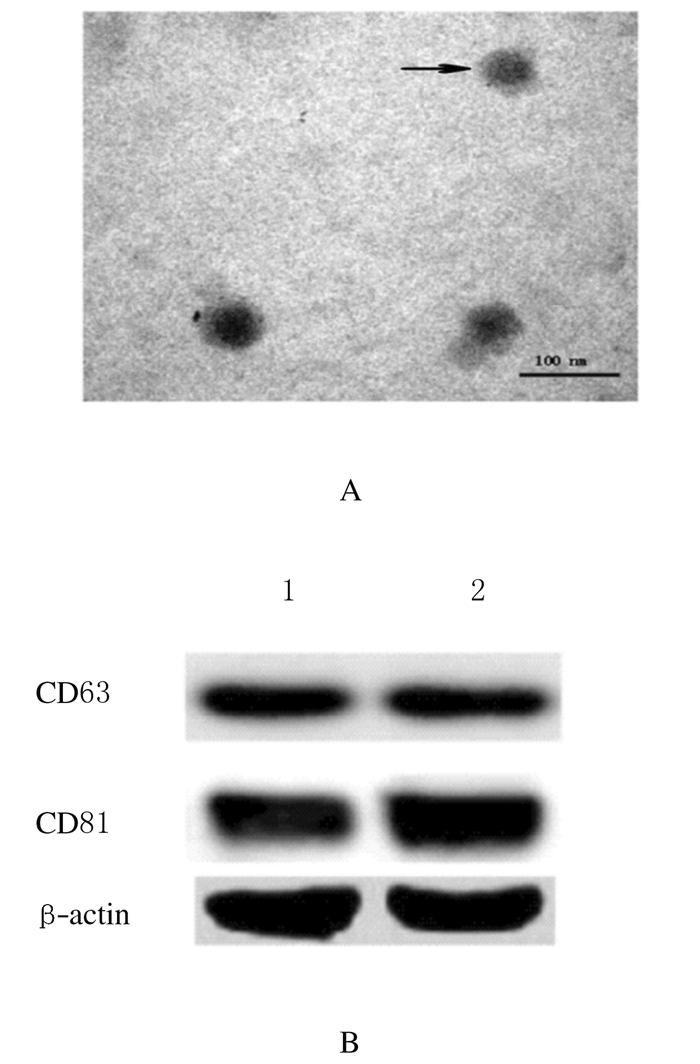
|
| A: Morphology of exosome under transmission electron microscope(×40000); B: Detection of CD63and CD81 by Western blotting method; Lane 1: BMSCs-ExoMU; Lane 2: BMSCs-ExoWT. 图 2 外泌体的鉴定 Figure 2 Identification of exosomes |
|
|
采用细胞膜红色荧光探针(Dil)标记的外泌体与软骨细胞共孵育2、4和8h后,荧光显微镜下可以观察到软骨细胞膜表面存在红色荧光点,且随着时间延长细胞表面荧光强度增加,可以进一步证明外泌体被软骨细胞所摄取。见图 3(插页一)。
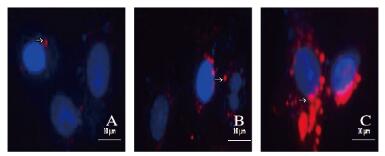
|
| A: Co-culturingfor2 h; B: Co-culturing for4 h; C: Co-culturing for 8 h. 图 3 荧光显微镜下观察软骨细胞对外泌体摄取(×400) Figure 3 Intake of exosomes in chondrocytes observed under fluorescence microscope(×400) |
|
|
与空白组比较,炎症组p-AKT水平降低(P < 0.05),p-p38和p-ERK水平升高(P < 0.05)。与炎症组比较,BMSCs-ExoWT组p-AKT水平升高(P < 0.05),p-p38和p-ERK水平降低(P < 0.05);BMSCs-ExoMU组p-AKT水平明显升高(P < 0.05),p-p38和p-ERK水平明显降低(P < 0.05)。与BMSCs-ExoWT组比较,BMSCs-ExoMU组p-AKT水平升高(P < 0.05),p-p38和p-ERK水平降低(P < 0.05)。见图 4和表 1。
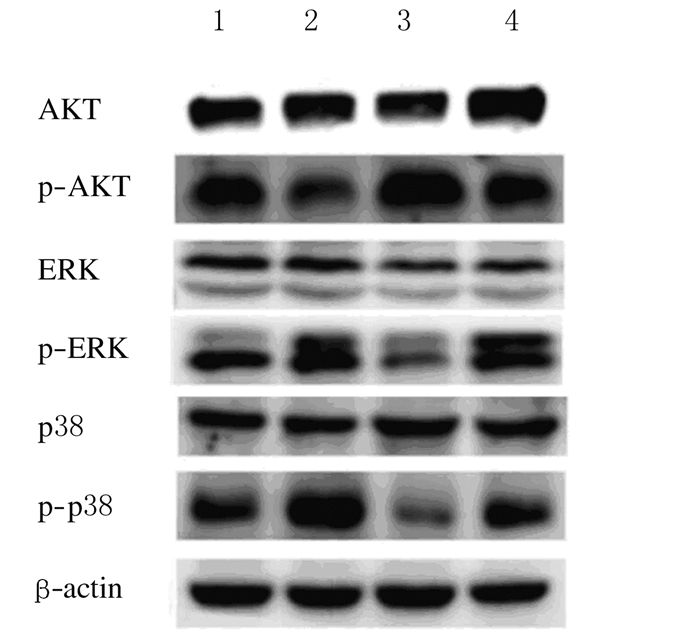
|
| Lane 1: Blank group; Lane 2: Inflammation group; Lane 3: BMSCs-ExoMU group; Lane 4:BMSCs-ExoWT group. 图 4 各组软骨细胞中AKT、p-AKT、p38、p-p38、ERK1/2和p-ERK1/2蛋白表达电泳图 Figure 4 Electrophoregram of expressions of AKT, p-AKT, p38, p-p38, ERK1/2 and p-ERK1/2 proteins in chondrocytes in various groups |
|
|
| (n=3, x±s) | |||
| Group | p-AKT/β-actin | p-ERK1/2/β-actin | p-p38/β-actin |
| Blank | 0.627±0.062 | 0.580±0.012 | 0.489±0.019 |
| Inflammation | 0.601±0.058* | 1.579±0.024* | 0.628±0.016* |
| BMSCs-ExoWT | 0.754±0.531△ | 1.023±0.049△ | 0.547±0.014△ |
| BMSCs-ExoMU | 1.244±0.060△# | 0.478±0.020△# | 0.224±0.038△# |
| *P < 0.05 compared with blank group; △P < 0.05 compared with inflammation group; #P < 0.05 compared with BMSCs-ExoWTgroup. | |||
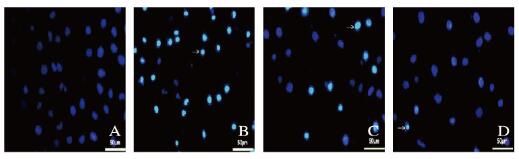
与空白组(2.300±0.949)比较,炎症组(31.800±4.984)软骨细胞核内凋亡小体明显增多(P < 0.01);与炎症组比较,BMSCs-ExoWT组(11.700±2.584)和BMSCs-ExoMU组(3.900±1.524)凋亡小体明显减少(P < 0.01),且BMSCs-ExoMU组凋亡小体最少。见图 5(插页一)。
|
| A: Blank group; B: Inflammation group; C: BMSCs-ExoWT group; D: BMSCs-ExoMU group. 图 5 各组软骨细胞中凋亡小体的Hoechst33342染色结果(Bar=50 μm) Figure 5 Results of Hoechst33342 staining of apoptotic bodies in chondrocytes in various groups (Bar=50 μm) |
|
|
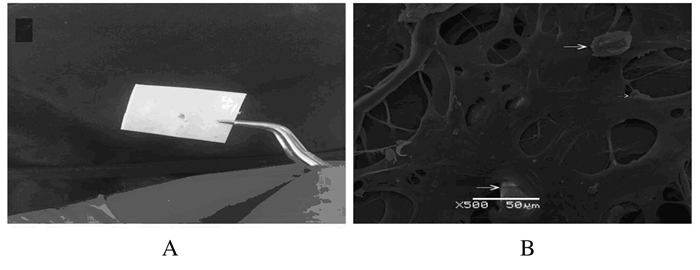
BMSCs与软骨再生支架共培养后,BMSCs已渗入软骨再生支架; BMSCs与软骨再生支架共培养48h后,BMSCs稳定黏附在软骨支架孔隙中。见图 6。
|
| 图 6 BMSCs与软骨再生支架共培养的肉眼(A)和扫描电镜(B)观察(Bar=50 μm) Figure 6 Observation of co-culture of cartilage regenerated scaffold with BMSCs by naked eye (A) and SEM (B) (Bar=50 μm) |
|
|
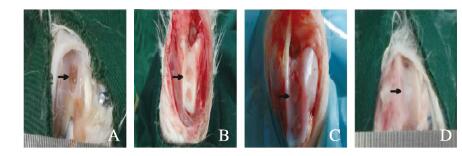
空白组缺损面积较大,未能与正常软骨组织紧密结合,缺损处与周围软骨组织界限明显,缺损周围粗糙;支架组软骨缺损面积较大,缺损处与正常软骨组织未能紧密结合,缺损处与周围软骨组织界限明显,缺损深度稍变浅;支架+BMSCs-ExoWT组缺损处有少量修复组织填充,软骨缺损面积较前减小,部分软骨缺损边际与正常软骨紧密结合,深度变浅,表面较前明显光滑;支架+BMSCs-ExoMU组缺损处被修复组织填充明显,富有弹性,缺损面积明显变小,深度明显变浅,表面光滑。见图 7(插页一)。
|
| A: Blank group; B: Scaffold group; C: Scaffold+BMSCsk-ExoWT group; D: Scaffold+BMSCs-ExoMU group. 图 7 各组软骨缺损处肉眼观察 Figure 7 Visual inspection of cartilage defects |
|
|
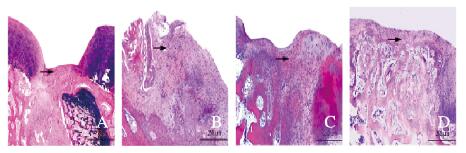
空白组软骨表面褶皱粗糙,结构不规则,潮线破坏,边缘骨赘形成,软骨损伤修复效果较差;支架组软骨表面不平,潮线尚完整,局部可见软骨细胞增生;支架+ BMSCs-ExoWT组软骨表面部分区域平滑,软骨细胞增生明显,缺损修复较好;支架+BMSCs-ExoMU组缺损处表面光滑,与周围软骨结合较好,细胞排列整齐,缺损处修复效果明显。见图 8(插页一)。
|
| A: Blank group; B: Scaffold group; C: Scaffold+BMSCs-ExoWT group; D: Scaffold+BMSCs-ExoMU group. 图 8 各组软骨缺损处HE染色结果(Bar=250 μm) Figure 8 Results of HE staining of cartilage defects in various groups (Bar=250 μm) |
|
|
空白组软骨缺损处有薄层纤维组织填充,软骨细胞极少,有较多成纤维细胞,缺损修复较差;支架组未见潮线形成,有少量软骨细胞生长,可见少量软骨基质,缺损修复较差;支架+BMSCs-ExoWT组软骨基质较多,软骨细胞数量较多,部分细胞体积较小,缺损修复较好;支架+BMSCs-ExoMU组软骨细胞基质丰富,材料与周围组织结合较好,细胞分化良好,形态类似正常软骨细胞,缺损修复明显。见图 9(插页一)。
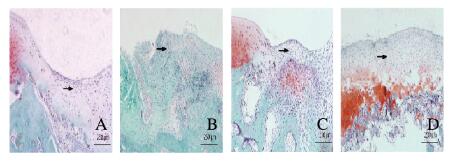
|
| A: Blank group; B: Scaffold group; C: Scaffold+BMSCs-ExoWT group; D: Scaffold+BMSCs-ExoMU group. 图 9 各组软骨缺损处蕃红O-固绿染色结果(Bar=250 μm) Figure 9 Results of Safranin O staining of cartilage defects in various groups (Bar=250 μm) |
|
|
关节软骨损伤和损伤后导致的蜕变是骨科常见的疾病。由于软骨本身再生能力有限,面积较大的软骨损伤或缺损很难自行修复。因此,研究促进关节软骨缺损再生的方法很有现实意义。
研究[7-8]显示:外泌体在炎症抑制过程中有显著作用,并且可以促进OA患者关节软骨缺损的修复。研究[9-10]显示:HIF-1α在软骨细胞生长和分化过程中起着至关重要的作用, 当软骨缺乏HIF-1α蛋白时会出现大量软骨细胞死亡现象。但生理状态下表达的HIF-1α在常氧状态下容易降解,在此基础上本实验通过使基因三点突变而产生一种在常氧下不易降解的HIF-1α。研究[11]显示:生理条件下,膝关节软骨细胞的增殖与凋亡处于动态平衡,但在OA等病理条件下,软骨细胞凋亡异常。软骨细胞凋亡受不同信号通路调控,PI3K/AKT和p38 MAPK信号通路在OA软骨细胞凋亡的过程中起着重要作用。PI3K是一种细胞内磷脂酰肌醇激酶,其代谢产物1,4,5-三磷酸肌醇(PIP3)与4, 5-二磷酸磷脂酰肌醇(PIP2)可激活AKT蛋白上的丝氨酸或苏氨酸磷酸化位点,从而调节细胞的增殖、分化、凋亡以及迁移等[12];p38 MAPK信号通路存在于哺乳动物的细胞内,是MAPKs的亚类之一,炎症因子IL-1β能有效激活p38信号通路,且激活后的p38又可激活相关蛋白激酶和转录因子,从而调控软骨细胞凋亡[13-14];MAPK/ERK信号通路是一类细胞内丝氨酸/苏氨酸蛋白激酶,能将细胞外刺激信号转导至细胞及其核内,引起相关细胞生物学反应(如细胞增殖、分化和凋亡等)[15-16]。先期研究[17-20]显示:炎症因子IL-1β在体外诱导兔软骨细胞凋亡同时伴随着AKT磷酸化水平升高与ERK1/2、p38磷酸化水平降低。本研究结果显示:在IL-1β介导的炎症环境中,经BMSCs-ExoWT和BMSCs-ExoMU处理后,细胞内凋亡小体明显减少,ERK1/2和p38磷酸化水平明显降低,AKT磷酸化水平明显升高,且经BMSCs-ExoMU处理后的效果更为明显。
近年来再生医学技术在治疗关节软骨损伤过程中已经初步显示出良好效果[3],但是,材料与外泌体的联合应用在软骨缺损修复方面的研究还鲜有报道。在此基础上,本课题组合作团队设计、开发了一种免疫原性低、力学强度高、具有良好的微观孔隙结构和适宜的孔隙率及孔径大小、有利于细胞的迁入与营养成分的渗入、适宜种子细胞向软骨方向分化的无细胞的软骨再生支架,可以促进软骨缺损修复。在本研究中,当联合应用BMSCs-ExoWT、BMSCs-ExoMU与软骨再生支架作用于软骨缺损处时,缺损处修复较为明显,且BMSCs-ExoMU与软骨再生支架共同作用于软骨缺损处时,其修复效果更加显著。
综上所述,本实验证实了在炎症环境中BMSCs-ExoMU可抑制软骨细胞凋亡,其通过调控PI3K/AKT、p38 MAPK和MAPK/ERK信号通路明显下调ERK1/2和p38磷酸化水平,上调AKT磷酸化水平,这可能是其控制炎症反应的可能机制之一;本实验结果也证实了当BMSCs-ExoMU与软骨再生支架共同作用于软骨缺损处时,能更有效促进软骨缺损修复。本研究结果为临床关节软骨缺损的治疗提供了新的思路。
| [1] | 袁普卫, 杨威, 康武林, 等. 骨性关节炎发病机制研究进展[J]. 中国骨质疏松杂志, 2016, 22(7): 902–906. |
| [2] | Liu-Bryan R, Terkeltaub R. The growing array of innate inflammatory ignition switches in osteoarthritis[J]. Arthritis Rheum, 2012, 7(7): 2055–2058. |
| [3] | 范宏斌, 胡蕴玉, 李旭升, 等. 明胶-硫酸软骨素-透明质酸钠作为组织工程软骨支架的实验研究[J]. 中国修复重建外科杂志, 2005, 19(6): 473–477. |
| [4] | Casado JG, Blázqutz R, Vela FJ, et al. Mesenchymal stem cell-derived exosomes:immunomodulatory evaluation in an intigen-induced synovitis porcine model[J]. Front Vet Sci, 2017, 4: 39. |
| [5] | Pfander D, Gramer T, Schipani E, et al. HIF-1alpha controls extracellular matrix synthesis by epiphyseal chondrocytes[J]. J Cell Sci, 2003, 116(Pt9): 1819–1826. |
| [6] | Chen WP, Wu LD. Chlorogenic acid suppresses interleukin-1β-induced inflammatory mediators in human chondrocytes[J]. Int J Clin Exp Pathol, 2014, 7(12): 8797–8801. |
| [7] | Ti D, Hao H, Fu X, et al. Mesenchymal stem cells-derived exosomal microRNAs contribute to wound inflammation[J]. Sci China Life Sci, 2016, 59(2): 1305–1312. |
| [8] | Toh WS, Lai RC, Hui JHP, et al. MSC exosome as a cell-free MSC therapy for cartilage regeneration:implications for osteoarthritis treatment[J]. Semin Cell Dev Biol, 2017, 67: 56–64. DOI:10.1016/j.semcdb.2016.11.008 |
| [9] | Aro E, Khatri R, Gerard-Óriley R, et al. Hypoxia-inducible factor-1(HIF-1) but not HIF-2 is essential for hypoxic induction of collagen prolyl 4-hydroxylases in primary newborn mouse epiphyseal growth platechondrocytes[J]. J Biol Chem, 2012, 287(44): 37134–37144. DOI:10.1074/jbc.M112.352872 |
| [10] | Maes C, Araldi E, Haiqh K, et al. VEGF-independent cell-autonomous functions of HIF-1α regulating oxygen consumption in fetal cartilage are critical for chondrocyte survival[J]. J Bone Miner Res, 2012, 27(3): 596–609. DOI:10.1002/jbmr.1487 |
| [11] | Huang Y, Wu D, Fan W. Protection of ginsenoside Rg1 on chondrocyte from IL-1β-induced mitochondria-activated apoptosis through PI3K/Akt signaling[J]. Mol Cell Biochem, 2014, 392(1/2): 249–257. |
| [12] | Xu CQ, Liu BJ, Wu JF, et al. Icariin attenuates LPS-induced acute inflammatory responses:involvement of PI3K/Akt and NF-kappaB signaling pathway[J]. Eur J Pharmacol, 2010, 642(1-3): 146–153. DOI:10.1016/j.ejphar.2010.05.012 |
| [13] | 赵青, 万毅刚, 王朝俊, 等. 慢性肾脏病肾组织炎症信号通路p38MAPK的调节机制及中药的干预作用[J]. 中国中药杂志, 2012, 37(12): 1700–1704. |
| [14] | Min J, Li X, Huang K, et al. Phloretin induces apoptosis of non-small cell lung carcinoma A549 cells via JNK1/2 and p38 MAPK pathways[J]. Oncol Rep, 2015, 34(6): 2871–2879. DOI:10.3892/or.2015.4325 |
| [15] | Patraca I, Martínez N, Busquets O, et al. Anti-inflammatory role of Leptin in glial cells through p38 MAPK pathway inhibition[J]. Pharmacol Rep, 2017, 69(3): 409–418. DOI:10.1016/j.pharep.2016.12.005 |
| [16] | Chen Y, Ba L, Huang W, et al. Role of carvacrol in cardioprotection against myocardial ischemia/reperfusion injury in rats through activation of MAPK/ERK and Akt/eNOS signaling pathways[J]. Eur J Pharmacol, 2017, 796: 90–100. DOI:10.1016/j.ejphar.2016.11.053 |
| [17] | Martinez-Lopez N, Singh R. ATGs:Scaffolds for MAPK/ERK signaling[J]. Autophagy, 2014, 10(3): 535–537. DOI:10.4161/auto.27642 |
| [18] | Wang J, Hendrix A, Hernot S, et al. Bone marrow stromal cell-derived exosomes as communicators in drug resistance in multiple myeloma cells[J]. Blood, 2014, 124(4): 555–566. DOI:10.1182/blood-2014-03-562439 |
| [19] | Van Vulpen LF, Schutgens RE, Coeleveld K, et al. IL-1β, in contrast to TNFα, is pivotal in blood-induced cartilage damage and is a potential target for therapy[J]. Blood, 2015, 126(19): 2239–2246. DOI:10.1182/blood-2015-03-635524 |
| [20] | Jiang Y, Hu C, Yu S, et al. Cartilage stem/progenitor cells are activated in osteoarthritis via interleukin-1β/nerve growth factor signaling[J]. Arthritis Res Ther, 2015, 17(11): 1478–1487. |
 2018, Vol. 44
2018, Vol. 44


