扩展功能
文章信息
- 王孝芸, 蓝楠, 唐红梅, 袁谢芳, 王星, 李国平
- WANG Xiaoyun, LAN Nan, TANG Hongmei, YUAN Xiefang, WANG Xing, LI Guoping
- Lyn对屋尘螨诱导的人支气管上皮细胞中MUC5AC表达的影响及其机制
- Effect of Lyn on expression of MUC5AC in human bronchial epithelial cells induced by house dust mite and its mechanism
- 吉林大学学报(医学版), 2018, 44(02): 211-215
- Journal of Jilin University (Medicine Edition), 2018, 44(02): 211-215
- 10.13481/j.1671-587x.20180202
-
文章历史
- 收稿日期: 2017-08-01
2. 西南医科大学附属医院呼吸内一科, 四川 泸州 646000
2. First Department 1 of Respiratory Medicine, Affiliated Hospital, Southwest Medical University, Luzhou 646000, China
哮喘是当前世界面临的重要健康问题,其发病率和死亡率逐年上升。气道黏液高分泌是哮喘的重要特征,在重症哮喘发作时尤其明显。如何抑制黏液高分泌成为哮喘防治需解决的关键问题[1]。气道黏液是一种胶状液体,分布于气道表面,是气道上皮细胞的物理屏障。然而过度的黏液分泌和黏液清除下降可导致黏液在气道聚集和阻塞气道,导致患者明显咳嗽和呼吸困难,并增加患者死亡率。近年研究[2]显示:黏液高分泌可引起气道高反应,阻碍炎症的逆转和多余黏液的清除。黏蛋白是黏液中的主要蛋白成分,是一种糖基化蛋白,其编码基因为MUC,迄今为止已发现11种黏蛋白基因(MUC1、MUC2、MUC3、MUC4、MUC5AC、MUC5B、MUC6、MUC7、MUC8,MUC13和MUC19)在肺部表达[3-4]。气道黏蛋白主要包括MUC2、MUC4、MUC5AC和MUC5B。MUC5AC和MUC5B在气道表达最多,尤其是MUC5AC,在气道杯状细胞中高表达,是黏液细胞增生和化生的标志。轻中度哮喘患者主要产生富含MUC5AC黏蛋白的黏液,致死性哮喘患者明显存在MUC5AC和MUC5B高表达[5-6]。
MUC5AC产生主要通过白细胞介素13(IL-13)/白细胞介素4受体α(interleukin-4 receptor α, IL-4Rα)复合物和表皮生长因子受体(epithelial growth factor receptor, EGFR)2条途径来调节。白细胞介素4(interleukin-4, IL-4)和IL-13均属于辅助性T细胞(helper T cell)2型细胞因子(Th2),在哮喘的发生和发展中发挥重要作用,二者均通过IL-4Rα传递信号。IL-4R途径与信号传导及转录激活因子6(signal transducers and activators of transcription 6, STAT6)活化有关。研究[7]显示:在小鼠气道Clara细胞中,过敏原介导的黏液高分泌依赖于Clara细胞的IL-4Rα信号途径。近来研究[8]显示:IL-4还可通过介导含脂筏的小窝蛋白的聚集影响人支气管上皮细胞中MUC5AC的合成。信号转录子与转录活化子STAT6在IL-13的活化下激活,引起MUC5AC产生、黏液腺化生和气道高反应性[7]。屋尘螨(house dust mite, HDM)在过敏性哮喘中起着重要作用,是过敏性哮喘发生的重要致敏原。研究[9]显示:在过敏性炎症中HDM可以破坏上皮细胞黏膜屏障并且激活T细胞,引起IL-4和IL-13等Th2型细胞因子的产生。另有研究[10]显示亚洲沙尘螨可引起小鼠气道上皮细胞中MUC5AC的高表达从而影响气道黏液分泌。有研究[11]显示:HDM可通过EGFR信号途径破坏气道上皮屏障功能。受体酪氨酸蛋白激酶是细胞信号传导的关键信号酶,在免疫应答和炎症反应等过程中起着重要的生理病理作用。Lyn激酶是非受体酪氨酸激酶Src家族成员之一。Lyn与许多信号途径有关,参与了哮喘炎症与气道重塑发生,但在哮喘发病中的具体机制不明。本研究构建人MUC5AC启动子荧光素酶报告基因,观察在HDM刺激作用下Lyn激酶对MUC5AC表达的影响及Lyn对MUC5AC表达的调节是否依赖于调节STAT6途径。
1 材料与方法 1.1 细胞、主要试剂和仪器16HBE细胞为本实验室保存。限制性内切酶(美国MBI公司),T4DNA连接酶、dNTP、Taq酶及buffer(中国TaKaRa公司),高糖DMEM(中国Hyclone公司),OPTI-MEM和胎牛血清(美国Gibco公司),脂质体2000(美国Invitrogen公司),双荧光素酶报告基因检测试剂盒(美国Promega公司),HDM提取液(美国GEER公司),pRL-TK质粒(中国百替生物公司),BCA蛋白浓度试剂盒、SDS-PAGE凝胶配制试剂盒、SDS-PAGE蛋白上样缓冲液(5×)和预染蛋白质相对分子质量标准(中国Beyotime公司),LynsiRNA、MUC5AC一抗、STAT6一抗和辣根过氧化物酶二抗(美国SantaCruz公司),FITC标记二抗(英国Abcam公司),Western blotting化学发光液(美国Millipore公司)。水平电泳仪(中国天能公司),荧光报告检测仪(美国Promega公司),细胞培养箱(日本Sanyo公司),垂直电泳仪(美国Bio-Rad公司),共聚焦显微镜(德国Leica公司)。
1.2 构建人MUC5AC启动子荧光报告基因通过NCBI基因数据库确定MUC5AC基因启动子区域(-1300/+48),设计扩增-1300/+48启动子的引物,应用基因重组及PCR等技术,构建人MUC5AC启动子荧光报告基因(pGL3-hMUC5AC/-1300/+48)。
1.3 双荧光素酶报告基因检测① 用含5%胎牛血清的高糖DMEM培养基于24孔板培养16HBE细胞,培养条件为37℃、5%CO2。细胞设PBS组和HDM组待细胞融合度为40%~50%时,用LynsiRNA分别转染对照组和HDM组细胞。待细胞继续生长至融合度为80%~90%时,用Invitrogen脂质体2000试剂盒将pGL3-hMUC5AC/-1300/+48和pRL-TK二质粒转染至16HBE细胞。转染步骤如下:a.用50μLOPti-MEM培养基稀释相应的DNA或者RNA;b.用50μL OPti-MEM稀释适量的脂质体,室温静置5min;c.稀释的DNA或RNA和脂质体混匀,室温静置20min;d.将混合物加至24孔板,轻轻吹匀,前后摇动24孔板。②弃掉旧培养基,用PBS清洗2次。加不含抗生素和血清的高糖DMEM培养基继续培养,并用1 μg·L-1的HDM提取液刺激转染质粒后的细胞24 h,然后采用Promega双荧光素酶报告基因检测试剂盒检测16HBE细胞中pGL3-hMUC5AC/-1300/+48基因的相对荧光素酶活性(relative luciferase unit, RLU)。RLU=RLU1/RLU2, RLU1为萤火虫荧光素酶反应强度,RLU2为内参海肾荧光素酶反应强度。
1.4 免疫荧光法检测16HBE细胞中MUC5AC表达水平① 用共聚焦培养皿培养16HBE细胞,分为LynsiRNA转染组和非LynsiRNA转染组。细胞融合度为40%~50%时,用Invitrogen脂质体2000试剂盒进行LynsiRNA转染,37℃培养(转染方法如前所述)。转染4h后换含血清的新鲜DMEM。采用浓度为1μg·L-1的HDM刺激细胞24h,同时设PBS对照组。②加4%多聚甲醛固定30min,用0.2%Triton穿孔15 min,PBS漂洗2次,每次5min;用1%BSA封闭30 min;加抗MUC5AC抗体(1:100)于4℃孵育过夜,PBS漂洗;加FITC标记的二抗(1:200),室温避光孵育1h,PBS漂洗,在Leica共聚焦显微镜下观察各组细胞中MUC5AC表达水平。MUC5AC表达水平以相对荧光强度表示,采用Leica共聚焦显微镜自带软件分析。
1.5 Western blotting检测16HBE细胞中STAT6表达水平① 用60mm培养皿培养16HBE细胞,分为LynsiRNA转染组和非LynsiRNA转染组,转染步骤按Invitrogen脂质体2000试剂盒说明操作,转染4h后换含血清的新鲜DMEM。用浓度为1μg·L-1的HDM分别刺激LynsiRNA干扰组和非LynsiRNA干扰组细胞24h,并设PBS对照组。②去除培养液,PBS漂洗,每个培养皿加300μL Western blotting及IP细胞裂解液和3μL的PMSF,冰上静置5 min。用细胞刮刮下细胞,将裂解的细胞转移到1.5mL EP管并离心10 min(4℃、12000r·min-1)。将上清液转移到新EP管,加5×SDS上样缓冲液,100℃煮沸5min,冷却后-20℃保存。③用BCA蛋白浓度试剂盒测定各组蛋白浓度;配制10%的SDS聚丙烯酰胺凝胶(SDS-PAGE),每孔加20μg蛋白样品;100V恒压垂直电泳90min;将分离的蛋白用Bio-Rad湿转仪转到PVDF膜上,转膜条件为100 mA恒流转膜4 h;用5%的脱脂奶粉封闭膜上非特异性位点,封闭时间为1h;分别加内参β-actin和STAT6一抗(1:200),4℃孵育过夜;用TBST缓冲液漂洗2次,每次10min;加相应的二抗(1:800),室温孵育1h,TBST缓冲液漂洗如前;最后加辣根过氧化物酶标记的化学发光液,采用美国Bio-Rad公司的ChemiDoc Touch成像系统曝光成像。采用AlphaEaseFC软件分析目的条带的相对灰度值(以β-actin为内参),以STAT6/β-actin表示STAT6表达水平。
1.6 统计学分析采用SPSS 17.0统计学软件进行统计学分析。各组16HBE细胞中RLU、MUC5AC和STAT6表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析(ANOVA法)。以P < 0.05表示差异有统计学意义。
2 结果 2.1 pGL3-MUC5AC/-1300/+48载体构建将pMD19-TS-MUC5AC/-1300/+48片段亚克隆至pGL3-enhance载体,阳性克隆经KnpⅠ和XhoⅠ双酶切鉴定,可切出约1 340 bp的MUC5AC/-1300/+48片段带和约5 000 bp的载体带。见图 1。
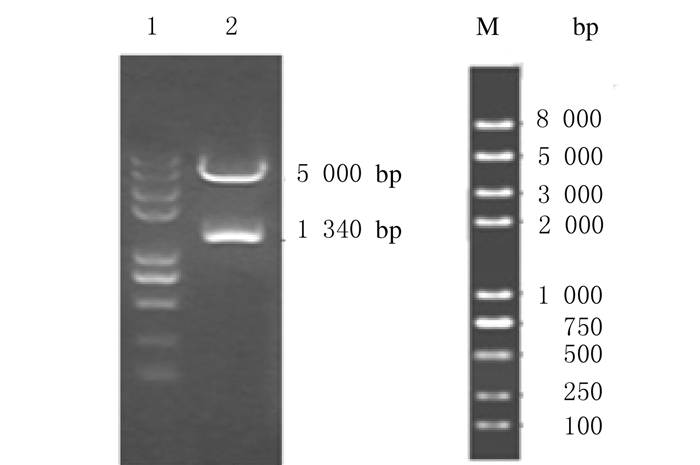
|
| Lane 1: DNA marker; Lane 2: pGL3-MUC5AC/-1300/+48; M: DNA marker 2 000 bp plus. 图 1 pGL3-MUC5AC/-1300/+48酶切鉴定 Figure 1 Identification of pGL3-MUC5AC/-1300/+48 with restriction enzyme digestion |
|
|
HDM组pGL3-hMUC5AC/-1300/+48基因的RLU高于PBS组(PBS组:4.210±0.036;HDM组:7.030±0.176) (P < 0.05);LynsiRNA干扰HDM组细胞后,RLU明显升高(HDM组:7.030±0.176;HDM LynsiRNA组:10.080±0.442)(P < 0.05)。
2.3 各组16HBE细胞中MUC5AC表达水平采用浓度为1 μg·L-1的HDM刺激16HBE细胞24h后,采用免疫荧光法检测各组细胞中MUC5AC表达水平,共聚焦显微镜观察结果见图 2(插页一)。HDM组16HBE细胞中MUC5AC表达水平高于PBS组(PBS组:29.480±1.581; HDM组:66.700±2.780) (P < 0.05);LynsiRNA干扰HDM组细胞后,其MUC5AC表达水平高于未干扰时(HDM组:66.70±2.78;HDM LynsiRNA组:93.61±2.65)(P < 0.05)。
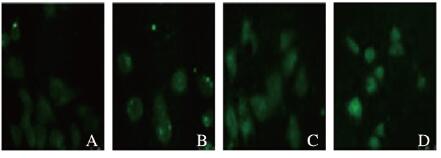
|
| A:PBS group; B: PBS+LynsiRNA group; C:HDM group; D:HDM+LynsiRNA group. 图 2 免疫荧光法检测16HBE细胞中MUC5AC表达(×200) Figure 2 Expressions of MUC5AC in 16HBE cells detected by immunofluorescence method(×200) |
|
|
采用Western blotting法检测HDM刺激下人支气管上皮细胞(16HBE)中STAT6的表达水平。LynsiRNA干扰后HDM组细胞中STAT6表达水平(118.98±1.77)高于未干扰时(88.23±2.04)(P < 0.05)。见图 3。
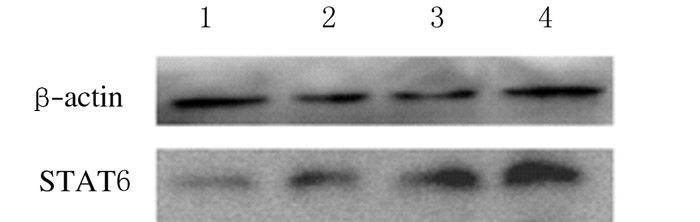
|
| Lane 1:PBS group; Lane 2:PBS+LynsiRNA group; Lane 3:HDM group; Lane 4:HDM+LynsiRNA group. 图 3 Western blotting法检测各组16HBE细胞中STAT6表达电泳图 Figure 3 Electrophorogram of expressions of STAT6 in 16HBE cells in various groups detected by Western blotting method |
|
|
气道黏液高分泌是哮喘的重要特征,抑制气道黏液高分泌是防治哮喘、尤其是严重哮喘的关键[12-13]。黏蛋白是黏液中的主要蛋白成分,其编码基因为黏蛋白基因MUC,迄今为止已发现11种黏蛋白基因。已有研究[6, 14]显示:MUC5AC在气道中表达最多,对气道黏液高分泌有重要作用, 因此对MUC5AC基因表达及其调节机制的研究对于临床治疗哮喘有重要意义。气道黏液高分泌与IL-4和IL-13等Th2型细胞因子相关,主要通过IL-4Rα途径传递信号。IL-4Rα途径与STAT6活化密切相关。IL-4Rα途径可激活JAK3、JAK2和TYK2等激酶,从而使STAT6磷酸化。磷酸化的STAT6二聚体向核迁移并与IL-4和IL-13启动子结合,由此影响Th2细胞分化,引起气道高反应和气道黏液高分泌[7, 15]。HDM是过敏性哮喘的重要致敏原,研究[16]显示约有50%的哮喘患者对HDM变应原过敏。有研究[9, 17]显示:HDM可破坏气道上皮屏障,并激活T细胞,引起IL-4和IL-13等细胞因子的释放,发生以Th2型为主的免疫应答反应。另有研究[10]显示:亚洲沙尘螨可引起小鼠气道上皮细胞中MUC5AC的高表达从而影响气道黏液分泌。但有关HDM和MUC5AC之间关系的研究还很少。本研究采用浓度为1μg·L-1的重组HDM提取液刺激人支气管上皮细胞发现:HDM可引起人支气管上皮细胞中MUC5AC的高表达,说明HDM可诱导气道黏液高分泌。Lyn属于Src家族,是一种非受体酪氨酸激酶,在除了T淋巴细胞以外的造血细胞上表达,是细胞信号转导的关键信号酶,在免疫应答和炎症反应等过程中起着重要的生理病理作用。有研究[18]显示:Lyn对造血干细胞、中性粒细胞、巨噬细胞、树突状细胞和血小板等具有正向和负向的双重调节作用。Lyn缺陷小鼠容易发生骨髓增生和免疫性疾病。Lyn基因敲除小鼠出现严重和持续的变态反应炎症、血清IgE水平升高和Th2免疫应答表明:Lyn激酶可能是一个重要的阴性调节Th2免疫应答的激酶,但其具体调节作用不明[19]。有研究[20]显示IL-13可通过STAT6-TMEM16A-ERK1/2途径引起MUC5AC高表达。也有研究[21]显示Rho激酶抑制剂法舒地尔可通过调节STAT6和NF-κB减轻过敏性气道炎症和下调MUC5AC的表达。这些研究结果皆提示STAT6在MUC5AC表达中起着重要作用。本研究采用LynsiRNA抑制Lyn在人支气管上皮细胞的表达,同时采用1 μg·L-1的重组HDM提取液刺激LynsiRNA干扰的人支气管上皮细胞和正常对照上皮细胞。双荧光报告基因检测和免疫荧光检测结果显示:采用LynsiRNA干扰人支气管上皮细胞后,MUC5AC表达要高于正常对照细胞,说明Lyn缺失可增加人支气管上皮细胞中MUC5AC表达。而Western blotting检测结果也提示Lyn缺失可能通过上调STAT6的水平增加人支气管上皮细胞中MUC5AC的表达。
本研究说明Lyn和人支气管上皮细胞中MUC5AC表达有关,Lyn缺失可通过上调STAT6的水平而增加人支气管上皮细胞中MUC5AC的表达。本研究结果对阐明Lyn在哮喘气道黏液高分泌作用机制和发现新的治疗靶点具有重要作用。
| [1] | Xiang YY, Wang S, Liu M, et al. A GABAergic system in airway epithelium is essential for mucus overproduction in asthma[J]. Nat Med, 2007, 13(7): 862–867. DOI:10.1038/nm1604 |
| [2] | Rubin BK, Priftis KN, Schmidt HJ, et al. Secretory hyperresponsiveness and pulmonary mucus hypersecretion[J]. Chest, 2014, 146(2): 496–507. DOI:10.1378/chest.13-2609 |
| [3] | Thai P, Loukoianov A, Wachi S, et al. Regulation of airway mucin gene expression[J]. Annu Rev Physiol, 2008, 70: 405–429. DOI:10.1146/annurev.physiol.70.113006.100441 |
| [4] | Johnson DC. Airway mucus function and dysfunction[J]. N Engl J Med, 2011, 364(10): 978. DOI:10.1056/NEJMc1014719 |
| [5] | Hewson CA, Haas JJ, Bartlett NW, et al. Rhinovirus induces MUC5AC in a human infection model and in vitro via NF-κB and EGFR pathways[J]. Eur Respir J, 2010, 36(6): 1425–1435. DOI:10.1183/09031936.00026910 |
| [6] | Rose MC, Voynow JA. Respiratory tract mucin genes and mucin glycoproteins in health and disease[J]. Physiol Rev, 2006, 86(1): 245–278. DOI:10.1152/physrev.00010.2005 |
| [7] | Xia Y, Cai PC, Yu F, et al. IL-4-induced caveolin-1-containing lipid rafts aggregation contributes to MUC5AC synthesis in bronchial epithelial cells[J]. Respir Res, 2017, 18(1): 174. DOI:10.1186/s12931-017-0657-z |
| [8] | Kuperman DA, Huang X, Nguyenvu L, et al. IL-4 receptor signaling in Clara cells is required for allergen-induced mucus production[J]. J Immunol, 2005, 175(6): 3746–3752. DOI:10.4049/jimmunol.175.6.3746 |
| [9] | Wang JY. The innate immune response in house dust mite-induced allergic inflammation[J]. Allergy Asthma Immunol Res, 2013, 5(2): 68–74. DOI:10.4168/aair.2013.5.2.68 |
| [10] | Kang IG, Jung JH, Kim ST. Asian sand dust enhances allergen-induced th2 allergic inflammatory changes and mucin production in BALB/c mouse lungs[J]. Allergy Asthma Immunol Res, 2012, 4(4): 206–213. DOI:10.4168/aair.2012.4.4.206 |
| [11] | LE YQ, Dong HM, Wang YH, et al. Role of epidermal growth factor receptor in house dust mite-induced airway epithelial barrier dysfunction[J]. J South Med Univ, 2017, 37(6): 737–743. |
| [12] | Evans CM, Kim K, Tuvim MJ, et al. Mucus hypersecretion in asthma:causes and effects[J]. Curr Opin Pulm Med, 2009, 15(1): 4–11. DOI:10.1097/MCP.0b013e32831da8d3 |
| [13] | Raclawska DS, Ttofali F, Fletcher AA, et al. Mucins and their sugars[J]. Ann Am Thor Soc, 2016, 13(Suppl 1): S98–99. |
| [14] | Evans CM, Raclawska DS, Ttofali F, et al. The polymeric mucin Muc5ac is required for allergic airway hyperreactivity[J]. Nat Commun, 2015, 6: 6281. DOI:10.1038/ncomms7281 |
| [15] | Hershey GK. IL-13 receptors and signaling pathways:an evolving web[J]. J Allergy Clin Immunol, 2003, 111(4): 677–690. DOI:10.1067/mai.2003.1333 |
| [16] | Calderón MA, Kleine-Tebbe J, Linneberg A, et al. House dust mite respiratory allergy:An overview of current therapeutic strategies[J]. J Allergy Clin Immunol Pract, 2015, 3(6): 843–855. DOI:10.1016/j.jaip.2015.06.019 |
| [17] | Reithofer M, Jahn-Schmid B. Allergens with protease activity from house dust mites[J]. Int J Mol Sci, 2017. DOI:10.3390/ijms18071368 |
| [18] | Scapini P, Pereira S, Zhang H, et al. Multiple roles of Lyn kinase in myeloid cell signaling and function[J]. Immunol Rev, 2009, 228(1): 23–40. DOI:10.1111/imr.2009.228.issue-1 |
| [19] | Beavitt SJ, Harder KW, Kemp JM, et al. Lyn-deficient mice develop severe, persistent asthma:Lyn is a critical negative regulator of Th2 immunity[J]. J Immunol, 2005, 175(3): 1867–1875. DOI:10.4049/jimmunol.175.3.1867 |
| [20] | Yan F, Li W, Zhou H, et al. Interleukin-13-induced MUC5AC expression is regulated by a PI3K-NFAT3 pathway in mouse tracheal epithelial cells[J]. Biochem Biophys Res Commun, 2014, 446(1): 49–53. DOI:10.1016/j.bbrc.2014.02.051 |
| [21] | Xie T, Luo G, Zhang Y, et al. Rho-kinase inhibitor fasudil reduces allergic airway inflammation and mucus hypersecretion by regulating STAT6 and NF-κB[J]. Clin Exp Allergy:J Br Soc Allergy Clin Immunol, 2015, 45(12): 1812–1822. DOI:10.1111/cea.2015.45.issue-12 |
 2018, Vol. 44
2018, Vol. 44


