扩展功能
文章信息
- 王建行, 姜妍, 王妍, 吴磊, 穆玉, 韩淑英
- WANG Jianxing, JIANG Yan, WANG Yan, WU Lei, MU Yu, HAN Shuying
- 荞麦花叶发酵提取物对2型糖尿病db/db小鼠肾损伤的影响
- Influence of extract from fermented buckwheat flower and leaf in kidney injury in type 2 diabetic db/db mice
- 吉林大学学报(医学版), 2018, 44(01): 95-100
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 95-100
- 10.13481/j.1671-587x.20180118
-
文章历史
- 收稿日期: 2017-07-17
2. 华北理工大学冀唐学院教学管理部, 河北 唐山 063000;
3. 华北理工大学基础医学院药理学教研室, 河北 唐山 063000;
4. 河北省慢性疾病 重点实验室及唐山市慢性病临床基础研究重点实验室, 河北 唐山 063000
2. Teaching Management Department, JitangCollege, North China University of Science and Technology, Tangshan 063000, China;
3. Department of Pharmacology, School of Basic Medical Sciences, North China University of Science and Technology, 063000, China;
4. Hebei Key Laboratory of Chronic Diseases, Tangshan Key Laboratory of Clinical and Basic Research of Chronic Diseases, Tangshan 063000, China
糖尿病肾损伤是一种糖尿病病程中最常见且最严重的慢性并发症,是糖尿病全身性微血管病变表现之一,其以肾小球滤过率降低、肾小球外基质堆积和肾小球纤维化为主要病理特征[1],持续发展可致终末期肾功能衰竭[2]。近年来随着糖尿病患者的增多,糖尿病肾损伤的发病率亦逐年上升,其发病机制尚不清楚。
前期研究[3-6]显示:从荞麦花叶中提取的黄酮具有降糖、降脂、改善胰岛素抵抗、改善微循环、抗氧化和抗炎等作用,并对实验性糖尿病大鼠肾脏具有一定的保护作用。近期对荞麦花叶进行酵母菌发酵处理,发现其黄酮含量有所降低[7],表明微生物发酵后成分有所改变,且其发酵后的提取物可显著降低db/db小鼠随机血糖[8],并对db/db小鼠肾组织中血管内皮生长因子(vascular endothetial growth factor, VEGF)和基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9)蛋白表达有明显的影响[9],但其对肾脏的作用尚未明确。本实验是在前期研究的基础上,研究荞麦花叶发酵提取物(extract from fermented buckwheat flower and leaf,EFBFL)对自发肥胖2型糖尿病db/db小鼠的肾脏损伤的保护作用,并进一步探讨其可能的机制。
1 材料与方法 1.1 实验动物、药品、试剂和主要仪器8周龄SPF级db/db、db/m小鼠,雄性,体质量(35±5)g,购自常州卡文斯实验动物有限公司,动物许可证号:SCXK(苏)2001-0003。荞麦花叶:内蒙古通辽市库伦旗。EFBFL的制备:将活化增殖的酵母菌液加入干燥的荞麦花叶粉末中,给予蛋白胨和葡萄糖营养,置37℃恒温箱中培养48h,用70%乙醇回流提取2h,离心取上清液,合并滤液,70℃浓缩干燥,即得EFBFL。小鼠过氧化物酶体增殖物激活受体γ(PPARγ)单克隆抗体(货号:sc-7273)和小鼠核因子κB(NK-κB)单克隆抗体(货号:sc-372,美国Santa Cruz Biotechnology. Inc),Western blotting用兔抗鼠多抗(货号:ab150073,美国Abcam公司),其他试剂均为国产分析纯。Image-Pro Plus6.0图像分析软件(美国Media Cybernetics公司),真彩病理图像分析系统(型号HMIAS-2000,高腾科技有限公司),MV-Ⅱ型双垂直板式电泳槽(大连竞迈生物科技有限公司),凝胶成像分析系统(Universal Hood Ⅲ,美国伯乐公司),全自动生化分析仪(Cobas-8000,德国罗氏制药有限公司),BX-53型光学显微镜(日本Olympus公司),日立H-7650透射电子显微镜(日本日立公司)。
1.2 动物分组及给药db/db小鼠适应性饲养1周后,剪尾法取血,用血糖仪测定随机血糖,筛选出随机血糖(RBG)≥16.7 mmol·L-1的实验用鼠30只,再按体质量、血糖分层,随机分为3组,每组10只。模型组:灌胃蒸馏水;低和高剂量EFBFL组:分别灌胃低、高剂量EFBFL(50和100 mg·kg-1EFBFL);另设db/m小鼠为正常对照组:灌胃蒸馏水。各组小鼠均每天灌胃1次,连续给药8周。
1.3 实验指标检测分别于给药前和给药8周末尾静脉取血用血糖仪测定小鼠血空腹血糖(FBG);各组小鼠禁食12 h,摘眼球取血,分离血清,用全自动生化分析仪测定血清中血肌酐(SCr)和尿素氮(BUN)的水平。小鼠处死后立即对其进行解剖,迅速摘取两侧肾脏,去除表面被膜,经生理盐水清洗,滤纸吸干后称质量,一部分置于2%戊二醛溶液保存,一部分置于4%多聚甲醛溶液固定;计算肾脏指数,肾脏指数=双肾平均肾质量(mg)/体质量(g)。
1.4 光镜和电镜下观察小鼠肾组织形态表现4%多聚甲醛溶液固定小鼠肾脏组织,冲水,梯度酒精脱水、二甲苯溶液透明,浸蜡、包埋、切片,HE染色及Masson染色,光镜下观察肾组织形态表现和肾组织纤维化程度。4%戊二醛溶液固定肾脏组织,采用透射电镜观察肾组织超微结构。
1.5 免疫组织化学法检测小鼠肾组织PPARγ和NF-κB蛋白表达水平石蜡包埋的肾组织连续切片(5 μm),经脱蜡至水、抗原修复后,加1:100稀释的一抗4℃过夜,PBS洗3次,加二抗37℃、60min,PBS洗3次,DAB显色,自来水终止显色,常规梯度酒精脱水,二甲苯透明,中性树胶封片。以PBS替代一抗作为阴性对照,在光镜下观察PPARγ和NF-κB蛋白表达及分布(细胞胞膜和胞质内棕黄色颗粒即为阳性信号)。将每张切片在400倍光学显微镜下观察,用Image-Pro Plus6.0图像处理系统检测PPARγ和NF-κB的平均积分吸光度(IA)值。
1.6 Western blotting法检测小鼠肾组织PPARγ和NF-κB蛋白表达水平取肾组织在裂解液中制成匀浆,离心后取上清液,采用BCA法测定总蛋白浓度。上样前加入5×buffer,100μg蛋白样品经电泳分离后电转至PVDF膜,5%的脱脂奶粉封闭1h后,孵育一抗PPARγ(1:500)、NF-κB(1:1 000)4℃缓慢振荡过夜。次日TBST漂洗滤膜5 min×3次,孵育二抗Goat anti-Rabbit IgG/HRP(1:5 000)稀释,37℃室温振荡孵育1h,TBST漂洗5 min×3次,加入超敏ECL化学发光试剂,暗室曝光。采用Image J软件进行灰度值分析,以β-actin为内参,结果用目的蛋白与β-actin灰度值的比值表示其相对表达水平。
1.7 统计学分析采用SPSS16.00统计软件进行统计学分析。各组小鼠FBG、SCr、BUN、肾脏指数及小鼠肾组织中PPARγ和NF-κB蛋白表达水平均以x±s表示。多组间样本均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 给药前后各组小鼠FBG水平给药前后正常对照组小鼠FBG水平无明显变化(P>0.05);与正常组比较,给药前模型组及EFBFL组小鼠FBG水平明显升高(P < 0.05);给药8周后,与模型组比较,EFBFL组小鼠FBG水平均明显降低(P < 0.05或P < 0.01),尤以高剂量EFBFL组效果最为明显。见表 1。
| [n=10,x±s,cB /(mmol·L-1)] | ||
| Group | FBG level | |
| Before administration | After administration | |
| Normal control | 4.87±0.60 | 4.46±0.64 |
| Model | 10.33±1.05* | 11.83±1.62* |
| EFBFL | ||
| Low dose | 10.85±0.94* | 9.87±1.24*△ |
| High dose | 10.58±1.57* | 8.36±1.10*△△ |
| * P < 0.05 vs normal control group; △ P < 0.05, △△ P < 0.01 vs model group. | ||
与正常对照组比较,模型组小鼠血清中的SCr和BUN水平明显升高(P < 0.05),肾脏指数明显降低(P < 0.01);与模型组比较,高剂量EFBFL组小鼠血清中的SCr和BUN水平明显降低(P < 0.05),低剂量EFBFL组小鼠血清中的SCr和BUN水平降低不明显(P>0.05);与模型组比较,高剂量EFBFL组小鼠肾脏指数明显升高(P < 0.01),低剂量EFBFL组小鼠肾脏指数升高不明显(P>0.05)。见表 2。
| (n=10, x±s) | |||
| Group | SCr[cB /(μmol·L-1)] | BUN[cB /(mmol·L-1) ] | Kidney index |
| Normal control | 20.71±4.52 | 6.68±1.81 | 1.09±0.09 |
| Model | 25.92±5.01* | 8.70±1.27* | 0.67±0.05** |
| EFBFL | |||
| Low dose | 24.03±4.23 | 7.61±1.68 | 0.75±0.08** |
| High dose | 21.25±3.54△ | 7.00±1.29△ | 0.87±0.07**△△ |
| * P < 0.05, ** P < 0.01 vs normal control group; △ P < 0.05, △△ P < 0.01 vs model group. | |||
给药8周后,正常对照组小鼠肾组织中肾小球和肾小管结构正常,未见炎症细胞浸润;与正常对照组比较,模型组小鼠肾组织中肾小球固缩明显,囊腔增大,部分肾小球系膜增生、基底膜增厚,肾间质散在炎细胞浸润及出血点,肾小管细胞水肿明显;与模型组比较,EFBFL组小鼠上述病理改变均有不同程度减轻,高剂量EFBFL组小鼠肾损伤程度明显减轻。见图 1(插页四)。

|
| A:Normal control group; B:Model group; C:Low dose of EFBFL group; D:High dose of EFBFL group. 图 1 各组小鼠肾组织形态表现(HE, ×400) Figure 1 Morphology of kidney tissue of mice in various groups (HE, ×400) |
|
|
给药8周后,正常对照组小鼠肾组织中肾小球清晰,大小正常,可见少量蓝染物质,纤维化程度极低;与正常对照组比较,模型组小鼠肾组织中肾小球系膜基质和肾间质见大量蓝染物质沉积,组织纤维化明显;与模型组比较,EFBFL组小鼠肾组织蓝染物质明显减少,纤维化程度均有不同程度降低。见图 2(插页四)。

|
| A:Normal control group; B:Model group; C:Low dose of EFBFL group; D:High dose of EFBFL group. 图 2 各组小鼠肾组织Masson染色结果(×400) Figure 2 Results of Masson staining of kidney tissue of mice in various groups(×400) |
|
|
电镜下观察,正常对照组小鼠肾组织中肾小球结构清晰,肾小球基底膜厚度均匀,足细胞结构完整,足突分布均匀、排列整齐清晰,无融合现象;与正常对照组比较,模型组小鼠肾组织中肾小球基底膜弥漫性增厚,足细胞数量减少,足突增宽、融合甚至消失。与模型组比较,EFBFL组小鼠肾组织上述现象有不同程度改善。见图 3。
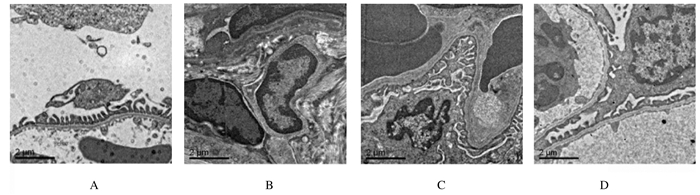
|
| A: Normal control group; B: Model group; C:Low dose of EFBFL group; D:High dose of EFBFL group. 图 3 各组小鼠肾组织电镜观察结果(Bar=2 μm) Figure 3 Results of electronic microscope of kidney tissue of mice in various groups(Bar=2 μm) |
|
|
正常对照组小鼠肾组织中PPARγ主要位于肾小球,阳性表达蛋白染色呈棕色;模型组小鼠肾组织中PPARγ呈低表达,阳性染色颗粒数量减少,分布不均匀,颜色呈浅黄色;EFBFL组小鼠肾组织中PPARγ表达明显增强,阳性染色颗粒数量较模型组明显增多,颜色明显加深,其中高剂量EFBFL组增强最为明显(图 4,见插页四)。模型组小鼠肾组织中NF-κB表达于肾小管,高剂量EFBFL组与正常对照组NF-κB表达相当,仅有少量表达(图 5,见插页四)。与正常对照组比较,模型组小鼠肾组织中PPARγ蛋白表达水平明显降低(P < 0.05);与模型组比较,EFBFL组小鼠肾组织中PPARγ蛋白表达水平明显升高(P < 0.05),其中高剂量EFBFL组PPARγ蛋白表达水平最高,且与正常对照组比较差异无统计学意义(P>0.05)。与正常对照组比较,模型组小鼠肾组织中NF-κB蛋白表达水平明显升高(P < 0.05);与模型组比较,EFBFL组小鼠肾组织中NF-κB蛋白表达水平明显降低(P < 0.05),且高剂量EFBFL组与正常对照组比较差异无统计学意义(P>0.05)。见表 3。

|
| A:Normal control group; B:Model group; C:Low dose of EFBFL group; D:High dose of EFBFL group. 图 4 各组小鼠肾组织中PPARγ蛋白表达(免疫组织化学,×400) Figure 4 Expressions of PPARγ protein in kidney tissue of mice in various groups (Immunohistochemistry, ×400) |
|
|
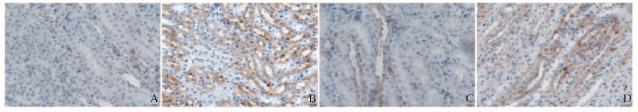
|
| A:Normal control group; B:Model group; C:Low dose of EFBFL group; D:High dose of EFBFL group. 图 5 各组小鼠肾组织中NF-κB蛋白表达(免疫组织化学,×400) Figure 5 Expressions of NF-κB protein in kidney tissue of mice in various groups (Immunohistochemistry, ×400) |
|
|
| (n=10, x±s) | ||
| Group | PPARγ | NF-κB |
| Normal control | 0.115±0.011 | 0.035±0.009 |
| Model | 0.041±0.005* | 0.125±0.032* |
| EFBFL | ||
| Low dose | 0.092±0.012*△ | 0.066±0.012*△ |
| High dose | 0.114±0.014△ | 0.049±0.014△ |
| * P < 0.05 vs normal control group; △ P < 0.05 vs model group. | ||
与正常对照组比较,模型组小鼠肾组织中PPARγ蛋白表达水平明显降低(P < 0.05),NF-κB蛋白表达水平明显升高(P < 0.01);与模型组比较,EFBFL组小鼠肾组织中PPARγ蛋白表达水平明显升高(P < 0.05或P < 0.01),NF-κB蛋白表达水平明显降低(P < 0.05或P < 0.01),高剂量EFBFL组效果最为明显,且高剂量EFBFL组小鼠肾组织中PPARγ和NF-κB蛋白表达水平与正常对照组比较差异无统计学意义(P>0.05)。与免疫组织化学染色结果一致。见图 6。

|
|
n=3, x±s;
* P < 0.05, ** P < 0.01 vs normal control group; △ P < 0.05, △△ P < 0.01 vs model group. Lane 1:Normal control group; Lane2:Model group; Lane3:High dose of EFBFL group; Lane4:Low dose of EFBFL group. 图 6 各组小鼠肾脏PPARγ和NF-κB蛋白表达电泳图(A)和直条图(B) Figure 6 Electrphoregram (A) and histogram(B) of expressions of PPARγ and NF-κB proteins in kidney tissue of mice in various groups |
|
|
糖尿病肾损伤是一个由高血糖启动的、多因素共同参与的渐进性肾脏损伤过程。高血糖作为一个独立的危险因素,是糖尿病微血管病变发生和发展的始动因素[10]。已有研究[11]表明:db/db小鼠处于高血糖状态,易发生肾脏病变,表现为尿蛋白增高、系膜细胞增生、基质增加和基底膜增厚等肾脏结构破坏,随着高血糖进展,肾脏病变进一步恶化。db/db小鼠与2型糖尿病患者有类似的肾脏病变,本研究采用db/db小鼠作为研究对象可以较好模拟2型糖尿病肾损伤的特征[12]。本研究结果显示:db/db小鼠给予EFBFL治疗后,与模型组比较,其血糖、肾脏组织学病变和肾功能均有不同程度改善,表明EFBFL可在一定程度上减轻小鼠肾损伤,且有一定的降血糖功能,提示EFBFL对高血糖引起的肾脏疾病具有一定的治疗作用。
随着对糖尿病肾损伤的深入研究,其被认为是与先天免疫有关的慢性炎症疾病。糖尿病患者的长期高血糖环境,可促使机体促炎因子及炎症介质大量产生,攻击肾脏组织并加重糖尿病肾损伤发生[13]。糖尿病肾损伤患者微炎症状态与肾功能损伤程度直接相关。过氧化物酶体增殖物激活受体(peroxisome pro-liferator-activated receptors, PPARs)是一类配体激活的核转录因子,其亚型之一PPARγ在降低血糖、调节脂类代谢和抗炎过程中发挥重要作用[14-15]。NF-κB是调控机体免疫和炎症反应的重要转录因子,阻断NF-κB通路具有多重的抗炎作用。进一步的研究[16]表明:PPARγ-NF-κB途径是调控炎症反应的一个重要的靶点,PPARγ通过降低NF-κB的活性或抑制其活化,可以下调炎症基因的表达,从而调节炎症通路,最终缓解炎症反应。本研究结果显示:与模型组比较,EFBFL可明显升高db/db小鼠肾脏组织中PPARγ的蛋白表达水平,下调NF-кB蛋白表达水平,表明EFBFL通过激活PPARγ减少NF-кB的转录活性,减少淋巴细胞产生促炎分子,促进免疫系统产生抗炎症分子,改善炎症反应,减轻肾功能的损伤,延缓肾损伤的进展。与此同时,EFBFL在一定程度上可激活PPARγ信号通路,从而降低血糖,增加肾脏组织胰岛素敏感性,改善肾脏糖代谢异常,抑制肾脏损伤。
综上所述,EFBFL可降低db/db小鼠血糖,改善肾组织的损害程度,减缓糖尿病的症状。其机制可能是通过调控炎症反应PPARγ-NF-κB这一重要靶点,改善炎症反应及肾脏功能;与此同时,EFBFL能增加小鼠肾脏组织内PPARγ蛋白表达,降低血糖,增加肾脏组织对胰岛素的敏感性,对肾脏起到一定的保护作用。本研究为荞麦花叶的深入研究提供了新的思路,为荞麦花叶的开发再利用提供了新的研究方向。
| [1] | Pourghasem M, Shafi H, Babazadeh Z. Histological changes of kidney in diabetic nephropathy[J]. Caspian J Intern Med, 2015, 6(3): 120–127. |
| [2] | Ros Ruiz S. Diabetic nephropathy:changes after diabetes surgery?[J]. Nutr Hosp, 2013, 28(Suppl 2): 57–65. |
| [3] | 韩淑英, 姜妍, 王志路, 等. 荞麦花叶黄酮对2型糖尿病大鼠肝损伤及IRS-2、PI3K、NF-κB表达的影响[J]. 中国药理学通报, 2013, 29(11): 1582–1586. DOI:10.3969/j.issn.1001-1978.2013.11.025 |
| [4] | 张博男, 储金秀, 韩淑英. 荞麦花叶总黄酮的舒张血管作用及其机制[J]. 中国药理学通报, 2010, 26(7): 952–956. |
| [5] | 涂画, 陈雪品, 成曦爽, 等. 荞麦花叶黄酮对糖尿病GK大鼠肾脏的影响[J]. 中国高新技术企业, 2016(17): 58–59. |
| [6] | 刘小娜, 王兰英, 彭建霞, 等. 荞麦黄酮对大鼠糖尿病肾病的保护作用[J]. 中国实验方剂学杂志, 2015, 21(2): 142–145. |
| [7] | 张英, 曹良顺, 张赛航, 等. 荞麦花叶发酵提取物黄酮含量的测定[J]. 中国高新技术企业, 2015(20): 17–18. |
| [8] | 王建行, 王妍, 刘曼, 等. 荞麦花叶发酵提取物对2型糖尿病db/db小鼠心肌损伤的影响[J]. 中国药理学通报, 2017, 33(7): 1026–1031. |
| [9] | 黄菡雪, 蒋志鹏, 石亚静, 等. 荞麦发酵物对2型糖尿病db/db小鼠肾VEGF、MMP-9表达的影响[J]. 现代预防医学, 2017, 44(6): 1102–1105, 1144. |
| [10] | 房芸, 王海颖. 复方鱼腥草合剂对db/db小鼠糖尿病肾损伤的保护作用[J]. 中华中医药学刊, 2017, 35(4): 787–790. |
| [11] | Einbinder Y, Ohana M, Benchetrit S, et al. Glucagon-like peptide-1 and vitamin D:anti-inflammatory response in diabetic kidney disease in db/db mice and in cultured endothelial cells[J]. Diabetes Metab Res Rev, 2016, 32(8): 805–815. DOI:10.1002/dmrr.v32.8 |
| [12] | Pei F, Li BY, Zhang Z, et al. Beneficial effects of phlorizin on diabetic nephropathy in diabetic db/db mice[J]. J Diabetes Complications, 2014, 28(5): 596–603. DOI:10.1016/j.jdiacomp.2014.04.010 |
| [13] | Sakai N, Wada T. Revisiting inflammation in diabetic nephropathy:the role of the Nlrp3 inflammasome in glomerular resident cells[J]. Kidney Int, 2015, 87(1): 12–14. DOI:10.1038/ki.2014.322 |
| [14] | Wang FF, Mullican SE, DiSpirito JR, et al. Lipoatrophy and severe metabolic disturbance in mice with fat-specific deletion of PPARγ[J]. Proc Natl Acad Sci USA, 2013, 110(46): 18656–18661. DOI:10.1073/pnas.1314863110 |
| [15] | 张宁, 孟爱民, 王莉莉. 选择性PPARγ调节剂治疗二型糖尿病的分子机制研究进展[J]. 中国药理学通报, 2013, 29(2): 157–160. |
| [16] | Delerive P, Gervois P, Fruchart JC, et al. Induction ofIκBα expression as a mechanism contributing to the anti-inflammatory activities of peroxisome proliferator-activatedreceptor-alpha activators[J]. J Biol Chem, 2000, 275(47): 36703–36707. DOI:10.1074/jbc.M004045200 |
 2018, Vol. 44
2018, Vol. 44


