扩展功能
文章信息
- 上官梦原, 赵菁, 陈俊宇, 杨艳荣, 张佳悦, 赵淑华
- SHANGGUAN Mengyuan, ZHAO Jing, CHEN Junyu, YANG Yanrong, ZHANG Jiayue, ZHAO Shuhua
- 五味子脂A增强卡铂对人卵巢癌Skov3细胞的促凋亡作用及其机制
- Enhancement of gomisin A in pro-apoptotic effect of carboplatin on human ovarian cancer Skov3 cells and its mechanism
- 吉林大学学报(医学版), 2018, 44(01): 83-89
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 83-89
- 10.13481/j.1671-587x.20180116
-
文章历史
- 收稿日期: 2017-08-31
2. 延边大学附属医院妇产科, 吉林 延吉 133000;
3. 吉林大学基础医学院病理生理学系, 吉林 长春 130021
2. Department of Gynaecology and Obstetrics, Affiliated Hospital, Yanbian University, Yanji 133000, China;
3. Department of Pathophysiology, School of Basic Medical Sciences, Jilin University, Changchun 130021, China
铂类是治疗卵巢癌的主要化疗药物,但其选择性差、不良反应作用强,长期应用易产生耐药。高复发率和复发后的高耐药率已严重影响卵巢癌的化疗效果和长期生存率。近年来,中药治疗以其毒性低、效率高的优势成为卵巢癌辅助治疗手段之一。大量研究[1-6]表明:中药五味子有效成分可能通过抑制肿瘤细胞增殖、促进凋亡、抗氧化、逆转耐药、提高免疫力和减轻化疗不良反应等方面发挥抗肿瘤作用。随着五味子抗肿瘤作用研究的日益深入,五味子已成为抗肿瘤中药的研究热点。五味子具有多种活性成分[7],以往研究多集中在五味子多糖及木脂素类,如五味子乙素(schisandrin B)、五味子醇甲(schizandrin)、五味子醇乙(aomisin)和五味子酯A(schisantherin A)等。本研究选取五味子化学成分五味子脂A(gomisin A, GA)作为研究对象,观察其与卡铂(carboplatin, CBP)联合应用对卵巢癌Skov3细胞凋亡的影响,并初步探讨其作用机制,为更加合理、有效的临床卵巢癌化疗方案提供实验依据。
1 材料与方法 1.1 细胞株和主要试剂人卵巢浆液性乳头状囊腺癌细胞株Skov3由吉林大学前列腺疾病防治中心保存。GA(纯度98%)购于上海源叶生物制品有限公司,注射用CBP注射液为齐鲁制药有限公司生产,IMDM培养基和胎牛血清购自美国Gibico公司,JC-1购于碧云天生物技术研究所,Annexin Ⅴ-FITC/PI凋亡试剂盒购于天津三箭生物技术有限公司,RT-PCR试剂盒购于大连宝信生物工程有限公司。
1.2 细胞培养和分组人卵巢癌Skov3细胞用含10% FBS的IMDM培养液,置于37℃、5%CO2培养箱中培养,每隔3d传代1次,传代比率1:3,取对数生长期状态良好的细胞进行研究。研究分两步:首先选择不同浓度GA和CBP(GA浓度分别为0、0.01、0.02、0.04、0.08和0.16 μmol·L-1,CBP浓度分别为0、4、8、16、32和64 mg·L-1)单独应用和分别组合后观察其对Skov3细胞增殖能力的影响;然后根据其结果选择联合用药的合适浓度,将细胞分为对照组、GA(0.04 μmol·L-1)组、CBP(16mg·L-1)组、GA(0.04 μmol· L-1)联合CBP(16 mg·L-1)组(联合用药组)进行后续实验。
1.3 MTT法检测细胞增殖能力取对数生长期细胞,消化细胞后制备单细胞悬液,细胞计数,调整细胞密度为3 000个/孔,接种于96孔板,每孔100 μL,于37℃、5%CO2培养箱中孵育24 h。分组同上,每组设6个复孔。加药后,5%CO2、37℃条件下继续孵育。细胞给药48 h后,每孔加入MTT(5g·L-1)10 μL,37℃孵育4h,小心吸去培养液,每孔加入DMSO溶液150 μL。振荡10 min,用酶标仪于490 nm波长处检测各孔吸光度(A)值。实验重复3次。细胞增殖抑制率=(1/给药组A值-1/空白对照组A值)×100%。
1.4 倒置显微镜观察细胞形态表现将培养至80%融合的Skov3细胞分为对照组、GA组(0.04 μmol·L-1)、CBP组(16mg·L-1)和GA+CBP组(联合用药组),药物处理48 h后,于倒置显微镜下观察并拍照。
1.5 Annexin Ⅴ-FICT/PI双染法检测细胞凋亡率取对数生长期的Skov3单细胞悬液接种6孔板,37℃孵育24h后,分组同上,每组3个复孔,另设仅含10%血清IMDM培养液和Skov3细胞的对照组,给药后37℃、5% CO2培养箱中继续孵育48h。胰酶消化细胞,制备单细胞悬液,冷PBS洗2次,离心后弃上清,1×binding buffer1mL重悬细胞,使细胞浓度为1×106 mL-1。取100 μL细胞悬液,加入5 μL Annexin Ⅴ-FICT,室温避光孵育15 min,加入PI 5 μL,室温避光5 min,加PBS至500 μL,1h内流式细胞仪检测细胞凋亡率。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.6 TUNEL染色法检测细胞凋亡指数(apoptotic index, AI)用各组药物作用48h的细胞爬片进行TUNEL染色。参考试剂盒说明书进行染色后用抗荧光淬灭封片液封片后荧光显微镜下观察。阳性细胞核呈绿色。显微镜(×400)下随机选取10个视野,计数细胞总数和染色阳性细胞数,二者之比值乘以100%即为细胞AI(%)。
1.7 JC-1染色检测Skov3细胞线粒体膜电位取对数生长期的Skov3单细胞悬液接种于24孔板,调整细胞浓度为1×105个/孔,每孔500 μL液体。于37℃、含5% CO2的孵箱中孵育24h后给药,分组同上。给药后37℃、5% CO2培养箱中继续孵育48 h。吸去24孔板内培养基,用PBS洗2次,每孔加入500 μL JC-1稀释液,细胞培养箱中37℃孵育30 min。孵育结束后,吸去JC-1,PBS洗2次。荧光显微镜下观察。
1.8 RT-PCR法检测Skov3细胞中Bax、caspase-3、Bcl-2和Stat3 mRNA表达水平对数生长期的Skov3单细胞悬液接种于6孔板,37℃孵育24 h贴壁后给药,孵育48 h后,使用Trizol试剂盒提取各组细胞总RNA,紫外分光光度计测定RNA浓度。根据RT-PCR试剂盒方法进行实验。PCR引物设计:Bax,上游引物5′-AGGGTTTCAGGATCGAGC-3′,下游引物5′-AGGCGGTGAGGACTCCAGCC-3′; caspase-3,上游引物5′-CTGGACTGCGGTATTGAGAC-3′,下游下物5′-CCGGGTGCGGTAGAGTAAGC-3′; Bcl-2,上游引物5′-GGATGACTGAGTACCTGAA-3′,下游引物5′-TTCAGGTACTCAGTCATCC-3′;Stat3,上游引物5′-ATTCAAACACTTGACCCTGA-3′,下游引物5′-ATTGTTGGTCAGCATGTTGT-3′;GAPDH,上游引物5′-GGAAAGGCTGGGGCTCATTTG-3′,下游引物5′-AGAAGGGGCCATCCACAGTCTTC-3′。以cDNA为模板进行实时定量PCR检测,扩增条件如下:94℃、3 min(预变性);94℃、30s,55℃、30s,72℃、45s,40个循环;72℃、5 min。以GAPDH为内参照,通过2-ΔΔCt法计算各基因mRNA相对表达水平。
1.9 Western blotting法检测Skov3细胞中Bax、caspase-3和Stat3蛋白表达水平在直径100 mm培养皿中接种细胞,37℃、含5% CO2的孵箱中孵育24h后给药,给药后继续孵育48h。离心收集细胞,加入细胞裂解液,充分裂解细胞,离心收集上清,采用BCA法测定蛋白含量。SDS-PAGE电泳分离蛋白样本中不同相对分子质量蛋白,将蛋白转印到PVDF膜上。转膜完成后,用5%脱脂奶粉封闭1 h,TBST洗3次,稀释一抗,稀释比例分别为Bax(1:1 000)、caspase-3(1:1 000)、Stat3(1:1 000)和β-actin(1:500),将膜封入一抗,4℃静置过夜。TBST洗3次后,加入过氧化物酶标记二抗,37℃孵育1 h,TBST洗3遍。以β-actin作为内参照。DAB显色,凝胶成像系统拍照。以各实验组灰度值与对照组之比表示蛋白相对表达水平。
1.10 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组细胞增殖抑制率、凋亡率、AI及凋亡相关基因mRNA和蛋白表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q法。以P < 0.05表示差异有统计学意义。
2 结果 2.1 MTT法检测各组细胞增殖抑制率随着浓度增加,GA和CBP对Skov3细胞增殖抑制率明显升高。单独应用GA(0.01、0.02、0.04、0.08和0.16 μmol·L-1)干预后,Skov3细胞增殖抑制率为9.4%~21.3%;单独应用CBP(4、8、16、32和64mg·L-1)干预后,细胞增殖抑制率为14.6%~27.2%;而CA与CBP联合作用后细胞增殖抑制率明显升高,高于同浓度GA组和CBP组(P < 0.01),且GA和CBP浓度分别为0.04 μmol·L-1和16mg·L-1时量效比最佳,细胞增殖抑制率为52.1%。见图 1。
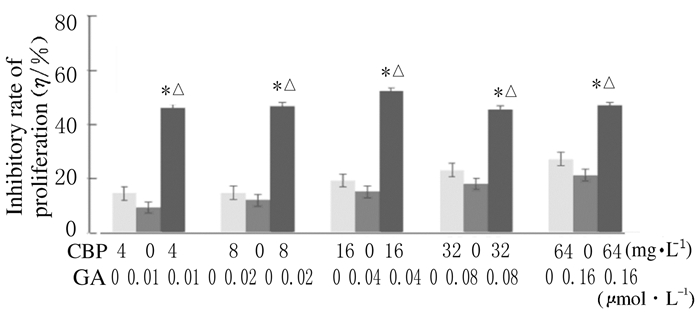
|
| n=6;*P < 0.01 compared with GA group; △P < 0.01 compared with CBP group. 图 1 各组Skov3细胞增殖抑制率 Figure 1 Inhibitory rates of proliferation of Skov3 cells in various groups |
|
|
对照组Skov3细胞形状呈梭形或多角形,胞核圆形或椭圆形,胞质透亮,贴壁生长旺盛,折光性好;GA组Skov3细胞光镜下见体积略缩小,回缩变圆的细胞略有增加,细胞核相对变小;CBP组Skov3细胞折光性减弱,回缩明显,部分脱落呈悬浮状;联合用药组细胞回缩现象更为明显,细胞数量减少,体积缩小,细胞形态不一,并见大量脱落细胞。见图 2。

|
| A:Control group; B:GA group; C:CBP group; D:GA+CBP group. 图 2 倒置显微镜下各组Skov3细胞形态表现 Figure 2 Morphology of Skov3 cells in various groups under interted microscope |
|
|
对照组细胞凋亡率为(4.33±1.69)%,GA组、CBP组及联合用药组细胞凋亡率分别为(8.69±3.55)%、(13.12±0.79)%和(18.54±2.11)%。与对照组比较,GA组、CBP组和联合用药组细胞凋亡率明显升高(P < 0.05或P < 0.01);与GA组和CBP组比较,联合用药组细胞凋亡率进一步升高(P < 0.05)。见图 3。
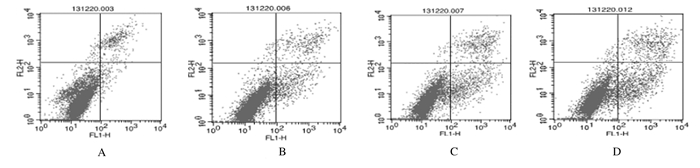
|
| A:Control group; B:GA group; C:CBP group; D:GA+CBP group. 图 3 流式细胞术检测各组Skov3细胞凋亡率 Figure 3 Apoptotic rates of Skov3 cells in various groups detected by flow cytometry |
|
|
药物作用Skov3细胞48 h后,TUNEL法染色检测各组Skov3细胞凋亡,细胞核中有绿色荧光颗粒者为阳性细胞,细胞呈典型的凋亡形态学改变(变小、变圆、核固缩);正常细胞的胞核不着色。与对照组比较,GA组和CBP组Skov3细胞核中有绿色荧光颗粒者数量均有增加,联合用药组阳性细胞增加更明显。对照组细胞AI为(3.53±1.29)%,GA组、CBP组和联合用药组细胞AI分别为(12.21±2.47)%、(17.36±0.86)%和(26.87±2.62)%。与对照组比较,GA组、CBP组和联合用药组细胞AI明显升高(P < 0.05或P < 0.01);与GA组和CBP组比较,联合用药组细胞AI明显升高(P < 0.05) (图 4,见插页三)。
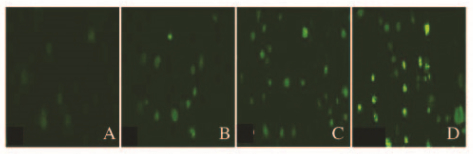
|
| A:Control group; B:GA group; C:CBP group; D:GA+CBP group. 图 4 TUNEL染色法检测各组Skov3细胞凋亡(×400) Figure 4 Apoptosis of Skov3 cells in various groups detected by TUNEL staining(×400) |
|
|
线粒体膜电位的下降是细胞早期凋亡的标志性事件。通过JC-1从红色荧光到绿色荧光的转变过程观察细胞膜电位的降低,同时也可用JC-1从红色荧光到绿色荧光的变化作为细胞凋亡的早期指标。对照组细胞在荧光显微镜下大部分呈红色荧光,GA组和CBP组部分细胞在荧光显微镜下呈绿色荧光,而联合用药组大部分细胞在荧光显微镜下呈现绿色荧光,提示联合用药组Skov3细胞线粒体膜电位降低,细胞发生早期凋亡(图 5, 见插页三)。
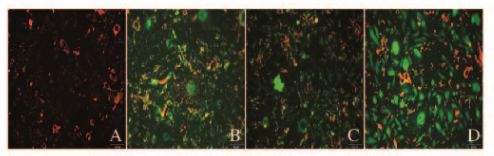
|
| A:Control group; B:GA group; C:CBP group; D:GA+CBP group. 图 5 各组Skov3细胞JC-1染色结果(×400) Figure 5 Results of JC-1 straining of Skov3 cells in various groups(×400) |
|
|
与对照组比较,GA组、CBP组和联合用药组细胞中Bax和caspase-3 mRNA表达水平上调(P < 0.05),Stat3和Bcl-2 mRNA表达水平下调(P < 0.05);与GA组和CBP组比较,联合用药组细胞中Bax和caspase-3 mRNA表达水平上调(P < 0.05),Stat3和Bcl-2 mRNA表达水平下调(P < 0.05)。见表 1。
| (n=3, x±s) | ||||
| Group | Caspase-3mRNA | BaxmRNA | Bcl-2mRNA | Stat3mRNA |
| Control | 1.00±0.20 | 1.11±0.24 | 0.99±0.21 | 1.12±0.30 |
| GA | 2.80±0.30* | 2.50±0.18* | 0.90±0.19 | 0.75±0.21* |
| CBP | 3.98±0.15* | 2.20±0.11* | 0.50±0.12* | 0.45±0.11* |
| GA+CBP | 6.89±0.20*△# | 5.00±0.25*△# | 0.25±0.15*△# | 0.26±0.11*△# |
| * P < 0.05 compared with control group; △ P < 0.05 compared with GA group; # P < 0.05 compared with CBP group. | ||||
与对照组比较,GA组、CBP组和联合用药组细胞中Bax和Cleave-caspase-3蛋白表达水平上调(P < 0.05),Stat3蛋白表达水平下调(P < 0.05);与GA组和CBP组比较,联合用药组细胞中Bax和Cleave-caspase-3蛋白表达水平上调(P < 0.05),Stat3蛋白表达水平下调(P < 0.05)。见图 6和表 2。

|
| Lane 1:Control group; Lane 2:GA group; Lane 3:CBP group; Lane 4:GA+CBP group. 图 6 Western blotting法检测各组Skov3细胞中凋亡相关基因蛋白表达电泳图 Figure 6 Electrophoregram of expressions of apoptosis-related gene proteins in Skov3 cells in various groups |
|
|
| (n=3, x±s) | |||
| Group | Cleave-caspase-3 protein | Bax protein | Stat3 protein |
| Control | 0.19±0.03 | 0.44±0.01 | 0.64±0.03 0.46±0.03* |
| GA | 0.38±0.02* | 0.52±0.03* | 0.14±0.02* |
| CBP | 0.33±0.03* | 0.47±0.03* | 0.08±0.03*△# |
| GA+CBP | 0.56±0.02*△# | 0.39±0.02*△# | |
| * P < 0.05 compared with control group; △ P < 0.05 compared with GA group; # P < 0.05 compared with CBP group. | |||
卵巢癌的发病率日益增高,严重威胁女性的生命健康。紫杉醇和卡铂联合化疗是目前卵巢癌辅助治疗的重要手段,但是存在严重的不良反应。近年来,天然、高效、低毒和来源广泛的中草药受到国内外学者的青睐。五味子的抗肿瘤活性已被许多研究所证实。研究[8]表明:五味子乙素通过激活p38MAPK/p53信号通路而抑制结肠癌SW480细胞增殖和侵袭,促进细胞凋亡;禹洁等[9]发现:五味子木脂素对人乳腺癌细胞MCF-7、食管癌9706细胞和肝癌HepG2细胞的抑制效果明显。Kim等[10]发现:五味子脂可抑制乳腺癌细胞增殖,其机制可能是抑制细胞周期蛋白Cyclin D1、Cyclin E和细胞周期蛋白依赖性激酶CDK2、CDK4的表达。有研究[11]显示:随着五味子多糖浓度升高可明显抑制卵巢癌Skov3细胞增殖。本课题组前期研究[12]显示:单独使用GA和CBP均可抑制人卵巢癌Skov3细胞增殖,联合用药后抑制作用更为明显,进一步证实GA可增强卡铂对人卵巢癌Skov3细胞增殖的抑制作用。
凋亡是细胞为了维持机体内环境稳定而发生的自主的程序性死亡。多数化疗药物是通过诱导肿瘤细胞凋亡达到杀伤细胞、治疗肿瘤的目的。Yim等[13]研究五味子木脂素不同成分对肝癌细胞的影响发现:五味子木脂素可通过增强促凋亡蛋白Bax表达促进肿瘤细胞凋亡。Inoue等[14]发现:五味子脂N预处理可上调caspase-3和caspase-9水平,促进RARP-1裂解, 上调死亡受体4 (DR4)和死亡受体5(DR5)转录,最终通过蛋白酶级联反应促进凋亡。本研究Annexin Ⅴ-FICT/PI双染法及线粒体膜电位等结果显示:GA与CBP联合应用可加速CBP诱导的卵巢癌细胞凋亡;应用TUNEL法检测细胞凋亡也发现:联合用药组凋亡细胞明显增多,进一步证实GA与CBP联合应用可促进CBP诱导的卵巢癌细胞凋亡,肯定了GA在抗肿瘤方面的价值。
细胞凋亡是多基因调控的复杂过程,抗凋亡蛋白Bcl-2与促凋亡蛋白Bax的比例决定了细胞是否发生凋亡[15]。细胞色素C是第一个被发现的线粒体凋亡蛋白,是细胞凋亡的阀门,Bcl-2蛋白通过抑制线粒体中细胞色素C的释放从而抑制细胞凋亡,细胞色素C释放可直接激活caspase-9,继而活化caspase-3,caspase-3是caspase家族中的凋亡执行者,其激活预示着凋亡进入不可逆阶段[16]。本实验分别采用RT-PCR及Western blotting法检测药物处理后Skov3细胞凋亡相关基因mRNA和蛋白表达水平,结果表明:联合用药组Skov3细胞中Bax基因表达水平增高,Bcl-2基因表达水平明显降低,由此推断,GA可能是通过上调促凋亡因子Bax、下调抗凋亡因子Bcl-2的表达,激活caspase-3,从而协同卡铂诱导肿瘤细胞凋亡。
JAK-Stat信号通路对多种细胞的生长、分化和凋亡具有重要的调节功能,通过使蛋白质酪氨酸磷酸化和激活,引起级联激酶的活化,并将活化的信号传导给其他分子如Stat,继而引发一系列基因和蛋白的变化[17]。Stat3信号转导通路直接影响分化、增殖和凋亡过程,可导致细胞的异常增殖和恶性转化[18]。研究[19-21]显示:磷酸化Stat3 (p-Stat3)在卵巢癌细胞株中高表达,卵巢癌组织中Stat3途径的激活与肿瘤的侵袭力有关。本研究结果显示:CBP与GA联合用药后Stat3表达的下调更加明显,提示GA协同CBP诱导Skov3凋亡的作用可能是通过抑制JAK-Stat信号通路完成的。
本研究表明:GA和CBP联合用药对卵巢癌Skov3细胞的凋亡的作用优于单独应用CBP,即低浓度的CBP与微量的GA联合用药即可达到高浓度CBP所产生的抑瘤效果,从而可降低CBP的用量,减少化疗药物对人体的不良作用,为临床开发新的抗肿瘤药物提供了理论依据。
| [1] | Waiwut P, Shin MS, Yokoyama S, et al. Gomisin A enhances tumor necrosis factor-α-induced G1 cell cycle arrest via signal transducer and activator of transcription 1-mediated phosphorylation of retinoblastoma protein[J]. Biol Pharm Bull, 2012, 35(11): 1997–2003. DOI:10.1248/bpb.b12-00450 |
| [2] | 孙雨薇, 闫冬梅. 五味子多糖对体外培养肝癌SMMC-7721细胞Bcl-2和Bax蛋白表达的影响[J]. 中国处方药, 2016, 14(7): 21–22. |
| [3] | 陈海芳, 戚进, 余伯阳. 生脉散中人参、麦冬和五味子提取物体外抗氧化作用[J]. 中国实验方剂学杂志, 2016, 22(19): 37–42. |
| [4] | Leong PK, Chiu PY, Chen N, et al. Schisandrin B elicits a glutathione antioxidant response and protects against apoptosis via the redox-sensitive ERK/Nrf2 pathway in AML12 hepatocytes[J]. Free Radical Res, 2011, 45(4): 483–495. DOI:10.3109/10715762.2010.550917 |
| [5] | 安琳, 苏慎勇, 杨卫东, 等. 参芪五味子片口服降低胃癌化疗后胃肠道抑制及对患者免疫功能的影响[J]. 中药药理与临床, 2017, 33(2): 226–229. |
| [6] | Zhao T, Mao G, Mao R, et al. Antitumor and immunomodulatory activity of a water-soluble low molecular weight polysaccharide from Schisandra chinensis (Turcz.) Baill[J]. Food Chem Toxicol, 2013, 55: 609–616. DOI:10.1016/j.fct.2013.01.041 |
| [7] | 刘宇灵, 付赛, 樊丽姣, 等. 南北五味子化学成分、药理作用等方面差异的研究进展[J]. 中国实验方剂学杂志, 2017, 23(12): 228–234. |
| [8] | 姜恩平, 李贺, 于春艳, 等. 五味子乙素通过p38MAPK信号通路对结肠癌SW480细胞凋亡和侵袭的影响[J]. 吉林大学学报:医学版, 2015, 41(4): 675–679. |
| [9] | 禹洁, 刘培勋, 龙伟, 等. 五味子总木脂素的分离纯化与体外抗肿瘤活性的研究[J]. 中国药师, 2009, 12(12): 1718–1720. |
| [10] | Kim SJ, Min HY Lee EJ, et al. Growth inhibition and cell cycle arrest in the G0/G1 by schizandrin, a dibenzocyclooctadiene lignan isolated from Schisandra chinensis, on T47D human breast cancer cells[J]. Phytother Res, 2010, 24(2): 193–197. |
| [11] | 赖一鸣, 许娜, 陈晓杰, 等. 五味子多糖抑制卵巢癌SKOV3细胞增殖的研究[J]. 中华中医药学刊, 2014, 32(4): 856–857. |
| [12] | 上官梦原. 五味子脂A增强紫杉醇和卡铂对Skov3的抑瘤作用及机制研究[D]. 长春: 吉林大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10183-1014281891.htm |
| [13] | Yim SY, Lee YJ, Lee YK, et al. Gomisin N isolated from Schisandra chinensis significantly induces anti-proliferative and pro-apoptotic effects in hepatic carcinoma[J]. Mol Med Rep, 2009, 2(5): 725–732. |
| [14] | Inoue H, Waiwut P, Saiki I, et al. Gomisin N enhances TRAIL-induced apoptosis via reactive oxygen species-mediated up-regulation of death receptors 4 and 5.[J]. Int J Oncol, 2012, 40(4): 1058–1065. |
| [15] | Llambi F, Green DR. Apoptosis and oncogenesis:give and take in the BCL-2 family[J]. Curr Opin in Genet Develop, 2011, 21(1): 12–20. DOI:10.1016/j.gde.2010.12.001 |
| [16] | Zhou Y, Liu QH, Liu CL, et al. Calycosin induces apotosis in human ovarian cancer SKOV3 cells by activating caspases and Bcl-2 family proteins[J]. Tumour Biol, 2015, 36(7): 5333–5339. DOI:10.1007/s13277-015-3194-8 |
| [17] | Wang P, Xue Y, Han Y, et al. The STAT3-binding long noncoding RNA lnc-DC controls human dendritic cell differentiation[J]. Science, 2014, 344(6181): 310–313. DOI:10.1126/science.1251456 |
| [18] | Bharadwaj U, Eckols TK, Kolosov M, et al. Drug-repositioning screening identified piperlongumine as a direct STAT3 inhibitor with potent activity against breast cancer[J]. Oncogene, 2015, 34(11): 1341–1353. DOI:10.1038/onc.2014.72 |
| [19] | 陈亮, 盛修贵. IL-6/STAT3信号通路与卵巢癌关系研究进展[J]. 中华肿瘤防治杂志, 2015, 22(15): 1253–1256. |
| [20] | 钟莉莉, 陈雪, 赵银龙. MicroRNA与卵巢癌关系的研究进展[J]. 中国实验诊断学, 2017, 21(11): 2041–2043. DOI:10.3969/j.issn.1007-4287.2017.11.058 |
| [21] | 孙洁. CA19-9、CA125及HE4在卵巢癌中的检测意义[J]. 中国实验诊断学, 2016, 20(7): 1146–1147. |
 2018, Vol. 44
2018, Vol. 44


