扩展功能
文章信息
- 朱刚, 孙海斌, 徐刚
- ZHU Gang, SUN Haibin, XU Gang
- 肉苁蓉醇提物对去卵巢骨质疏松大鼠的治疗作用及其机制
- Therapeutic effect of cistanche deserticola ethanol extraction in rats with osteoporosis induced by ovariectomy and its mechanism
- 吉林大学学报(医学版), 2018, 44(01): 68-72
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 68-72
- 10.13481/j.1671-587x.20180113
-
文章历史
- 收稿日期: 2017-05-03
2. 郑州大学第五附属医院病理科, 河南 郑州 450052;
3. 河北医科大学第二医院烧伤整形科, 河北 石家庄 053600
2. Department of Pathology, Fifth Affiliated Hospital, Zhengzhou University, Zhengzhou 450052, China;
3. Department of Burn and Plastic surgery, Second Hospital, Hebei Medical University, Shijiazhuang 053600, China
骨质疏松是以骨密度降低及其显微结构发生实质性变化为主要特征的一类型疾病。骨质疏松的发病与年龄呈明显的正相关关系,尤其在40岁以上人群其相关性更加明显[1-2]。目前,我国60岁及以上人口总数已达到总人口数的13.26%[3]。对于骨质疏松的治疗现以使用骨吸收抑制剂、骨形成促进剂等治疗为主,虽然药物疗效确切,但不良反应也十分明显,寻找毒副作用小的治疗药物显得尤为重要[4]。肉苁蓉是名贵中药之一,又有沙漠人参的美誉。中国药典记载,肉苁蓉具有补肝肾、益精气的功效[5]。现代药理研究[6]证实:肉苁蓉具有一定的雌激素样作用。而雌激素是治疗女性骨质疏松的临床常用药物之一。国内外暂无使用肉苁蓉醇提物(cistanche deserticola ethanol extraction, CDE)进行骨质疏松治疗的研究,因此本文作者旨在探讨CDE对去卵巢所致的骨质疏松大鼠的治疗作用及其机制,为肉苁蓉的临床应用奠定基础。
1 材料与方法 1.1 实验动物、药物、主要试剂和仪器雌性SD大鼠72只,SPF级,体质量140~180 g,购于河南省实验动物中心,动物合格证号:SCXK(豫) 2005-0001。饲养于SPF级实验动物房,室温(23±2)℃,光照与黑暗时间各12h。戊酸雌二醇,购于德国拜耳公司,使用前用生理盐水配置成0.3 g·L-1注射液。肉苁蓉,购于北京同仁堂,打粉过10mm筛,加入75%乙醇溶液利用索氏提取器,回流提取4h,共提取2次,合并2次提取液,置于负压的旋转蒸发仪中,60℃浓缩至生药量为1 g·mL-1。骨钙素试剂盒(南京建成生物工程研究所),碱性磷酸酶(ALP)ELISA试剂盒(美国R&D公司),多聚甲醛(天津大茂化学试剂有限公司),其余化学试剂均为国产分析纯。恒温水浴槽(上海精宏实验设备有限公司),骨密度仪(美国HOLOGIC公司),全自动生化仪(河北厚德汉方医疗器械公司),常温低速离心机(湖南湘仪仪器有限公司),酶标仪(美国Bio-rad公司),骨密度仪和生物力学试验仪(英国LLOYD公司),游标卡尺(广州晨光科技有限公司)。
1.2 实验动物分组、造模和给药72只雌性SD大鼠随机分为对照组,模型组,雌二醇组(0.3 mg·kg-1),低、中和高剂量(0.5、1.0和2.0 g·kg-1)CDE组;每组12只。除对照组外,其余各组大鼠进行双侧卵巢摘除手术。3%戊巴比妥钠麻醉大鼠,使用剃毛器剔除背部中下部分毛发,酒精及碘酒双重消毒后,背部正中间开口,分别往两边扯动找到卵巢位置。使用手术线结扎子宫顶端后,剪除双侧卵巢,最后伤口缝合,并撒上青霉素。对照组大鼠于卵巢周围剪去少量脂肪。手术完成后,大鼠置于暖炉旁恢复,并连续3d肌肉注射青霉素预防感染(每天20万单位)。手术后第5天,待动物状态恢复正常后,开始灌胃给药。
1.3 大鼠右侧股骨密度测定给药20周后,麻醉大鼠,腹主动脉取血完成后,分离大鼠右侧股骨。钝性分离股骨后,使用纱布擦去股骨附近肌肉及组织,采用骨密度仪对离体大鼠右侧股骨进行密度分析。
1.4 大鼠左侧股骨生物力学测定给药20周后,麻醉大鼠,腹主动脉取血完成后,分离大鼠左侧股骨。4℃储存股骨,直至实验前24h,室温解冻股骨,并与实验前用滤纸吸干表面水分。置于生物力学实验仪上测定左侧股骨生物力学变化。设定参数为跨距20 mm,加速度为1 mm·min-1。实验完成后,使用游标卡尺测定股骨断面内外径。按文献[6]中的方法,计算左侧股骨最大弯曲力、最大应变和骨刚性。
1.5 大鼠血清中ALP和骨钙素水平测定给药20周后,麻醉大鼠,腹部下部开口,使用草纸拨开肠及肠下黏膜,暴露腹主动脉,使用一次性采血针与配套的采血管,与腹主动脉下部Y字岔口处进针取血,每只大鼠约取5 mL全血。室温静止4 h,使得血液完全凝固。3500 r·min-1、离心10 min,取血清。按照ALP及骨钙素ELISA试剂盒说明,测定血清中ALP和骨钙素水平。
1.6 大鼠血清中钙离子和磷离子水平测定按1.7中所述分离血清,取1mL血清置于全自动生化仪中,测定血清中钙离子和磷离子的水平。
1.7 观察HE染色大鼠子宫组织形态表现给药20周后,麻醉大鼠,腹主动脉取血完成后,分离大鼠子宫。取大鼠子宫左侧靠中部的部分,4%多聚甲醛固定48h。送检本医院病理科进行石蜡切片,HE染色后观察子宫组织形态表现。
1.8 统计学分析采用SPSS 16.0统计软件进行统计学分析。各组大鼠右侧股骨密度、左侧股骨最大弯曲力、左侧股骨最大应变、左侧股骨骨刚性及血清中ALP、骨钙素、钙离子和磷离子水平均以x±s表示,多组间样本均数比较采用单因素方差分析。以P < 0.05表示差异有统计学意义。
2 结果 2.1 各组大鼠右侧股骨密度与对照组比较,模型组大鼠右侧股骨密度明显降低(P < 0.01)。与模型组比较,雌二醇组及低、中和高剂量CDE组大鼠右侧股骨密度明显升高(P < 0.05或P < 0.01)。见表 1。
| (n=12, x±s) | ||||
| Group | Density of right femur (g·cm-2) |
Maximum bending force (mg·mm-2) |
Maximum strain (η/%) |
Bone rigid (KN×mm2) |
| Control | 0.304 1±0.003 7 | 116.80±2.64 | 0.069±0.002 | 30.51±1.55 |
| Model | 0.251 3±0.002 6* | 98.84±3.60* | 0.050±0.005* | 24.39±1.19* |
| Estradiol | 0.296 1±0.004 0△△ | 114.56±2.04△△ | 0.065±0.001△△ | 29.17±2.64△△ |
| CDE | ||||
| Low | 0.269 3±0.002 9△ | 100.33±3.62 | 0.057±0.009 | 25.31±3.24 |
| Middle | 0.2774±0.0032△ | 105.93±1.68△# | 0.063±0.004△# | 27.92±2.89△# |
| High | 0.279 0±0.002 0△ | 107.31±2.53△# | 0.065±0.003△# | 28.77±2.33△# |
| * P < 0.01 compared with control group;△ P < 0.05,△△ P < 0.01 compared with model group; # P < 0.05 compared with low dose of CDE group. | ||||
与对照组比较,模型组大鼠左侧股骨的最大弯曲力、最大应变及骨刚性明显降低(P < 0.01)。与模型组比较,雌二醇组、中和高剂量CDE组大鼠的最大弯曲力、最大应变及骨刚性明显升高(P < 0.05或P < 0.01),且中和高剂量CDE组大鼠上述指标明显高于低剂量CDE组(P < 0.05)。见表 1。
2.3 各组大鼠血清中ALP和骨钙素水平与对照组比较,模型组大鼠血清ALP和骨钙素水平明显升高(P < 0.01)。与模型组比较,雌二醇组和中、高剂量CDE组大鼠血清ALP水平明显降低(P < 0.05或P < 0.01),且中和高剂量CDE组大鼠血清ALP水平低于低剂量CDE组(P < 0.05)。与模型组比较,雌二醇组和高剂量CDE组大鼠血清骨钙素水平明显降低(P < 0.05或P < 0.01),且高剂量CDE组大鼠血清骨钙素水平明显低于低和中剂量CDE组(P < 0.05)。见表 2。
| [n=12, x±s, λB/(U·L-1)] | ||
| Group | ALP | Osteocalcin |
| Control | 2.942±0.081 | 20.792±0.575 |
| Model | 3.372±0.041* | 33.242±3.349* |
| Estradiol | 3.128±0.043△△ | 23.576±1.044△△ |
| CDE | ||
| Low | 3.301±0.035 | 31.239±2.080 |
| Middle | 3.214±0.029△# | 30.419±2.083 |
| High | 3.237±0.039△# | 26.308±1.903△#○ |
| * P < 0.01 compared with control group;△ P < 0.05,△△ P < 0.01 compared with model group; # P < 0.05 compared with low dose of CDE group; ○ P < 0.05 compared with middle dose of CDE group. | ||
与对照组比较,模型组大鼠血清钙离子的水平明显降低(P < 0.01)。与模型组比较,雌二醇组及低、中和高剂量CDE组大鼠的钙离子水平明显升高(P < 0.05或P < 0.01)。各组大鼠血清磷离子水平比较差异无统计学意义(P>0.05)。见表 3。
| [n=12, x±s, cB/(nmol·L-1)] | ||
| Group | Ca2+ | P3- |
| Control | 2.949±0.019 | 2.020±0.095 |
| Model | 2.362±0.033* | 1.970±0.145 |
| Estradiol | 2.908±0.057△△ | 2.107±0.124 |
| CDE | ||
| Low | 2.684±0.038△ | 2.072±0.164 |
| Middle | 2.716±0.072△ | 2.201±0.173 |
| High | 2.784±0.042△ | 2.177±0.151 |
| * P < 0.01 compared with control group;△ P < 0.05,△△ P < 0.01 compared with model group. | ||
对照组大鼠子宫内膜细胞排列整齐,腺体上皮呈高柱状,间质疏松,腺腔较大。模型组大鼠子宫内膜萎缩,腺体上皮呈低柱状,固有层组织较致密,上皮细胞细胞质较少。雌二醇组大鼠子宫内膜增厚,腺体上皮呈高柱状,上皮细胞肥大,胞浆丰富,腺体肥大。低、中和高剂量CDE组大鼠子宫内膜上皮较模型组明显增厚,腺体上皮呈高柱状致密排列,间质较为致密,且随剂量增加,腺体数量明显增加。见图 1(插页三)。
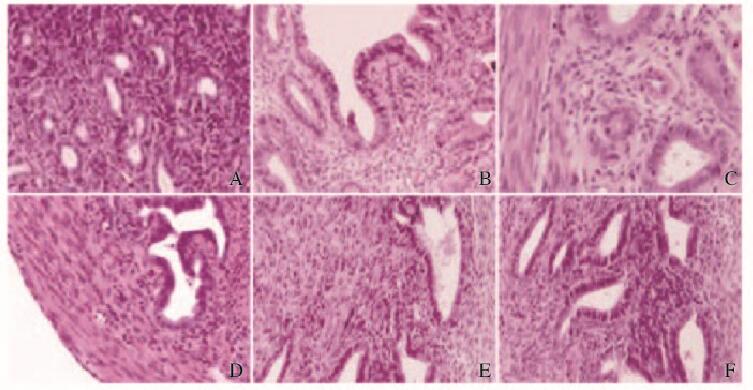
|
| A: Control group; B: Model group; C: Estradiol group; D: Low dose of CDE group; E: Middle dose of CDE group; F: High dose of CDE group. 图 1 各组大鼠子宫内膜组织形态表现(HE,×100) Figure 1 Morphology of endometrium tissue of rats in various groups(HE, ×100) |
|
|
骨质疏松是老年常见病之一,尤以女性发病率较高,其根本原因在于女性更年期后,机体雌激素水平的降低[7-8]。随着年龄的增加,人体各类型的激素水平产生波动,女性的雌激素分泌水平明显降低,这些因素均会导致骨质疏松的产生。卵巢摘除手术建立大鼠骨质疏松模型,模拟了这一疾病的进程,是目前筛选骨质疏松药物的首选动物模型[9]。本研究在手术造模后,使用青霉素注射的方法,消除了动物感染对实验造成的误差,并且明显提高手术后动物的成活率。中医认为骨质疏松属于“骨萎”的范围,病因以肾虚、肝血亏虚为主。肉苁蓉有沙漠人参的美誉,是中药中的上品[10],肉苁蓉补肾的中医功效与骨质疏松“骨萎”的中医本质相对应,中医认为“肾主骨,生髓”。补肾不仅可以纠正免疫力低下,加强下丘脑垂体性腺功能,还可以改善肠道对钙离子等关键离子的吸收,促进骨吸收,加快骨形成,起到调节机体内环境微量元素平衡的作用[11]。本研究采用现代药理学研究的手段和方法证实了这一中医内涵,发现CDE具有提高骨质疏松大鼠骨密度、改善骨生物力学功能的作用。ALP及骨钙素大部分由骨细胞合成,在骨的矿化过程中起到关键性的作用,而去卵巢大鼠由于雌激素的缺失会代偿性增加ALP和骨钙素的分泌[12-13]。临床研究[14]表明:妇女的骨钙素和ALP在绝经后的一段时间内均会保持在较高水平。血清中的多项指标,现在均已经作为诊断和预防措施选择的指标之一[15]。去卵巢大鼠模拟是高转换型骨质疏松,即卵巢摘除后破骨细胞骨吸收活性明显增强,伴随成骨细胞活性代谢性上调,骨代谢速率加快,ALP作为成骨细胞分泌物,可与血液中的钙离子相互作用共同促进骨质的合成[16-17]。因此血清中的ALP和钙离子水平可以反映骨代谢的速率。本研究结果显示:去卵巢模型大鼠血清ALP水平明显升高,钙离子浓度降低,而肉苁蓉给药组则能够有效地逆转这一趋势,起到治疗骨质疏松的作用。骨骼是运动系统的重要组成部分,而骨骼的质量主要体现在生物力学功能上,骨质疏松患者骨组织中钙质大量流失,可以导致包括最大弯曲力、最大应变、骨刚性在内的多种骨功能下降[18]。本研究结果显示:CDE给药后可以有效地改善去卵巢所导致大鼠股骨生物力学功能下降。而现代药理学研究证实了肉苁蓉具有雌激素样作用,这也是肉苁蓉能够起到治疗骨质疏松的原因之一。
| [1] | 严孙杰, 冯霖, 沈喜妹, 等. 健康成人体成分差异对不同年龄段人群骨密度的影响[J]. 福建医科大学学报, 2009, 43(4): 301–305. |
| [2] | 张萌萌. 中国老年学学会骨质疏松委员会骨代谢生化指标临床应用专家共识[J]. 中国骨质疏松杂志, 2014, 20(11): 1263–1272. |
| [3] | 胡鞍钢, 刘生龙, 马振国. 人口老龄化、人口增长与经济增长——来自中国省际面板数据的实证证据[J]. 人口研究, 2012, 36(3): 14–26. |
| [4] | 胡一梅. 老年性骨质疏松症病理研究及治疗进展[D]. 成都: 成都中医药大学, 2006. |
| [5] | 赖青海, 王琳琳, 丁辉, 等. 肉苁蓉治疗骨质疏松症研究进展[J]. 辽宁中医药大学学报, 2016, 18(3): 102–104. |
| [6] | 魏珍珍. 肉苁蓉苯乙醇苷对大、小鼠围绝经期模型的影响[D]. 郑州: 河南中医学院, 2014. |
| [7] | Geisler J, Lonning PE, Krag LE, et al. Estrogens and bone metabolism in postmenopausal women with early breast cancer at low risk treated with exemestane:a randomized placebo-controlled study[J]. J Clin Oncol, 2004, 22(14): 531. |
| [8] | Flores R, Döhrmann S, Schaal C, et al. The selective estrogen receptor modulator raloxifene inhibits neutrophil extracellular trap formation[J]. Front Immunol, 2016, 7: 566. |
| [9] | 李素萍. 骨质疏松动物模型的研究现状[J]. 中国组织工程研究与临床康复, 2011, 15(20): 3767–3770. DOI:10.3969/j.issn.1673-8225.2011.20.038 |
| [10] | 杨峻山. 沙漠人参-肉苁蓉[J]. 中国药学杂志, 2011, 46(12): 881. |
| [11] | 黄继锋, 宋敏, 李泽佳, 等. 补肾固本方对去卵巢大鼠骨质疏松症骨密度、骨矿盐含量及CT含量的影响[J]. 中国实验方剂学杂志, 2015, 21(4): 149–152. |
| [12] | 司会群, 卜淑敏, 赵俊勇, 等. 全身垂直振动对去卵巢骨质疏松大鼠胫骨和子宫血管内皮生长因子蛋白表达的影响[J]. 中国老年学杂志, 2016, 36(18): 4423–4425. DOI:10.3969/j.issn.1005-9202.2016.18.009 |
| [13] | Yang S, Zhou Y, Shuai B, et al. Role of the ER/NO/cGMP signaling pathway in the promotion of osteogenic differentiation of rat bone marrow mesenchymal stem cells by actaea racemosa extract[J]. Evid Based Complement Alternat Med, 2016, 2016: 2615620. |
| [14] | Löfman O, Magnusson P, Toss G, et al. Common biochemical markers of bone turnover predict future bone loss:a 5-year follow-up study[J]. Clin Chim Acta, 2005, 356(1/2): 67–75. |
| [15] | 薛昊罡, 冷冰, 马恩元, 等. 血清细胞因子水平检测在辅助诊断和治疗老年骨质疏松中的作用[J]. 中国老年学杂志, 2011, 31(11): 1984–1985. DOI:10.3969/j.issn.1005-9202.2011.11.020 |
| [16] | Zhao D, Wang J, Liu Y, et al. Expressions and clinical significance of serum bone Gla-protein, bone alkaline phosphatase and C-terminal telopeptide of type Ⅰ collagen in bone metabolism of patients with osteoporosis[J]. Pak J Med Sci, 2015, 31(1): 91–94. |
| [17] | Xu MH, L iX, Yuan FL. Is it necessary to investigate rapamycin-modulated autophagy during the development of experimental osteoporosis in female rat[J]. Osteoporos Int, 2016, 27(12): 3665–3666. DOI:10.1007/s00198-016-3734-0 |
| [18] | Peng S, Liu XS, Huang S, et al. Intervention timing of strontium treatment on estrogen depletion-induced osteoporosis in rats:bone microstructure and mechanics[J]. J Orthop Res, 2014, 32(3): 477–484. DOI:10.1002/jor.v32.3 |
 2018, Vol. 44
2018, Vol. 44


