扩展功能
文章信息
- 严敏, 冯丹, 高平, 魏茜茜, 姜雪, 张晓萌, 朱松
- YAN Min, FENG Dan, GAO Ping, WEI Qianqian, JIANG Xue, ZHANG Xiaomeng, ZHU Song
- 6种光固化复合树脂吸水性、溶解性和单体释放量的比较
- Comparison of water absorption, solubility and monomer release of six kinds of light-curing composite resins
- 吉林大学学报(医学版), 2018, 44(01): 45-51
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 45-51
- 10.13481/j.1671-587x.20180109
-
文章历史
- 收稿日期: 2017-11-05
光固化复合树脂因具有良好的美学性能、机械性能及操作简便等优点被广泛应用于临床。目前70%以上的商品复合树脂以双酚A双甲基丙烯酸缩水甘油酯(Bisphenol A diglycidyl methacrylate,Bis-GMA)为主要基质[1],由于Bis-GMA的黏度很高,限制了无机填料的加入,所以通常要加入相对分子质量较小、黏度较低的稀释剂如双甲基丙烯酸二缩三乙二醇酯(triethylene glycol dimethacrylate,TEGDMA)。复合树脂在光引发条件下发生聚合反应时,仍有部分单体未能聚合,成为残余单体。残余单体可在唾液的浸泡下进行释放,已聚合的树脂成分也会在口腔唾液、微生物、酶及咀嚼磨耗等的作用下发生降解,其中唾液衍生酯酶和非特异性酯酶能轻易降解复合树脂的成分[2]。如果水或者其他溶剂进入树脂聚合物内,将导致降解的低聚物和残余单体释放,Bis-GMA基质较为软化,更容易被渗透,从而使聚合物网膨胀,最终导致残余单体长期释放[3]。研究[4-6]表明:复合树脂释放的成分具有致敏性、致突变性、遗传毒性和雌激素样作用等。Bis-GMA和TEGDMA对来源于人类牙髓、牙龈或牙周膜成纤维细胞的原代细胞系和永生细胞系均具有较高毒性[7]。
复合树脂释放成分的生物安全性已经引起越来越多的关注,近年研究者们也围绕着复合树脂释放成分进行了较多研究,但是关于树脂长期释放的单体量研究尚少。本研究拟检测目前具有代表性的6种商品光固化复合树脂的吸水值、溶解值及单体释放量,探讨各检测指标出现差异的原因,为临床选择和应用光固化复合树脂提供参考依据。
1 材料与方法 1.1 材料6种商品复合树脂分别为FiltekTM Z250(Z250)、FiltekTM Z350XT(Z350)、Aelite LS Posterior(ALS)、Clearfil Majesty Posterior(CMP)、Neofil Nano(NN)和Tetric N-Ceram(TNC),其中ALS和CMP是低收缩复合树脂。具体资料见表 1。
| Material | Organic matrix | Filler | Filler volume /weight(η/%) | Manufacturer | Lot number |
| ALS | Bis-GMA, Bis-EMA, TEGDMA | Glass filler, amorphous silica | 74/88 | Bisco, Schamburg, IL, USA | 1600006346 |
| CMP | Bis-GMA, TEGDMA,ArDMA | Glass ceramics,Surface-treatedalumina microfillers,silica | 82/92 | Kuraray, America, Inc | 5H0034 |
| Z350 | Bis-GMA, Bis-EMA, TEGDMA, UDMA | Zirconia, zirconia clusterfiller, silica cluster | 63.0/78.5 | 3M ESPE, USA | N766682 |
| NN | Bis-GMA, TEGDMA,1, 6-Ethylene glycol dimethacrylate | Si-Al-borosilicat glass,barium silicate,silica | 66/75 | Kerr, Kavo, USA | 5279234 |
| Z250 | Bis-GMA, Bis-EMA, TEGDMA, UDMA | Zirconia silica,silica filler | 60/82 | 3M ESPE, USA | N657490 |
| TNC | Bis-GMA, TEGDMA, Bis-EMA, UDMA | Ba-Al-Fl-borosilicat glass,Ba glass, YbF3 filler | 55-57/80-81 | Ivoclar vivadent, Schaan, Liechtenstein | U57266 |
Bis-GMA和TEGDMA(分析纯,美国Sigma-aldrich公司)(表 2)。高分辨液相色谱质谱仪(Agilent1290-micrOTOF Q Ⅱ,德国Bruke公司);电热恒温鼓风干燥箱(DGG-9070B,上海森信实验仪器有限公司);光固化灯(SLC-ⅧA, 杭州四方医疗器械有限公司),光强度为900 mW·cm-2,光强度由辐射仪(美国登士柏公司)进行监测;电子分析天平(MATTELER AE240,北京晨曦勇创科技有限公司);保干器;电子游标卡尺(精度为0.001 mm)。
| Monomer | Molecular formula | Molecular weight (g·mol-1) |
CAS number |
| Bis-GMA | C29H36O8 | 512.59 | 1 565-94-2 |
| TEGDMA | C14H22O6 | 286.32 | 109-16-0 |
按照ISO 4049-2009,将6种复合树脂制作成直径15mm、厚1mm的圆形试件,固化后放入装有重新干燥过硅胶的保干器内支架上,将试件放入第一个保干器中22h(37℃)后,再放入第2个保干器2h(23℃)后称质量,重复进行直至达到恒定质量(在24h内,每个试件的质量减少量≤0.1mg),记为m1;用电子千分尺测量试件2个相互垂直的直径以及中心和圆周四等分处的厚度,计算试件的体积,记为V。将恒定的试件浸泡于37℃的去离子水中7 d,取出称质量,记为m2。按照上述方法将试件放入保干器中直至质量再次恒定,记为m3。吸水值(water sorption value, Wsp)和溶解值(water solubilityvalue, Wsl)可由下列公式计算:Wsp(μg·mm-3)=(m2-m3)/V,Wsl(μg·mm-3)=(m1-m3)/V。m1为试件浸水前质量(μg),m2为试件浸水后质量(μg),m3为再恒定质量(μg),V为试件的体积(mm3)。
1.4 单体渗出量的检测 1.4.1 样品制备将6种复合树脂制备成直径6mm、厚度2mm的树脂片,制备过程中将不锈钢模具放置在玻璃板上,用充填器将树脂加压充填入模具内,树脂上下表面用聚酯薄膜覆盖以抑制空气中的氧对树脂表面的阻聚作用,盖玻片挤压出多余树脂,移去玻片,光固化灯光源距试件表面约1mm,光照40s。每种材料制备3个试件,然后浸入1 mL、37℃的75%乙醇溶液中,24h后终止浸泡。重复上述步骤,分别在7d、28d和3个月终止浸泡,浸出液4℃密封保存备用。
1.4.2 色谱条件色谱柱:Agilent SB-C18(2.1mm×150mm,1.8μm), 柱温为(23±2)℃。流动相:A相为乙腈,B相为水;梯度洗脱条件:0.00min,30%A-70%B;5.00min,80%A-20%B。流速0.7mL·min-1,进样量5μL。
1.4.3 质谱条件电喷雾电离源(eletrospray ionization, ESI),雾化气压力0.8Bar,毛细管电压4500V,干燥气流速6.0L·min-1,干燥气温度200℃。
1.4.4 标准曲线的绘制和线性回归方程的建立配制2.5、5.0、10.0、20.0和30.0mg·L-1的Bis-GMA和TEGDMA标准溶液,在选定的色谱质谱条件下分析。以浓度为横坐标,峰面积为纵坐标,绘制标准曲线(图 1)。Bis-GMA和TEGDMA的浓度在2.5~30.0 mg·L-1的范围内呈线性,Bis-GMA的线性回归方程为Y=21977.523X-23713.962,相关系数为0.997;TEGDMA的线性回归方程为Y=2043.858X+11540.721,相关系数为0.998。

|
| 图 1 Bis-GMA(A)和TEGDMA(B)标准溶液的标准曲线 Figure 1 Standard concentration curves of standard solutions of Bis-GMA(A) and TEGDMA(B) |
|
|
所有样品检测前需用离心机4000r·min-1离心3 min。以标准溶液Bis-GMA和TEGDMA提取离子色谱图(extracted ion chromatogramme, EIC)出现的主峰时间及峰面积为参照,选取被测样品EIC相应时间段内的洗脱峰,测定峰面积,根据线性回归方程计算样品中Bis-GMA和TEGDMA的浓度。Bis-GMA和TEGDMA的EIC和质谱图见图 2和3。

|
| 图 2 Bis-GMA的EIC(A)和质谱图(B) Figure 2 EIC(A) and mass spectrum(B) of Bis-GMA |
|
|
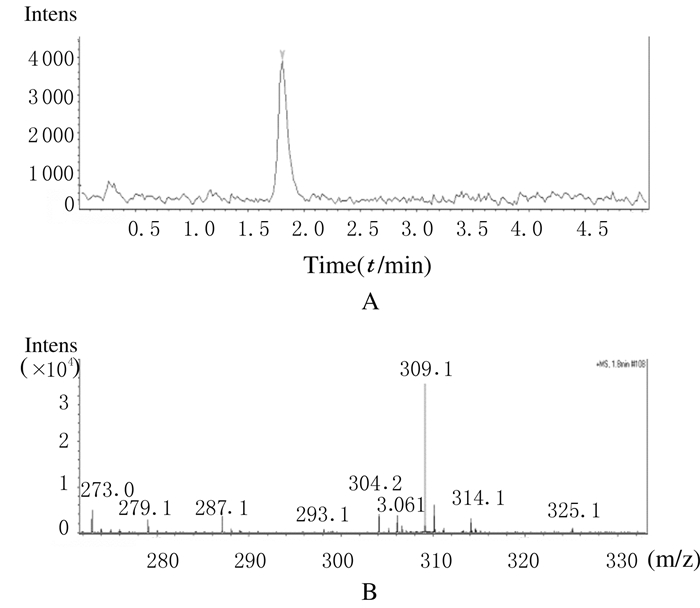
|
| 图 3 TEGDMA的EIC(A)和质谱图(B) Figure 3 EIC(A) and mass spectrum(B) of TEGDMA |
|
|
采用SPSS20.0软件包进行统计学分析。各组复合树脂吸水值、溶解值和单体释放量均以x±s表示,多组间比较采用单因素方差分析,两两比较用LSD-t检验。检验水准为ɑ=0.05。
2 结果 2.1 各组树脂吸水值和溶解值6种复合树脂的吸水值和溶解值见表 3。其中ALS吸水值最小,Z350吸水值最大,由小到大依次为ALS < CMP < TNC≈Z250 < NN < Z350,组间比较差异有统计学意义(P < 0.05)。Z350溶解值最小,TNC溶解值最大,其余4种树脂溶解值比较差异无统计学意义(P>0.05),由小到大依次为Z350 < NN≈ALS≈CMP≈Z250 < TNC,组间比较差异有统计学意义(P < 0.05)。
| (n=5, x±s, μg·mm-3) | ||
| Material | Water sorption value | Watersolubility value |
| ALS | 6. 22±0. 12 | 0. 90± 0. 06 |
| CMP | 8. 12±0. 28 | 0. 94± 0.34 |
| Z350 | 23. 36±1. 09 | 0. 54±0. 14 |
| NN | 15. 53±0. 44 | 0. 87± 0. 11 |
| Z250 | 14. 24±0. 69 | 0. 94± 0. 12 |
| TNC | 13. 95 ±0. 70 | 1.7± 0.31 |
标准Bis-GMA样品,分离主要成分即Bis-GMA峰保留时间3.5min。标准TEGDMA样品,主要分离成分即TEGDMA峰保留时间1.8min。
6种复合树脂的Bis-GMA和TEGDMA在75%乙醇溶液中24 h、7 d、1个月和3个月的单体渗出量见表 4和表 5。Bis-GMA的释放量:随着时间延长,ALS释放量缓慢增加,与1个月时比较,3个月时ALS释放量减少(P < 0.05);与1个月时比较,7 d时CMP释放量差异无统计学意义(P>0.05),3个月时CMP释放量减少(P < 0.05);与7 d时比较,24 h时Z350和NN释放量差异无统计学意义(P>0.05),1个月时Z350和NN释放量开始增加(P < 0.05);Z250的释放量随着时间的增加而增加,各时间点释放量比较差异均有统计学意义(P < 0.05);与1个月时比较,7 d时TNC释放量差异无统计学意义(P>0.05),3个月时释放量增加(P < 0.05)。TEGDMA的释放量:与7 d时比较,24 h时ALS和CMP释放量差异无统计学意义(P>0.05),1个月时释放量增加(P < 0.05),3个月时不再增加(P>0.05);与1个月时比较,3个月时CMP释放量减少(P < 0.05);与7 d时比较,24 h时Z350和Z250释放量差异无统计学意义(P>0.05),1个月时Z350和Z250释放量开始增加(P < 0.05);NN和TNC未检出TEGDMA。
| [n=3, x±s, ρB/(mg·L-1)] | ||||
| Material | Bis-GMA | |||
| 24 h | 7 d | 1 month | 3 months | |
| ALS | 18.27±1.09 | 25.18±1.88 | 30.05±2.18 | 24.90±1.07* |
| CMP | 24.85±1.10 | 30.64±0.75 | 31.49±1.14 | 19.08±1.17* |
| Z350 | 32.37±1.13 | 33.00±1.41 | 36.70±1.32△ | 47.30±2.24△ |
| NN | 102.29±1.77 | 102.93±0.64 | 111.63±4.25△ | 120.44±2.92△ |
| Z250 | 31.12±1.35 | 35.05±1.86 | 43.68±1.15 | 53.30±2.40 |
| TNC | 62.10±1.81 | 83.69±1.69 | 85.83±0.42 | 97.37±4.04 |
| * P < 0.05 compared with 1 month; △ P < 0.05 compared with 7 d. | ||||
| [n=3, x±s, ρB/(mg·L-1)] | ||||
| Material | TEGDMA | |||
| 24 h | 7 d | 1 month | 3 months | |
| ALS | 29.44±0.47 | 30.62±0.61 | 48.98±1.56* | 49.59±2.01* |
| CMP | 19.16±0.93 | 19.50±1.23 | 28.46±0.93 | 22.90±1.11△ |
| Z350 | 0.31±0.04 | 0.39±0.05 | 0.81±0.04 | 1.69±0.67 |
| NN | - | - | - | - |
| Z250 | 1.81±0.19 | 1.94±0.10 | 3.85±0.48* | 5.27±1.14* |
| TNC | - | - | - | - |
| * P < 0.05 compared with 7 d; △ P < 0.05 compared with 1 month.“-”:No data. | ||||
光固化复合树脂的吸水是一个扩散-控制的过程,理论上有2种途径:一种是自由体积途径,水分子聚集在树脂-填料界面、微孔隙和形态缺陷处,没有与极性基团发生反应;另一种是相互作用途径,水分子与一些亲水基团形成氢键[8]。复合树脂的吸水性取决于有机基质(单体种类、聚合转化率和极性相互作用)、无机填料(组分、类型、形态、粒径和在基质中的分布情况)、树脂-填料界面的性质、催化剂和引发剂的浓度、溶剂性质及树脂暴露在溶剂中的表面积,其中基质发挥着主要作用[8-9]。树脂浸泡在水中,吸水和溶解过程会同时发生。初期水分子进入材料使其质量迅速增加并使材料发生化学降解,部分降解产物从材料中释放,同时水分子扩散致残余单体浸出,无机填料也发生降解,材料质量相应减少,导致材料的综合性能下降。树脂的溶解性与吸水性密切相关,因为溶剂进入材料后残余单体和其他可溶解成分才能释放,且与树脂的转化率和交联密度也有关[10]。影响溶解性的因素包括可浸出物质的种类、数量、大小、极性、浸泡溶剂、浸泡时间和温度[8]。
Z350的吸水值最高,这可能与其有机基质含量较高及单体中含亲水性基团有关。Z350的填料含量为质量的78.5%,是除了NN之外填料含量最低的,Z350含有Bis-GMA和TEGDMA,Bis-GMA中存在亲水的羟基,TEGDMA中含有亲水的醚键,这些亲水基团的存在有助于材料吸收水。虽然Z350的吸水值最高但溶解值却是最低的,这与材料内部网络密度有关[11]。TNC和Z250的吸水值相近,与其树脂基质构成比相近有关。ALS吸水值最小,原因是由于其填料构成比高且含有疏水性单体Bis-EMA,Bis-EMA是Bis-GMA的非羟基化相似物,可减少树脂的吸水性,近年已经开始部分替代Bis-GMA。CMP吸水值仅次于ALS,其基质中含有疏水性芳香族二甲基丙烯酸酯且填料构成比高。
复合树脂的浸出成分不仅与树脂的物理和机械性能有密切关联,也是评价材料生物安全性的决定因素[12-13]。许多单体如TEGDMA是引起接触性皮炎、扁平苔藓、牙龈炎和溃疡等各种过敏反应的致敏剂[14]。影响单体释放的三个重要因素包括树脂单体的聚合转化率、可释放成分(如有机基质和填料)的大小及化学性质、溶剂的种类[7]。另外,光强度、光照距离和光照时间也可对单体释放量产生影响。
本研究6种实验树脂中ALS和CMP是用于后牙的低收缩复合树脂,其余4种均为目前临床常用的前后牙通用型树脂。实验常用的溶液主要分为两大类:第一类是水溶液,包括人工唾液或人的唾液、蒸馏水和细胞培养液等;第二类是有机溶液,包括乙醇和丙酮溶液等[15]。根据美国食品药物管理局(Food and Drug Administration,FDA)的规定,75%乙醇溶液可作为食物/口腔的模拟液且与临床相关,其模拟某些饮料(包括含酒精的)、蔬菜和水果等食物[16]。本实验采用此溶液是为了模拟口腔的极端环境,这对复合树脂的性能稳定提出了较高的要求。目前大多数树脂单体释放实验为短期实验,检测的时间点一般有1h、3h、24h、7d、28d和1个月。很多研究[15, 17]表明:树脂聚合后的24 h内残余单体释放量较多,随后释放量呈缓慢上升趋势。极少数研究者进行了长期实验[18]。本实验选取大多数研究者选用的时间点24h、7d、1个月和3个月, 其中3个月的时间较长,这对于深入了解单体释放的规律具有重要意义。液相色谱法特别适用于分离多组分的试样,而且分离效率高、分析速度快;质谱法通过将被测物质离子化并按质荷比大小进行分离从而提供分子质量信息,根据质谱图可以进行定性定量分析,质谱法鉴别能力强、灵敏度高,通常将质谱法和液相色谱法联合应用,液相色谱质谱联用既可以发挥色谱法的高分离能力,又可利用质谱法的高鉴别能力,有利于对复杂混合物成分进行检测及分析[19]。
残余单体或其他成分从树脂聚合物网络浸出的2个必要条件是扩散和膨胀[13]。当浸泡溶液的溶解度参数与聚合物成分的溶解度参数相匹配时易发生扩散。水溶性溶剂易被亲水结构吸引,而有机溶剂更容易扩散到疏水结构中。溶剂扩散入聚合物网络可导致已存在空隙的膨胀和开放,膨胀程度取决于聚合物网络的刚性和交联密度,残余单体在聚合物内的扩散状况取决于其相对分子质量和分子结构的柔韧性。与具有刚性结构的大分子Bis-GMA相比,TEGDMA相对分子质量小且含有环氧乙烷长链,使得该单体易发生化学降解反应、易移动且相对容易从基质中洗脱出来[13, 15]。本研究中Bis-GMA检测量普遍大于TEGDMA,这是由于基质中的Bis-GMA构成比大于TEGDMA,且75%乙醇溶液与Bis-GMA有相似的溶解度参数,乙醇溶液能轻易渗透进入树脂基质并使聚合物网络膨胀引起残余单体释放。Polydorou等[18]研究发现:无论聚合时间、存储时间和树脂种类如何,Bis-GMA在75%乙醇溶液中的释放量一直是最高的,而且长期保持在较高水平。本研究中,复合树脂聚合后24h内可在浸泡液中检测出残余单体且释放量较高,随后释放量呈缓慢升高趋势。3个月时ALS和CMP的Bis-GMA释放量及CMP的TEGDMA释放量减少的原因是单体释放量不再增加,但溶液中单体发生了化学降解,化学降解的主要原因之一是单体内包含较多易水解的基团,如羟基、酯键和聚氨酯键等。NN和TNC的Bis-GMA释放量较高而TEGDMA未检出,可能由于其TEGDMA构成比低,且释放量少,导致仪器检测不出, 其他的研究也出现过类似结果[13]。
本文作者比较6种复合树脂的吸水值及单体释放量发现:两者之间不存在线性相关,原因是单体释放量的多少与聚合后材料的吸水性和溶解性、残余单体量、化学降解作用及材料表面状态等多种因素有关。但降低树脂的吸水值、溶解值及单体释放量,可以提高材料的综合性能和使用寿命,减少对患者的危害。
综上所述,本研究中6种复合树脂浸泡不同的时间有不同的单体释放量,ALS和CMP2种低收缩树脂优于其余4种树脂。Z350和NN的吸水值及NN的Bis-GMA释放量很高,可能会影响材料充填后的长期使用效果。在今后的临床工作中要根据临床需要及复合树脂的综合性能选择相应的光固化复合树脂。
| [1] | Moilanen LH, Dahms JK, Hoberman AM. Reproductive toxicity evaluation of the dental resin monomer bisphenol a glycidyl methacrylate (CAS 1565-94-2) in mice[J]. Int J Toxicol, 2013, 32(6): 415–425. DOI:10.1177/1091581813511995 |
| [2] | Cai K, Delaviz Y, Banh M, et al. Biodegradation of composite resin with ester linkages:identifying human salivary enzyme activity with a potential role in the esterolytic process[J]. Dent Mater, 2014, 30(8): 848–860. DOI:10.1016/j.dental.2014.05.031 |
| [3] | Finer Y, Jaffer F, Santerre JP. Mutual influence of cholesterol esterase and pseudocholinesterase on the biodegradation of dental composites[J]. Biomaterials, 2004, 25(10): 1787–1793. DOI:10.1016/j.biomaterials.2003.08.029 |
| [4] | Visalli G, Baluce B, La Maestra S, et al. Genotoxic damage in the oral mucosa cells of subjects carrying restorative dental fillings[J]. Arch Toxicol, 2013, 87(1): 179–187. DOI:10.1007/s00204-012-0915-2 |
| [5] | Styllou M, Reichl FX, Styllou P, et al. Dental composite components induce DNA-damage and altered nuclear morphology in gingiva fibroblasts[J]. Dent Mater, 2015, 31(11): 1335–1344. DOI:10.1016/j.dental.2015.08.156 |
| [6] | Gupta SK, Saxena P, Pant VA, et al. Release and toxicity of dental resin composite[J]. Toxicol Int, 2012, 19(3): 225–234. DOI:10.4103/0971-6580.103652 |
| [7] | Gul P, Miloglu FD, Akgul N. Hplc analysis of eluted monomers from dental composite using different immersion media[J]. J Liq Chromatogr Related Technol, 2014, 37(2): 155–170. DOI:10.1080/10826076.2012.738619 |
| [8] | Wei YJ, Silikas N, Zhang ZT, et al. Diffusion and concurrent solubility of self-adhering and new resin-matrix composites during water sorption/desorption cycles[J]. Dent Mater, 2011, 27(2): 197–205. DOI:10.1016/j.dental.2010.10.014 |
| [9] | Fonseca AS, Labruna Moreira AD, de Albuquerque PP, et al. Effect of monomer type on the CC degree of conversion, water sorption and solubility, and color stability of model dental composites[J]. Dent Mater, 2017, 33(4): 394–401. DOI:10.1016/j.dental.2017.01.010 |
| [10] | Sideridou ID, Karabela MM, Vouvoudi ECh. Physical properties of current dental nanohybrid and nanofill light-cured resin composites[J]. Dent Mater, 2011, 27(6): 598–607. DOI:10.1016/j.dental.2011.02.015 |
| [11] | Boaro LC, Gonçalves F, Guimarães TC, et al. Sorption, solubility, shrinkage and mechanical properties of "low-shrinkage" commercial resin composites[J]. Dent Mater, 2013, 29(4): 398–404. DOI:10.1016/j.dental.2013.01.006 |
| [12] | Alshali RZ, Salim NA, Sung R, et al. Qualitative and quantitative characterization of monomers of uncured bulk-fill and conventional resin-composites using liquid chromatography/mass spectrometry[J]. Dent Mater, 2015, 31(6): 711–720. DOI:10.1016/j.dental.2015.03.010 |
| [13] | Alshali RZ, Salim NA, Sung R, et al. Analysis of long-term monomer elution from bulk-fill and conventional resin-composites using high performance liquid chromatography[J]. Dent Mater, 2015, 31(12): 1587–1598. DOI:10.1016/j.dental.2015.10.006 |
| [14] | Alanko K, Susitaival P, Jolanki R, et al. Occupational skin diseases among dental nurses[J]. Contact Derm, 2004, 50(2): 77–82. DOI:10.1111/cod.2004.50.issue-2 |
| [15] | Łagocka R, Jakubowska K, Chlubek D, et al. Elution study of unreacted TEGDMA from bulk-fill composite (SDRTM Dentsply) using HPLC[J]. Adv Med Sci, 2015, 60(2): 191–198. DOI:10.1016/j.advms.2015.02.003 |
| [16] | Polydorou O, Huberty C, Wolkewitz M, et al. The effect of storage medium on the elution of monomers from composite materials[J]. J Biomed Mater Res B Appl Biomater, 2012, 100(1): 68–74. |
| [17] | Tsitrou E, Kelogrigoris S, Koulaouzidou E, et al. Effect of extraction media and storage time on the elution of monomers from four contemporary resin composite materials[J]. Toxicol Int, 2014, 21(1): 89–95. |
| [18] | Polydorou O, Konig A, Hellwig E, et al. Long-term release of monomers from modern dental-composite materials[J]. Eur J Oral Sci, 2009, 117(1): 68–75. DOI:10.1111/eos.2009.117.issue-1 |
| [19] | Van Landuyt KL, Nawrot T, Geebelen B, et al. How much do resin-based dental materials release? A meta-analytical approach[J]. Dent Mater, 2011, 27(8): 723–747. DOI:10.1016/j.dental.2011.05.001 |
 2018, Vol. 44
2018, Vol. 44


