扩展功能
文章信息
- 李媛, 史册, 张雪, 赵欢, 郝新青, 胡月, 刘苍维, 周怡君, 闫广兴, 张颖丽, 孙宏晨
- LI Yuan, SHI Ce, ZHANG Xue, ZHAO Huan, HAO Xinqing, HU Yue, LIU Cangwei, ZHOU Yijun, YAN Guangxing, ZHANG Yingli, SUN Hongchen
- 细胞极性相关蛋白CDC42和PAR3在小鼠牙胚发育过程中的表达
- Expressions of cell polarity related proteins CDC42 and PAR3 during tooth germ development in mice
- 吉林大学学报(医学版), 2018, 44(01): 41-44
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 41-44
- 10.13481/j.1671-587x.20180108
-
文章历史
- 收稿日期: 2017-10-10
2. 吉林省牙发育及颌骨重塑与再生重点实验室, 吉林 长春 130021;
3. 吉林大学口腔医院病理科, 吉林 长春 130021
2. Jilin Provincial Key Laboratory of Tooth Development and Bone Remodeling, Changchun 130021, China;
3. Department of Oral Pathology, Stomatology Hospital, Jilin University, Changchun 130021, China
牙发育是一个连续的过程,根据形态变化可分为蕾状期、帽状期和钟状期3个时期。分化成熟的具有分泌功能的成牙本质细胞的细胞器主要分布于分泌端胞浆内,呈高柱状排列,这种形态及功能上不对称分布称为成牙本质细胞的极化[1]。细胞的极性[2]是某些胞质成分不对称,这种特定的空间分布会促进不同的细胞行为,如分化、局部细胞膜增长、免疫系统激活、定向细胞迁移和分子的跨膜运输。对于哺乳动物,上皮细胞是研究细胞极性形成的典型模型,其极性的建立需要细胞连接作为外在启动信号,最终形成顶底极性(apical-basal polarity,A-B极性)[3]。在A-B极性形成的过程中,细胞连接的形成作为极性信号,指导PAR极性复合体定位于细胞顶端[4]。PAR极性复合体由PAR3、PAR6与aPKC组成,可与Rho GTPase信号相互作用,参与极性的维持和调控[5]。PAR极性复合体成员之一的PAR3还参与细胞连接的形成[6]。CDC42作为Rho家族的一员,不仅参与细胞分裂、细胞迁移和伪足形成等,还参与极性复合物的形成,是细胞极化的中心,并调控多种极性形成的信号通路[7-9]。然而,关于CDC42和PAR3在牙发育中的时空表达及其对成牙本质细胞与成釉细胞极性作用的相关研究较少。本研究通过对小鼠牙发育期不同阶段的牙胚(蕾状期、帽状期、钟状早期和钟状晚期)进行免疫组织化学染色,观察CDC42和PAR3在牙胚发育过程中的表达,初步探讨其在成牙本质细胞和成釉细胞极性形成中的作用。
1 材料与方法 1.1 实验动物成年雄性C57小鼠10只,体质量约20 g;成年雌性C57小鼠20只,体质量约24 g;均购自吉林大学实验动物中心(清洁级),动物许可证号:SCXK(吉)2013-0001。所有小鼠状况良好,无系统性疾病。
1.2 主要试剂和仪器15% EDTA脱钙液和4%多聚甲醛(北京化学工业集团有限责任公司),兔抗小鼠CDC42单克隆抗体(美国Abcam公司),兔抗小鼠PAR3多克隆抗体(美国Proteintech公司),免疫组织化学试剂盒(KIT-9706,福建迈新生物技术开发有限公司),DAB(ZLI-9019,北京中杉金桥生物科技有限公司)。切片机,体视显微镜(SZX16)和电子显微镜(Vanox)(日本Olympus公司)。
1.3 标本制备及处理1只雄性小鼠与2只雌性小鼠合笼,次日上午观察阴栓,以查到阴栓当天记为胚胎0.5 d(embryonic day 0.5,E0.5)。胚胎小鼠发育至13.5、14.5、16.5和18.5d(E13.5、E14.5、E16.5和E18.5),取孕鼠脱颈处死后,取出子宫,于体式显微镜下分离小鼠胚胎,取小鼠头部,4%多聚甲醛4℃固定24 h,乙醇梯度脱水,过二甲苯,标本透明,浸蜡、包埋。取出生后1 d(postnatal day 1,PN1)和出生后5 d(PN5)的小鼠头部,4%多聚甲醛4℃固定24 h,15% EDTA脱钙1周,脱水、浸蜡、包埋。
1.4 HE染色制备E13.5、E14.5、E16.5、E18.5、PN1和PN5小鼠下颌第一磨牙牙胚连续切片,常规HE染色,光镜下观察小鼠牙胚蕾状期(E13.5)、帽状期(E14.5)、钟状早晚期(E16.5和E18.5)组织形态表现以及PN1和PN5小鼠牙冠发育情况。
1.5 免疫组织化学染色切片烤片1 h后,常温下脱蜡至水,PBS冲洗3 min×3次,EDTA(pH9.0)修复液微波修复,PBS冲洗3 min×3次,滴加3% H2O2 30 min,PBS冲洗3 min×3次;羊血清封闭30 min后加一抗,分别为兔抗鼠CDC42单克隆抗体和PAR3多克隆抗体,4℃过夜;PBS冲洗5 min×3次;滴加羊抗兔生物素标记二抗(北京中杉)10 min,PBS冲洗5 min×3次;滴加辣根过氧化物酶标记的链霉素抗生物素工作液,常温20 min,PBS冲洗5 min×3次;滴加新鲜配置的DAB显色液镜下显色,终止后苏木素复染,树胶封片。镜下观察并拍照。空白对照以PBS代替一抗。
2 结果 2.1 不同时间小鼠胚胎图像体式显微镜下不同时间小鼠胚胎图像见图 1(插页二)。

|
| A:E13.5;B:E14.5;C:E16.5;D:E18.5 图 1 体式显微镜下小鼠胚胎图像 Figure 1 Photos of mouse embryos under stereomicroscope |
|
|
E13.5是小鼠牙胚发育的蕾状期。HE染色:牙板上皮向间充质处延伸,形成上皮芽,形状类似于花蕾,是成釉器的始基。在上皮芽周围外胚间充质处细胞增生,包绕着上皮芽(图 2A和B,见插页二)。免疫组织化学染色:CDC42在口腔上皮与外胚间充质处均有较为广泛的表达,在上皮芽及其周围的外胚间充质处表达较多(图 2C,见插页二)。PAR3在上皮芽及其周围外胚间充质处有少量表达(图 2D,见插页二)。
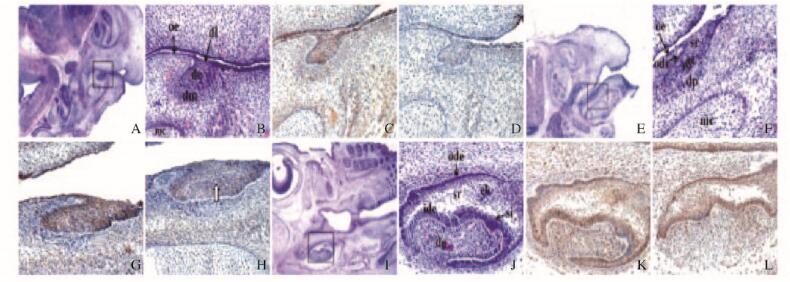
|
| A-D:E13.5;E-H:E14.5;I-L:E16.5;A, E, I: HE, ×40;B, F, J:HE, ×200;C, G, K:CD42-IHC, ×200;D, H, L: PAR3-IHC, ×200. (de: Dental epithelium; dl: Dental lamina; dm:Dental mesenchyme; dp: Dental papilla; ek: Enamel knot; Ide, :inner dental epithelium; ode: Outer dental epithelium; oe: Oral epithelium; si:Stratum intermedium; sr:Stellate reticulum.) 图 2 小鼠牙发育蕾状期、帽状期和钟状早期牙胚HE染色及CDC42和PAR3免疫组织化学染色结果 Figure 2 Results of HE staining of mouse dental germ at bud stage, cap stage and early bell stage of tooth development and immunohistochemical staining of CDC42 and PAR3 |
|
|
E14.5是小鼠牙胚发育的帽状期。HE染色:牙蕾向外胚间充质处生长,周围外胚间充质细胞密度增加,此时出现细胞的分化,成釉器分化为3层细胞,包括外釉上皮、内釉上皮和星网状层(图 2E和F,见插页二)。免疫组织化学染色:CDC42于口腔黏膜上皮、外釉上皮、内釉上皮、星网状层细胞的胞浆及外胚间充质均有表达(图 2G,见插页二)。PAR3在口腔黏膜上皮和外胚间充质均有表达,在成釉器的外釉上皮、内釉上皮及星网状层的胞浆有少量表达(图 2H,见插页二)。
E16.5是小鼠牙发育的钟状早期。HE染色:成釉器体积进一步变大,成釉器进入成熟期,分化为4层,分别为外釉上皮层、内釉上皮层、中间层和星网状层。内釉上皮与外釉上皮在颈环处增生,向间充质处嵌入性增长,在未来牙尖顶部还可见釉结(图 2I和J,见插页二)。免疫组织化学染色:CDC42在外釉上皮与内釉上皮胞浆处高表达,星网状层和牙乳头细胞胞浆也有表达(图 2K,见插页二)。PAR3在外釉上皮、内釉上皮、牙乳头和星网状层细胞胞浆处有表达(图 2L,见插页二)。
2.3 钟状晚期小鼠牙胚组织形态表现及CDC42和PAR3的表达E18.5是小鼠牙发育的钟状晚期。HE染色:内釉上皮细胞向前成釉细胞分化(图 3A和B,见插页二)。免疫组织化学染色:CDC42在内釉上皮细胞胞浆中表达强于其在牙乳头细胞的表达(图 3C和D,见插页二)。PAR3表达于内釉上皮与牙乳头细胞胞浆,并且PAR3在内釉上皮中的表达强于牙乳头(图 3E和F,见插页二)。
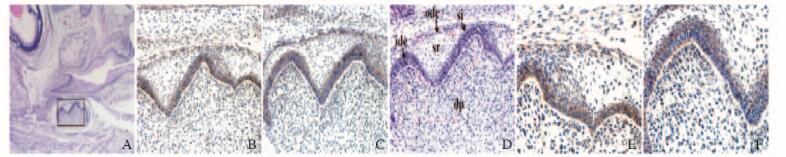
|
| A:HE, ×40;B:HE, ×200;C:CDC42-IHC, ×200;D:CDC42-IHC, ×400, E:PAR3-IHC, ×200;F:PAR3-IHC, ×400. (ide: Inner dental epithelium; ode: Outer dental epithelium; si: Stratum intermedium; sr:Stellate reticulum; dp: Dental papilla) 图 3 小鼠牙发育钟状晚期牙胚HE染色及CDC42和PAR3免疫组织化学染色结果 Figure 3 Results of HE staining of mouse dental germ at late bell stage of tooth development and results of immunohistochemical staining of CDC42 and PAR3 |
|
|
PN1仍处于小鼠牙发育钟状晚期。HE染色:分化的成釉细胞与成牙本质细胞,成牙本质细胞与成釉细胞为高柱状,呈栅栏状紧密排列,此时有前期牙本质形成(图 4A和B,见插页二)。免疫组织化学染色:CDC42表达于成牙本质细胞及成釉细胞的分泌端,在牙乳头处的表达较成牙本质细胞处减少(图 4C和D,见插页二)。PAR3在成釉细胞和成牙本质细胞分泌端表达较高,在星网状层以及牙乳头细胞胞浆中也有少量表达(图 4E和F,见插页二)。

|
| A:HE, ×40;B:HE, ×200;C:CDC42-IHC, ×200;D:CDC42-IHC, ×400;E:PAR3-IHC, ×200;F:PAR3-IHC, ×400. (am: Ameloblast; dp: Dental papilla; od: Odontoblast; pd:Pre-dentin; sr: Stellate reticulum) 图 4 PN1小鼠牙胚HE染色及CDC42和PAR3免疫组织化学染色结果 Figure 4 Results of HE staining of mouse dental germ at PN1 and results of immunohistochemical staining of CDC42 and PAR3 |
|
|
PN5时,HE染色:小鼠上皮根鞘开始向根方延伸,已有釉质和牙本质形成,成釉细胞和成牙本质细胞呈高柱状紧密排列(图 5A和B,见插页三)。免疫组织化学染色:CDC42在成釉细胞和成牙本质细胞分泌端表达较高(图 5C和D,见插页三),PAR3在成牙本质细胞和成釉细胞分泌端表达较弱(图 5E和F,见插页三)。
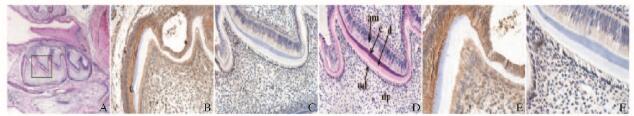
|
| A:HE, ×40;B:HE, ×200;C:CDC42-IHC, ×200;D:CDC42-IHC, ×400;E:PAR3-IHC, ×200;F:PAR3-IHC, ×400. (am:Ameloblast; d: Dentine; dp: Dental papilla; e: Enamel; od: Odontoblast) 图 5 PN5小鼠牙胚HE染色及CDC42和PAR3免疫组织化学染色结果 Figure 5 Results of HE staining of mouse dental germ at PN5 and results of immunohistochemical staining of CDC42 and PAR3 |
|
|
本研究结果显示:CDC42在小鼠牙胚发育的整个过程均有表达,同时在小鼠口腔黏膜上皮与周围的外胚间充质等处均有不同程度的表达,该结果与张文菲等[10]研究结果基本一致。牙发育起始阶段中重要的细胞生物学行为之一是细胞的增殖[11]。CDC42通过其下游分子鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factors,GEFT)诱导细胞的增殖[12]。CDC42表达于蕾状期、帽状期和钟状早期牙胚且在以上各期上皮处表达量较间充质处高,其可能参与了早期牙发育过程中上皮细胞向间充质处的增殖和迁移。研究[13]表明:CDC42参与了上皮细胞黏附连接与紧密连接的形成。在钟状晚期,前成釉细胞排列紧密,内釉上皮向前成釉细胞分化,CDC42表达于内釉上皮细胞的胞浆,并且CDC42于此期的表达弱于钟状早期牙胚表达,推测CDC42可能主要参与了钟状晚期牙胚内釉细胞连接的形成,此期上皮细胞的增殖迁移减弱。CDC42表达于PN1和PN5小鼠牙胚的呈高柱状极化形态的成牙本质细胞、成釉细胞分泌端,并且其表达强于E18.5小鼠。细胞极性的建立包括细胞连接的建立与极性复合物的形成[14],出生后小鼠成牙本质细胞和成釉细胞分泌端有紧密连接相关蛋白定位[15], CDC42还参与极性复合物的形成[13],CDC42作为极性相关蛋白于此期表达增强,表明其可能对成牙本质细胞和成釉细胞极性建立有重要作用。
极性分子PAR活化会引起一系列细胞效应,如迁移细胞头尾轴的形成、细胞的不对称分裂以及上皮细胞顶底极性的建立等。本研究结果显示:PAR3参与小鼠牙胚发育的整个过程。在牙胚发育蕾状期,上皮芽增殖能力较强尚未出现细胞分化[16],PAR3在上皮芽处表达较低;在帽状期与钟状早期,PAR3在成釉器的外釉上皮以及内釉上皮处表达较蕾状期高。在钟状晚期,PAR3在前成釉细胞表达但其表达明显弱于其在钟状晚期时的表达,此时细胞呈高柱状排列紧密,由于PAR3还参与极性复合物的形成[5]和细胞连接的建立[6]。本文作者推测:PAR3在此期的表达可能参与了前成釉细胞细胞连接的建立及其极性复合物的形成。PN5小鼠牙胚成牙本质细胞和成釉细胞分泌端PAR3表达与出生后PN1其表达量接近,细胞顶端连接复合体定位于此,PAR3对成牙本质细胞和成釉细胞极性的建立可能发挥重要作用。
综上所述,细胞极性相关分子CDC42和PAR3表达于小鼠牙胚发育的整个过程。在牙胚发育的早期阶段,CDC42和PAR3可能参与了细胞的增殖;在牙胚发育的晚期阶段,从前成釉细胞开始到成釉细胞和成牙本质细胞极性形成,CDC42与PAR3可能参与了成牙本质细胞和成釉细胞的极性建立。但关于CDC42与PAR3在牙胚发育过程中增殖和细胞极性形成中的具体作用及其分子机制仍需进一步研究。
| [1] | Tjäderhane L, Koivumäki S, Pääkkönen V, et al. Polarity of mature human odontoblasts[J]. JDent Res, 2013, 92(11): 1011–1016. DOI:10.1177/0022034513504783 |
| [2] | David G, Drubin W, Nelson J. Origins of cell polarity[J]. Cell, 1996, 84(3): 335–344. DOI:10.1016/S0092-8674(00)81278-7 |
| [3] | Coopman P, Djiane A. Adherens junction and E-cadherin complex regulation by epithelial polarity[J]. Cell Mol Life Sci, 2016, 73(18): 3535–3553. DOI:10.1007/s00018-016-2260-8 |
| [4] | Selamat W, Tay P-LF, Baskaran Y, et al. The Cdc42 effector kinase PAK4 localizes to cell-cell junctions and contributes to establishing cell polarity[J]. PLoS One, 2015, 10(6): 129–134. |
| [5] | Bertha C, Amrita D, Diptiben V, et al. Cdc42 regulates epithelial cell polarity and cytoskeletal function during kidney tubule development[J]. Cell Sci, 2015, 128(23): 4293–4305. DOI:10.1242/jcs.164509 |
| [6] | Weng M, Wieschaus E. Polarity protein Par3/Bazooka follows myosin-dependent junction repositioning[J]. Dev Biol, 2017, 422(2): 125–134. DOI:10.1016/j.ydbio.2017.01.001 |
| [7] | Mazel T. Crosstalk of cell polarity signaling pathways[J]. Proto Plasma, 2017, 254(3): 1241–1258. |
| [8] | Etienne-Manneville S. Cdc42-the centre of polarity[J]. J Cell Sci., 2004, 117(Pt8): 1291–1300. |
| [9] | Han Z, Motegi F. Reconstitution of self-organizing PAR polarity circuits[J]. Mech Dev, 2017, 145: 58. |
| [10] | 张文菲, 李明伟, 赵泽, 等. Cdc42在小鼠磨牙牙胚发育过程中的表达[J]. 牙体牙髓牙周病学杂志, 2016, 26(10): 598–601, 638. |
| [11] | Miletich I, Sharpe PT. Normal and abnormal dental development[J]. Hum Mol Genet, 2003, 12(1): 69–73. |
| [12] | Guo X, Stafford LJ, Bryan B, et al. A Rac/Cdc42-specific exchange fac tor, GEFT, induces cell proliferation, transformation, and migration[J]. JBiol Chem, 2003, 278(15): 13207–13215. DOI:10.1074/jbc.M208896200 |
| [13] | Etienne-Manneville S, Hall A. Rho GTPases in cell biology[J]. Nature, 2002, 420(6916): 629–635. DOI:10.1038/nature01148 |
| [14] | 李明伟. 成牙本质细胞极性相关蛋白cdc42和E-cadherin的表达及功能[D]. 西安: 第四军医大学, 2014. |
| [15] | João SM, Arana-Chavez VE. Tight junctions in differentiating ameloblasts and odontoblasts differentially express ZO-1, occludin, and claudin-1 in early odontogenesis of rat molars[J]. Anat Rec A Discov Mol Cell Evol Biol, 2004, 277(2): 338–343. |
| [16] | Miletich I, Sharpe PT. Normal and abnormal dental development[J]. Hum Mol Genet, 2003, 12(1): R69–R73. |
 2018, Vol. 44
2018, Vol. 44


