扩展功能
文章信息
- 毕然, 杜玉君, 魏伟, 王春喜
- BI Ran, DU Yujun, WEI Wei, WANG Chunxi
- 穿心莲内酯对人肾细胞癌786-0细胞增殖、迁移和凋亡的影响
- Effects of andrographolide in proliferation, migration and apoptosis of renal cell carcinoma 786-0 cells
- 吉林大学学报(医学版), 2018, 44(01): 18-23
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 18-23
- 10.13481/j.1671-587x.20180104
-
文章历史
- 收稿日期: 2017-09-11
2. 吉林大学第一医院肾内科, 吉林 长春 130021;
3. 吉林大学第一医院转化医学研究院艾滋病与病毒研究所, 吉林 长春 130021
2. Department of Nephrology, First Hospital, Jilin University, Changchun 130021, China;
3. Institute of AIDS and Virology, Institute of Translational Medicine, First Hospital, Jilin University, Changchun 130021, China
穿心莲内酯(andrographolide,Andro)是从穿心莲植物中提取的一种二萜二酯类化合物,分子式为C20H30O。在传统中药中,穿心莲因具有清热、抗炎[1]和抗病毒[2]作用,被用于治疗感冒、发烧、咳嗽、喉炎及一些感染性疾病。因穿心莲在人体内的半衰期短,可以迅速地排出体外,对正常人体细胞的毒害性小,成为国家食品药品监督管理总局承认且推广的中草药之一[3]。随着Andro的广泛应用,其抗癌的活性也逐渐被研究者发现。国内外学者[4-9]发现:Andro对胃癌、胰腺癌、肝癌、宫颈癌、肺癌、前列腺癌和神经胶质瘤等具有抗癌活性,但Andro对肾细胞癌(renal cell carcinoma, RCC)的作用却一直未见报道。本文作者将Andro作用于RCC细胞,观察其对RCC细胞的增殖、迁移和克隆形成能力的影响,探讨其诱导RCC细胞发生DNA损伤和程序性凋亡的作用,阐明其作为新的抗RCC药物的潜在可能性。
1 材料与方法 1.1 细胞和主要试剂人RCC786-0细胞(中国科学院上海细胞库)。RPMI-1640培养基(美国HyClone公司),胎牛血清(美国BI公司),Andro(美国MCE公司),MTS试剂盒(美国Promega公司),Annexin Ⅴ-FITC细胞凋亡检测试剂盒(中国凯基生物公司),Anti-γ-H2AX抗体和Anti-Caspase-8抗体(美国Cell Signaling Technology公司),Anti-β-actin抗体(美国Abcam公司),鼠二抗和兔二抗(美国Jackson Immuno Research Laboratories公司)。酶标仪(美国Bio-TEK公司),流式细胞分析仪(美国BD公司)。
1.2 细胞培养786-0细胞用含体积分数为10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基,置于恒温培养箱中培养(37℃、5%CO2)。细胞融合达80%~90%时,用0.25%胰蛋白酶消化传代。取生长状态良好的对数生长期细胞进行实验。
1.3 MTS法检测RCC786-0细胞增殖率将处于对数生长期的786-0细胞以5×103个/孔接种在96孔板中,细胞贴壁24 h后,加入浓度分别为0(空白对照组)、5、10、20、40和80 μmol·L-1 Andro,每组2个复孔,共同培养48 h后,每孔加入20 μL MTS液,在37℃避光孵育3 h,使用酶标仪在490 nm处测量各孔吸光度(A)值。细胞增殖率=实验组A值/对照组A值×100%。
1.4 平板克隆实验检测RCC 786-0细胞克隆形成率将处于对数生长期的786-0细胞以2×102个/孔接种在6孔板中,细胞贴壁24 h后,加入浓度分别为0(空白对照组)、0.50、1.25和2.50 μmol·L-1 Andro,共同培养1~2周,待出现肉眼可见细胞群落时终止培养,4%多聚甲醛固定细胞20 min,0.1%结晶紫染色细胞15 min,流水冲洗细胞染色液,自然风干后低倍镜下计数大于50个细胞的群落,计数3次取平均值。克隆形成率=(形成克隆数/接种细胞数)×100%。
1.5 划痕实验检测RCC 786-0细胞迁移能力将处于对数生长期的786-0细胞以1×105个/孔接种在6孔板中,当细胞密度为90%时,换成无血清培养基,排除对细胞增殖的影响。用10 μL枪头均匀划3条线,然后用PBS洗涤2次,去除划下细胞,加入浓度分别为0(空白对照组)、10、20和40 μmol·L-1 Andro,共同培养,于0和24 h在显微镜下拍照(×100)。细胞迁移能力以划痕愈合率表示。划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.6 流式细胞术检测RCC786-0细胞凋亡率将处于对数生长期的786-0细胞以1×105个/孔接种在6孔板中,细胞贴壁24 h后,加入浓度分别为0(空白对照组)、10、20和40 μmol·L-1 Andro,共同培养48 h后,用0.25%以蛋白酶消化细胞,用冷PBS洗涤细胞2次,用1×Binding Buffer 500 μL重悬细胞,加入5 μL Annexin Ⅴ-FITC混匀,再加入5 μL碘化丙啶混匀,室温避光孵育15 min。采用流式细胞仪检测细胞的凋亡率。凋亡率=细胞早期凋亡率(%)+晚期凋亡率(%)。
1.7 Western blotting法检测凋亡相关蛋白表达水平将处于对数生长期的786-0细胞以1×105个/孔接种在6孔板中,细胞贴壁24 h后,加入浓度分别为0(空白对照组)、10、20和40 μmol·L-1 Andro,共同培养48 h后,收集细胞,制备蛋白样品。用SDS-PAGE电泳进行检测,电泳条件为120V恒压120 min。将跑完电泳的SDS-PAGE凝胶取出,用半干转膜仪进行转膜,转膜条件为20V、20 min。转膜完成后将NC膜放入含有5%奶粉的TBST溶液中封闭20 min。加入一抗,置于4℃摇床过夜。用TBST洗膜3次,再用TBS洗膜1次,每次10 min。加入种属对应的二抗,在室温下孵育1 h。洗膜后将NC膜置于配置好的碱性磷酸酶显色液中,避光显色5~15 min,显色结束后晾干NC膜,放入扫描仪中扫描。采用Image J软件进行灰度值分析。按照下列公式计算蛋白表达水平:蛋白表达水平=每个样本条带灰度值/β-actin灰度值。
1.8 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组细胞增殖率、克隆形成率、划痕愈合率、细胞凋亡率及凋亡相关蛋白表达水平均以x±s表示,2组间比较采用两独立样本t检验,多组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组RCC786-0细胞增殖率不同剂量Andro作用48 h后,与空白对照组比较,5 μmol·L-1 Andro组细胞增殖率虽有降低趋势,但差异无统计学意义(P>0.05);10、20、40和80 μmol·L-1 Andro组细胞增殖率明显降低(P < 0.05或P < 0.01),且随着Andro浓度的增加,细胞增殖率逐渐降低。见表 1。
| (n=3, x±s,η/%) | |
| Group | Proliferation rate |
| Blank control | 100.00±3.63 |
| Andro(μmol·L-1) | |
| 5 | 93.23±2.70 |
| 10 | 86.97±5.22* |
| 20 | 75.19±2.85** |
| 40 | 54.21±2.36** |
| 80 | 25.18±3.11** |
| * P < 0.05,* * P < 0.01 compared with blank control group. | |
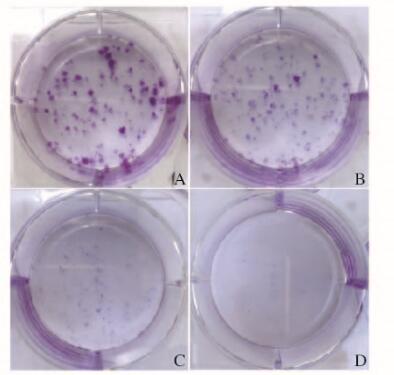
不同剂量Andro作用10 d后,肉眼观察,与空白对照组比较,当浓度为1.25 μmol·L-1时,可以明显抑制RCC细胞形成克隆,当浓度为2.50 μmol·L-1时,几乎无肾癌细胞形成克隆。见图 1(插页一)。通过显微镜观察计数并计算克隆形成率。与空白对照组(47.33%±1.02%)比较,0.50 μmol·L-1 Andro组细胞克隆形成率(41.50%±1.47%)降低(P < 0.05),1.25 μmol·L-1 Andro组细胞克隆形成率(7.33%±1.24%)明显降低(P < 0.01),且随着Andro浓度的增加,细胞克隆形成率逐渐降低。
|
| A:Blank control group; B-D:0.50, 1.25 and 2.50 μmol·L-1 Andro groups. 图 1 各组肾癌786-0细胞克隆形成图片 Figure 1 Pictures of colony formation of RCC 786-0 cells in various groups |
|
|
不同剂量Andro作用24 h后,各组细胞划痕愈合情况见图 2(插页一)。与空白对照组比较,不同浓度Andro组划痕愈合率均明显降低(P < 0.01),且随着浓度升高,细胞划痕愈合率逐渐降低。见表 2。

|
| A-D:0 h; E-H:24 h; A, E:Blank control group; B, F:10μmol·L-1Andro group; C, G:20 μmol·L-1Andro group; D, H:40 μmol·L-1 Andro group. 图 2 各组肾癌786-0细胞划痕实验(×100) Figure 2 Scratch test of RCC 786-0 cells in various groups(×100) |
|
|
| (n=3, x±s,η/%) | |
| Group | Scratch healing rate |
| Blank control | 78.06±0.91 |
| Andro(μmol·L-1) | |
| 10 | 70.03±1.22* |
| 20 | 61.40±1.87* |
| 40 | 48.43±1.06* |
| * P < 0.01 compared with blank control group. A:Blank control group;B-D:10,20, and 40 μmol·L-1 Andro groups. | |
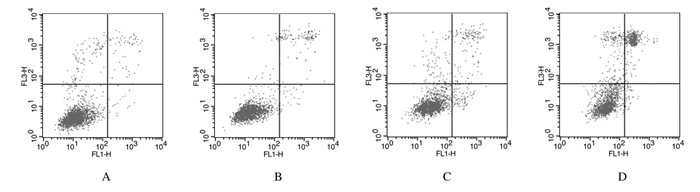
作用48 h后,与空白对照组(3.13%±0.36%)比较,20和40 μmol·L-1 Andro组的细胞凋亡率(10.61%±0.43%和23.12%±0.77%)明显升高(P < 0.01)。见图 3。
|
| A:Blank control group; B-D:10, 20, and 40 μmol·L-1 Andro groups. 图 3 流式细胞术检测各组RCC786-0细胞凋亡率 Figure 3 Apoptotic rates of RCC 786-0 cells in various groups detected by flow cytometry |
|
|
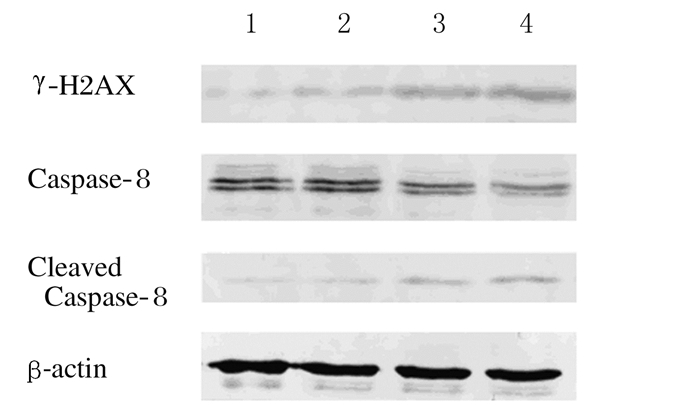
γ-H2AX可以反映DNA损伤程度,随着Andro浓度的升高,γ-H2AX蛋白表达水平逐渐升高,与空白对照组(0.185±0.004)比较,10和20 μmol·L-1Andro组细胞中γ-H2AX蛋白表达水平有升高趋势,但差异无统计学意义(P>0.05)。40 μmol·L-1 Andro组细胞中γ-H2AX蛋白表达水平(0.369±0.004)明显升高(P < 0.01)。Caspase-8的活化标志着程序性凋亡的开始,Caspase-8通过自我剪切活化,随着Andro浓度的升高,Caspase-8蛋白表达逐渐降低,而Caspase-8蛋白剪切体逐渐增多。与空白对照组Caspase-8蛋白表达水平(0.612±0.021)和Caspase-8蛋白剪切体表达水平(0.156±0.007)比较,10和20 μmol·L-1Andro组Caspase-8和Caspase-8剪切体表达水平有升高趋势,但差异无统计学意义(P>0.05);40 μmol·L-1 Andro组Caspase-8蛋白表达水平(0.391±0.025)明显降低(P < 0.05),而Caspase-8剪切体表达水平(0.238±0.001)明显升高(P < 0.01)。见图 4。
|
| Lane 1:Blank control group; Lane 2-4:10, 20, and 40 μmol·L-1 Andro groups. 图 4 各组RCC786-0细胞凋亡相关蛋白表达电泳图 Figure 4 Electrophoregram of expressions of apoptosis-related proteins in RCC 786-0 cells in various groups |
|
|
RCC是常见的恶性肿瘤之一,占成人恶性肿瘤的2%~3%,全世界每年新增患者超30万例[10]。RCC是起源于肾小管上皮系统的恶性肿瘤,表现为高度血管化和转移特征。目前,外科手术治疗仍然是局限性肾癌首选的治疗方法,但对于不可切除或转移的晚期RCC患者,治疗的选择是有限的。RCC对于传统放疗和化疗不敏感,免疫治疗包括干扰素α和白细胞介素2(IL-2)等益处也有限[11]。分子靶向药物可以明显延长患者的生存期,但分子靶向药物的不良反应(手足皮肤反应、乏力、白细胞减少、高血压、贫血和口舌炎等)严重,部分患者因此终止治疗[12-14]。因此,本研究致力于寻找在有效地控制肿瘤基础上减少不良反应的新的安全的治疗药物。
本研究结果显示:在体外,Andro可以有效地抑制RCC细胞增殖、迁移和克隆形成,并且随着Andro应用剂量的提高,对RCC细胞的抑制作用逐渐增强,与Dai等[15]报道的Andro对胃癌SGC7901细胞抑制作用相似。本研究还显示:Andro可以诱导RCC细胞发生程序性凋亡,使其在抑制RCC细胞生长的基础上更能有效地杀伤肾癌细胞,为RCC治疗的选择提供了新的可能。但本研究局限于细胞实验水平,未能进行动物实验,还有待进一步研究。
本研究同时对Andro诱导RCC细胞发生程序性凋亡的机制进行了研究。在细胞程序性凋亡途径中,Caspase-8通过自我剪切进行活化,活化的Caspase-8通过外源性途径或线粒体介导的内在凋亡途径诱导细胞凋亡。在外源性途径中,活化的Caspase-8直接激活效应Caspases(Caspase-3/7),诱导细胞程序性凋亡[16]。在线粒体介导的内在凋亡途径中,活化的Caspase-8将结构域死亡激动剂(Bid)切割为截断的Bid(tBid),tBid运输到线粒体,激活BAX和BAK,进而诱导线粒体释放前凋亡因子(如细胞色素c、SMAC)到细胞质中。细胞色素c、凋亡酶激活因子(APAF-1)和pro-Caspase-9在细胞质中组成凋亡小体,激活Caspase-9,进一步激活Caspase-3/7,诱导细胞凋亡[17-18]。在本研究中,随着Andro浓度的升高,活化的Caspase-8表达增多,说明Andro可以激活Caspase-8介导的凋亡信号途径。Dai等[15]发现:在应用Andro后胃癌细胞BAX蛋白表达水平升高,与本研究相符。因此,Andro对RCC细胞的杀伤作用可能是由于激活了Caspase-8介导的外源性凋亡途径或线粒体介导的内在凋亡途径。
本研究结果显示:在应用Andro后,RCC细胞中γ-H2AX蛋白表达水平升高。γ-H2AX识别抗体是近年来发展起的一种检测DNA双链断裂(DNA double-strand breaks, DSBs)的方法,DSBs是DNA损伤中最严重的形式,若未能修复可致细胞死亡,γ-H2AX作为一种生物标志物可以清楚地反映DNA损伤程度[19]。研究[20-22]显示:JNK/H2AX信号途径参与细胞凋亡的调节,并与Caspase-8凋亡信号途径产生协同作用,因此Andro可能通过诱导DNA损伤和诱导JNK/H2AX介导的细胞凋亡途径杀伤肾癌细胞。
综上所述,Andro在抑制RCC细胞生长的基础上还能诱导DNA损伤和细胞程序性凋亡,成为潜在的抗RCC药物。
| [1] | Shen YC, Chen CF, Chiou WF. Andrographolide prevents oxygen radical production by human neutrophils:possible mechanism(s) involved in its anti-inflammatory effect[J]. Br J Pharmacol, 2002, 135(2): 399–406. DOI:10.1038/sj.bjp.0704493 |
| [2] | Lee JC, Tseng CK, Young KC, et al. Andrographolide exerts anti-hepatitis C virus activity by up-regulating haeme oxygenase-1 via the p38 MAPK/Nrf2 pathway in human hepatoma cells[J]. Br J Pharmacol, 2014, 171(1): 237–252. DOI:10.1111/bph.2014.171.issue-1 |
| [3] | Jaruchotikamol A, Jarukamjorn K, Sirisangtrakul W, et al. Strong synergistic induction of CYP1A1 expression by andrographolide plus typical CYP1A inducers in mouse hepatocytes[J]. Toxicol Appl Pharmacol, 2007, 224(2): 156–162. DOI:10.1016/j.taap.2007.07.008 |
| [4] | Li SG, Wang YY, Ye ZY, et al. Proliferative and apoptotic effects of andrographolide on the BGC-823 human gastric cancer cell line[J]. Chin Med J, 2013, 126(19): 3739–3744. |
| [5] | Bao GQ, Shen BY, Pan CP, et al. Andrographolide causes apoptosis via inactivation of STAT3 and Akt and potentiates antitumor activity of gemcitabine in pancreatic cancer[J]. Toxicol Lett, 2013, 222(1): 23–35. DOI:10.1016/j.toxlet.2013.06.241 |
| [6] | Zhou J, Lu GD, Ong CS, et al. Andrographolide sensitizes cancer cells to TRAIL-induced apoptosis via p53-mediated death receptor 4 up-regulation[J]. Mol Cancer Ther, 2008, 7(7): 2170–2180. DOI:10.1158/1535-7163.MCT-08-0071 |
| [7] | Yuan H, Sun B, Gao F, et al. Synergistic anticancer effects of andrographolide and paclitaxel against A549 NSCLC cells[J]. Pharm Biol, 2016, 54(11): 2629–2635. DOI:10.1080/13880209.2016.1176056 |
| [8] | Mir H, Kapur N, Singh R, et al. Andrographolide inhibits prostate cancer by targeting cell cycle regulators, CXCR3 and CXCR7 chemokine receptors[J]. Cell Cycle, 2016, 15(6): 819–826. DOI:10.1080/15384101.2016.1148836 |
| [9] | 章倩倩, 丁一, 亓翠玲, 等. 穿心莲内酯对胶质瘤U87细胞增殖的抑制作用及其机制[J]. 吉林大学学报:医学版, 2013, 39(4): 676–679. |
| [10] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–E386. DOI:10.1002/ijc.29210 |
| [11] | Coppin C, Porzsolt F, Autenrieth M, et al. WITHDRAWN:Immunotherapy for advanced renal cell cancer[J]. Cochrane Database Syst Rev, 2015(12): CD001425. |
| [12] | Escudier B, Eisen T, Stadler WM, et al. Sorafenib in advanced clear-cell renal-cell carcinoma[J]. N Engl J Med, 2007, 356(2): 125–134. DOI:10.1056/NEJMoa060655 |
| [13] | Escudier B, Eisen T, Stadler WM, et al. Sorafenib for treatment of renal cell carcinoma:Final efficacy and safety results of the phase Ⅲ treatment approaches in renal cancer global evaluation trial[J]. J Clin Oncol, 2009, 27(20): 3312–3318. DOI:10.1200/JCO.2008.19.5511 |
| [14] | Rini BI, Wilding G, Hudes G, et al. Phase Ⅱ study of axitinib in sorafenib-refractory metastatic renal cell carcinoma[J]. J Clin Oncol, 2009, 27(27): 4462–4468. DOI:10.1200/JCO.2008.21.7034 |
| [15] | Dai L, Wang G, Pan W. Andrographolide inhibits proliferation and metastasis of SGC7901 gastric cancer cells[J]. Biomed Res Int, 2017, 2017: 6242103. |
| [16] | Dai X, Zhang J, Arfuso F, et al. Targeting TNF-related apoptosis-inducing ligand (TRAIL) receptor by natural products as a potential therapeutic approach for cancer therapy[J]. Exp Biol Med (Maywood), 2015, 240(6): 760–773. DOI:10.1177/1535370215579167 |
| [17] | Amarante-Mendes GP, Griffith TS. Therapeutic applications of TRAIL receptor agonists in cancer and beyond[J]. Pharmacol Ther, 2015, 155: 117–131. DOI:10.1016/j.pharmthera.2015.09.001 |
| [18] | Elmallah MI, Micheau O. Marine drugs regulating apoptosis induced by tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)[J]. Mar Drugs, 2015, 13(11): 6884–6909. |
| [19] | 刘敏, 赵苒. γH2AX检测在DNA双链断裂研究中应用[J]. 中国公共卫生, 2015, 31(6): 742–746. DOI:10.11847/zgggws2015-31-06-14 |
| [20] | Lu C, Zhu F, Cho YY, et al. Cell apoptosis:Requirement of H2AX in DNA ladder formation, but not for the activation of Caspase-3[J]. Mol Cell, 2006, 23(1): 121–132. DOI:10.1016/j.molcel.2006.05.023 |
| [21] | 潘伟康, 余辉, 王怀杰, 等. 肾母细胞瘤中ERCC1、TUBB3、TOP2A mRNA的表达及临床意义[J]. 西安交通大学学报:医学版, 2016, 37(5): 689–692. |
| [22] | 梁亮, 张寅斌, 张扬, 等. miR-21在肾透明细胞癌中的表达及对增殖和凋亡的影响[J]. 西安交通大学学报:医学版, 2017, 38(6): 826–832. |
 2018, Vol. 44
2018, Vol. 44


