扩展功能
文章信息
- 许哲男, 商圣涛, 陆毓峰, 张吉, 陈冲, 陈悦, 赵维
- XU Zhenan, SHANG Shengtao, LU Yufeng, ZHANG Ji, CHEN Chong, CHEN Yue, ZHAO Wei
- 双侧胸腔镜手术治疗侵袭性胸腺瘤并发重症肌无力1例报告及文献复习
- Bilateral thoracoscopic surgery for invasive thymoma complicated with myasthenia gravis: A case report and literature review
- 吉林大学学报(医学版), 2018, 44(01): 179-181
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 179-181
- 10.13481/j.1671-587x.20180135
-
文章历史
- 收稿日期: 2017-06-08
侵袭性胸腺瘤亦称恶性胸腺瘤,呈浸润性生长,并可以发生邻近及远处器官转移。恶性胸腺瘤易并发重症肌无力,常见临床症状为视力模糊、构音困难和咀嚼无力,甚至会出现肌无力危象等,严重威胁患者的健康及生活。外科手术是治疗侵袭性胸腺瘤最佳治疗手段,术中应最大可能切除胸腺瘤及周围脂肪组织,缓解肌无力症状及减少术后肿瘤复发。传统开放手术创伤大,并发症多,给患者带来极大的痛苦。单侧胸腔镜手术不能充分清扫对侧脂肪组织,尤其在治疗侵袭性胸腺瘤时很难达到根治效果。作为一项新开展的治疗方法,本文作者采用双侧胸腔镜下胸腺扩大切除术治疗1例胸腺瘤并发重症肌无力患者,安全可行,疗效满意,现将患者的临床诊治情况报道如下。
1 临床资料 1.1 一般资料患者,女性,52岁。该患无明显诱因出现双眼睑下垂伴视力模糊及复视1周,午后加重,无明显全身乏力和吞咽困难。患者为在职教师,肌无力症状严重影响日常生活及工作。患者于2016年10月来本院就诊,行胸部CT提示前下纵隔内可见团块状软组织密度影,边缘尚清楚,可见分叶,大小为37.7 mm×22.7 mm×32.4 mm,CT值为37.0HU,其内可见点状钙化影(图 1A)。结合病史、体征及辅助检查,诊断为“胸腺瘤并发重症肌无力-眼肌型”。患者术前口服溴吡斯的明,30 mg/次,每日4次,共2周,肌无力症状明显缓解并且稳定。
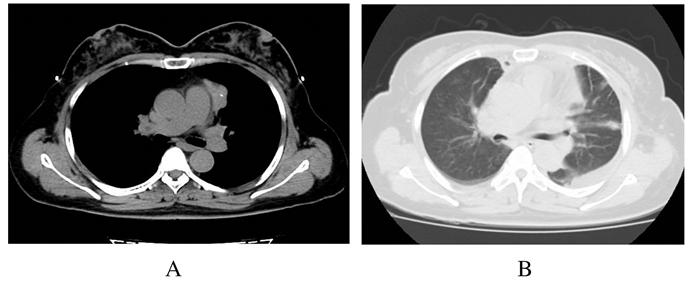
|
| 图 1 侵袭性胸腺瘤并发重症肌无力患者术前(A)和术后(B)胸部CT图像 Figure 1 Chest CT images of a patient with invasive thymoma complicated with myasthenia gravis before (A) and after (B) operation |
|
|
完善术前准备,在全麻下行双侧胸腔镜下胸腺扩大切除术。全麻生效后,患者取右侧卧位,后倾60°。切口选取:左腋中线第7肋间作为观察孔,腋前线第3肋间及锁骨中线第5肋间作为操作孔。镜下探查见:前纵隔及心包前方大量脂肪组织,肿瘤位于前下纵隔及肺动脉干左前方,大小为4.0 cm×3.5 cm×2.0 cm,形态不规整,质硬,呈分叶状,胸腺包膜及邻近脂肪组织被浸润。先从胸腺右下极开始自下向上行锐性加钝性分离,遇到束带或小血管处以超声刀切断。于无名静脉起始部水平膈神经前方找到胸腺静脉若干分支并依次切断。在肺门前方剥离胸腺左下极与心包脂肪,继续游离出胸腺左上极,完整切除整个胸腺瘤及左胸前纵隔脂肪组织,术中完整保留膈神经。考虑到患者有明显肌无力症状,胸腺瘤及单侧脂肪组织切除,可能会遗留对侧迷走胸腺,为了达到切净肿瘤及最大限度降低创伤,故决定行双侧胸腔镜下脂肪组织清扫术。患者翻身取左侧卧位,取同样手术入路,清扫右胸前纵隔脂肪组织,完整切除胸腺瘤及清扫双侧脂肪组织。
1.3 术后效果术后患者自诉轻度切口疼痛,口服非甾体类镇痛药后疼痛缓解。术后第1天、第4天复查胸片及胸部CT(图 1B)显示肺复张良好。术后每日两侧胸腔引流量均少于50 mL,第3天拔出两侧胸腔闭式引流管。术后继续口服溴吡斯的明,30 mg/次,每日4次,术后第5天眼肌症状完全缓解并出院。病理回报:胸腺来源肿瘤,考虑B2型胸腺瘤,细胞生长活跃,多结节性生长,侵及被膜外脂肪组织内。患者术后1个月转入放疗科接受前纵隔放射治疗以控制局部复发,术后随访3个月期间患者恢复良好,肌无力症状未再发生。
2 讨论胸腺瘤为前纵隔最常见的肿瘤,多数患者因出现局部压迫症状及重症肌无力表现而就诊。侵袭性胸腺瘤在罹患胸腺瘤患者中占25%~43%[1],其恶性程度相对其他肺部恶性肿瘤较低,手术效果好,术后生存时间较长,故外科手术切除是治疗侵袭性胸腺瘤的最主要手段。手术可以直接切除肿瘤、减轻肿瘤负荷、消除和缓解重症肌无力等临床症状[2]。
胸腺瘤按包膜是否完整及有无邻近组织受累,按日本Masaoka病理分期[3]可分为:Ⅰ期,无肿瘤包膜浸润;Ⅱ期,肿瘤包膜和脂肪组织浸润;Ⅲ期,心包、肺组织、大血管受侵;Ⅳ期,肿瘤广泛侵犯和转移。通常Ⅱ期以上视为侵袭性胸腺瘤。胸腺瘤患者常因并发重症肌无力而就诊并行手术治疗[4]。重症肌无力患者临床表现为受累骨骼肌无力,易疲劳,经短暂休息或使用新斯的明等抗胆碱酯酶药物治疗后,肌无力症状可有所缓解[5-6]。重症肌无力按临床症状(国际Osserman临床分型[7])可分为:Ⅰ型(单纯眼肌型)、ⅡA型(轻度全身型)、ⅡB(重度全身型)和Ⅲ型(急性暴发型)。
侵袭性胸腺瘤并发重症肌无力时,彻底切除肿瘤及清扫前纵隔脂肪组织被视为手术主要原则[8]。发病早期,将肿瘤完整切除者手术效果好,肿瘤进展至晚期时手术效果不理想,尤其因肿瘤广泛侵犯和转移导致未能切除或行姑息性切除的患者,多在发现后1~2年内死亡。因此术中姑息性切除者或侵袭性胸腺瘤术后应继续行放化疗,延长患者的生存期[9]。侵袭性胸腺瘤手术切除后,大部分患者的重症肌无力症状得到明显改善或缓解,但有的患者术后肌无力症状改善不明显,且随着肿瘤的复发,重症肌无力症状加重或出现肌无力危象而死亡。所以术中应尽量切净肿瘤及邻近被受侵的组织,如胸膜、肺、心包和大血管等,并彻底清扫前纵隔脂肪组织。
传统胸外科手术对于侵袭性胸腺瘤多采用前外侧切口、双侧开胸切口和胸骨正中切开等手术方式。此类术式均在直视下操作,给术者提供良好的术野,可获得较高的手术切除率[10],但手术切口长、创伤大和并发症多,给患者带来极大的痛苦。随着腔镜技术的发展,微创手术逐渐被应用到进展期胸腺瘤治疗,并取得了良好的效果。但是往往因瘤体较大、邻近组织受侵、解剖界限不清楚,并且可能存在对侧迷走胸腺等原因,单侧胸腔镜下切除胸腺瘤往往很难达到根治的效果,常因术后肌无力复发而导致治疗失败。本文作者采用双侧胸腔镜下胸腺扩大切除术,取得了与开放手术同样的治疗效果,并且避免了单侧胸腔镜下不能清扫对侧脂肪组织及遗留迷走胸腺的弊端,达到了根治性切除肿瘤及最大限度降低创伤的最佳治疗效果,与有关文献[11]中提到的“胸腔镜下胸腺瘤切除术的手术时间、术中出血量、住院时间均明显少于开放手术”等报道结果相一致。近年来大量研究结果[12-15]表明:与开放手术比较,胸腔镜治疗胸腺瘤的短期临床效果更好,关于长期生存率的差异尚无明确结论。
本文作者认为:双侧胸腔镜微创手术应用于侵袭性胸腺瘤的治疗,效果肯定,也符合现代外科微创理念,具有创伤小、疼痛轻和恢复快等诸多优点,并且此术式可应用在多种类型的胸腺瘤手术。本例患者为B2型具有中度恶性的侵袭性胸腺瘤,此种情况下如只做单侧脂肪组织的清扫,术后短期内肌无力症状容易再次复发,后续治疗非常棘手,在实际工作中多次遇到过。所以本文作者开展此项新技术,以更好地达到根治侵袭性胸腺瘤的目的,同时为该病患者最大限度降低创伤。但目前存在患者样本量少、随访时间不够长等不足的情况,有待于以后增加样本量及延长随访时间后再进一步研究。
| [1] | Duwe BV, Sterman DH, Musani AI. Tumors of the mediastinum[J]. Chest, 2005, 128(4): 2893–2909. DOI:10.1378/chest.128.4.2893 |
| [2] | Ichimura H, Usui S, Okazaki H, et al. Excision after chemoradiotherapy of invasive thymoma extending into the right atrium:report of a case[J]. Surg Today, 2006, 36(6): 534–537. DOI:10.1007/s00595-006-3188-7 |
| [3] | Suster S, Moran CA. Thymoma classification:current status and future trends[J]. Am J Clin Pathol, 2006, 125(4): 542–554. DOI:10.1309/CAV8RNU5TKNACKNC |
| [4] | LePéchoux C, Mahé M, Bretel JJ, et al. Thymic tumors[J]. Cancer Radiother, 2005, 9(6/7): 351–357. |
| [5] | 邹强, 赵夏, 黄云, 等. 放化疗联合胸腺瘤切除术治疗重症肌无力合并胸腺瘤的临床效果评价[J]. 医学综述, 2016, 22(24): 4989–4992. DOI:10.3969/j.issn.1006-2084.2016.24.057 |
| [6] | 张文军. 胸腔镜与胸骨正中劈开胸腺扩大切除治疗重症肌无力并胸腺瘤的比较[D]. 合肥: 安徽医科大学, 2016. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yike201605034&dbname=CJFD&dbcode=CJFQ |
| [7] | 吕传真. 重症肌无力的临床特征和诊断[J]. 中国实用内科杂志, 1994, 6(14): 325–326. |
| [8] | Sun XG, Wang YL, Liu YH, et al. Myasthenia gravis appearing after thymectomy[J]. J Clin Neurosci, 2011, 18(1): 57–60. DOI:10.1016/j.jocn.2010.05.018 |
| [9] | 钱昆杰, 孙清超, 张海平, 等. 胸腺瘤切除术后发生重症肌无力的危险因素分析[J]. 中国胸心血管外科临床杂志, 2017, 23(1): 20–24. DOI:10.7507/1007-4848.201506036 |
| [10] | Pennathur A, Qureshi I, Schuchert MJ, et al. Comparison of surgical techniques for early-stagethymoma:feasibility of minimally invasive thymectomy and comparison with open resection[J]. J Thorac Cardiovasc Surg, 2011, 141(3): 694–701. DOI:10.1016/j.jtcvs.2010.09.003 |
| [11] | Gu ZT, Mao T, Chen WH, et al. Comparison of video-assisted thoracoscopic surgery and median sternotomy approaches for thymic tumor resections at a single institution[J]. Surg Laparosc Endosc Percutan Tech, 2015, 25(1): 47–51. |
| [12] | Odaka M, Akiba T, Yabe M, et al. Unilateral thoracoscopic subtotal thymectomy for the treatment of stage Ⅰ and Ⅱ thymoma[J]. Eur J Cardiothorac Surg, 2010, 37(4): 824–826. DOI:10.1016/j.ejcts.2009.10.003 |
| [13] | Ng CS, Wan IY, Yim AP. Video-assisted thoracic surgery thymectomy:the better approach[J]. Ann Thorac Surg, 2010, 89(6): S2135–S2141. DOI:10.1016/j.athoracsur.2010.02.112 |
| [14] | Jurado J, Javidfar J, Newmark A, et al. Minimally invasive thymectomy and open thymectomy:outcome analysis of 263 patients[J]. Ann Thorac Surg, 2012, 94(3): 974–981. DOI:10.1016/j.athoracsur.2012.04.097 |
| [15] | Ye B, Tantai JC, Ge XX, et al. Surgical techniques for early-stage thymoma:video-assisted thoracoscopic thymectomy versus transsternal thymectomy[J]. J Thorac Cardiovasc Surg, 2014, 147(5): 1599–1603. DOI:10.1016/j.jtcvs.2013.10.053 |
 2018, Vol. 44
2018, Vol. 44


