扩展功能
文章信息
- 李小霞, 孙艳, 曲荣锋, 任立参, 李亚荣
- LI Xiaoxia, SUN Yan, QU Rongfeng, REN Lishen, LI Yarong
- 原发性乳腺弥漫大B细胞性淋巴瘤3例报告及文献复习
- Primary breast diffuse large B-cell lymphoma: A report of 3 cases and literature review
- 吉林大学学报(医学版), 2018, 44(01): 166-169
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 166-169
- 10.13481/j.1671-587x.20180132
-
文章历史
- 收稿日期: 2017-06-09
原发性乳腺淋巴瘤(primary breast lymphoma, PBL)是一种罕见的疾病,约占结外淋巴瘤的3%,占乳腺恶性肿瘤的0.5%,5年总生存期(OS)报告为50%~70%, 5%~16%的患者出现中枢神经系统(CNS)复发,危及患者生命[1-2]。原发性乳腺弥漫大B细胞性淋巴瘤(primary breast diffuse large B-cell lymphoma, PB-DLBCL)是最常见的组织学亚型。由于该病与乳腺癌有相似的临床表现及影像学表现,极易被误诊为乳腺癌。目前国内外对于该病均为小样本回顾性研究,对于其诊断和治疗的最佳方式尚未形成共识。目前临床上对于PB-DLBCL的治疗不推荐手术,常以单独或组合使用放疗和化疗。Thomas等[3]研究发现:PB-DLBCL的患者中,青年女性的人数有增加趋势。本文作者就本科近2年收治的3例PB-DLBCL患者的临床资料进行分析,并结合文献复习,以期提高对该病的认识。
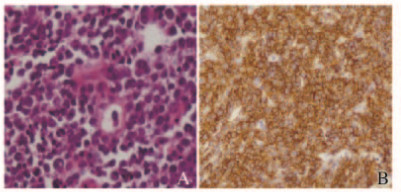
1 临床资料病例1:患者,女性,64岁,因发现右侧乳腺包块1个半月入院。无发热、盗汗和体质量减轻等全身症状。入院查体:右乳腺触及2 cm×4 cm包块,质韧,活动度差,无压痛。余浅表淋巴结未触及肿大。乳腺彩超示:右侧乳腺9点处可见2.8 cm×1.1 cm低回声肿物。行手术切除肿物。病理诊断:右侧PB-DLBCL。免疫组织化学染色结果:CD10、CD3、CK(AE/AE3)、Bcl-2、Bcl-6、CD3、CD34、CD43、CD56、CD2和CD99均(-),CD20、MUM1和CD79a均(+),Ki67(阳性率90%)(图 1,插页四)。骨髓检查正常。右乳术后化疗前彩超:右乳9~10点之间距乳头约为1.6 cm处探及0.8 cm×0.4 cm的片状低回声。临床分期为Ⅰ期A组, 淋巴瘤国际预后指数(IPI)评分1分。给予R-CHOP×4+CHOP×4周期化疗。R-CHOP方案化疗2周期结束后临床评价为完全缓解(CR),在第2次化疗间歇期给予鞘内注射预防CNS复发。8周期化疗结束至今,随访无复发。
|
| 图 1 乳腺肿瘤组织HE染色(A)和免疫组织化学染色(B)结果(×400) Figure 1 Results of HE staining (A) and immunohistochemical staining (B) of breast neoplasm tissue(×400) |
|
|
病例2:患者,女性,56岁,因左乳腺肿物进行性肿大伴疼痛3个月入院。查体:左乳腺触及大小约14 cm×10 cm包块,质硬、活动度差,有压痛,局部皮肤暗红色。左腋窝可触及质硬且活动度好的多个肿大淋巴结,较大者约5 cm×4 cm,无压痛。余查体未见异常。双乳彩超示:左乳占位,BIRADS-US分级为4C级,双腋下及锁骨上窝淋巴结肿大。CT示:纵隔内可见多枚淋巴结;左乳腺内占位,双侧腋窝淋巴结肿大。左乳腺及左腋窝肿物空心针穿刺活检病理:提示PB-DLBCL。免疫组织化学染色结果:CD10、CD3、CK(AE/AE3)、ER、GATA3、Vimentin、S-100、PR、CD5、CD56、CyclinD1、MPO和TdT均(-),Bcl-2、Bcl-6、CD20、CD79a、LCA、MUM1均(+),Ki67(阳性率90%)。骨髓未见浸润。临床分期为Ⅲ期A组,IPI评分2分。给予CHOP方案化疗2周期后临床评价为非常好的部分缓解(VGPR)。化疗2周期后复查彩超:左乳腺包块约8.9 cm×3.0 cm,左腋下淋巴结最大约2.0 cm×1.1 cm。胸部CT显示:左乳腺、双侧腋窝及纵隔淋巴结明显减小。目前仍在化疗中。
病例3:患者,女性,73岁,因发现右侧乳房肿物3个月入院。查体:右乳触及大小约3.3 cm×2.7 cm肿块,质韧,活动度差,无压痛。乳腺彩超示:右乳9-10点乳头旁腺体组织结构紊乱,腺管扩张,腺管周边回声增强,较宽处宽约0.38 cm,其内透声差;10点乳头旁3.1 cm处可见大小约1.3 cm×0.73 cm的低回声光团,周边界限欠清,其内可见条状略强回声;彩色多普勒超声(CDFI):内部可见条状血流信号,右腋下探及淋巴结样回声,以髓质回声为主,大小约1.1 cm×0.6 cm。乳腺钼靶:右侧乳腺可见3.3cm×2.7 cm肿块,边缘不规则,可见毛刺。右侧乳腺肿物及右侧腋窝淋巴结空心针穿刺活检病理提示:右侧PB-DLBCL。免疫组织化学结果:CD3、CK(AE/AE3)、EBER、Vimentin、CD7、MPO、CD10、Bcl-6、CylinD1和TdT均(-),Vimentin、PAX-5、Bcl-2、CD5和MUM1均(+),Ki67(阳性率85%)。骨髓未见浸润。临床分期为Ⅱ期A组,IPI评分2分。给予CHOP方案化疗1周期后疗效评价为CR。复查彩超:双乳腺未见占位性病变,BIRADS-US分级为1级。目前仍在化疗。
3例患者肿瘤组织免疫组织化学检测结果见表 1。根据Hans等[4]提出的分型标准,弥漫大B细胞性淋巴瘤(DLBCL)分为生发中心(germinal center B-cell, GCB)型和非生发中心(non-germinal center B-cell, non-GCB)型。GCB型:CD10+/bcl-6+/-/Mum-1+/-; CD10+/bcl+/Mum-1-; non-GCB型:CD10/bcl-6-/Mum-1+/-, CD10+/ bcl-6+/Mum-1+。
| Case | CD20 | CD79a | CD3 | CD10 | Bcl-2 | Bcl-6 | MUM1 | Ki-67 (η/%) |
| 1 | + | + | - | - | + | - | + | 90 |
| 2 | + | + | - | - | + | + | + | 90 |
| 3 | + | + | - | - | + | - | + | 85 |
PBL是少见且恶性程度较高的肿瘤。组织学上,PB-DLBCL是PBL最常见的组织学亚型,典型特征是无痛性单侧乳腺肿块,右侧乳腺受累多见,少数患者会有全身症状,PBL具有无毛刺征、钙化和肿块边缘结构不清等乳腺癌典型影像学征象,易误诊为乳腺癌[1-2, 5]。
PB-DLBCL的诊断依据Telesingle等[6]建立和Hugh等[7]修订的标准并结合免疫组织化学, 临床上多采用细针穿刺细胞学检查、手术切除活检及彩超引导下粗针穿刺活检,彩超引导下粗针穿刺活检具有较高的诊断符合率,且可减少对患者的损伤[8]。本组3例患者根据上述标准确立诊断。
研究[9-10]证实:乳腺切除术对提高PB-DLBCL患者生存率和减少复发风险无益。Uesato等[11]对行手术治疗的PB-DLBCL患者观察发现:腋窝淋巴结切除对预后意义不大,故只切除可供诊断的肿块组织量即可,应避免超出病理活检的手术干预。
化疗是治疗PB-DLBCL的主要手段。R-CHOP治疗方案在淋巴瘤的治疗中疗效确切,但尚无数据证明R-CHOP较CHOP方案在治疗PBL的优势[2, 12-13]。本科室收治的3例患者由于经济条件的限制,仅有1例应用美罗华(R-CHOP×4+CHOP×4)方案, 目前仍处于CR,其余2例应用CHOP×2、CHOP×1方案,疗效也非常显著,分别为VGPR和CR。PB-DLBCL的CNS复发率高,但由于缺少数据,预防性鞘内注射尚存在争议[2, 12, 14]。
放射治疗的主要作用是继化疗后巩固治疗,可降低局部复发的概率。许多研究[1-2, 11]表明:化疗联合放疗较单一放化疗有着明显的生存优势。2016年ESMO指南推荐6周期R-CHOP后,可给予(30~36 Gy)单侧全乳腺放疗[15]。也有研究者[16]提出:可结合PET-CT结果对局部病变乳腺进行放射治疗。
Weiler-Sagic等[17]研究发现:PET-CT诊断DLBCL的阳性率为98%,故临床上肯定了PET-CT在治疗前后评估DLBCL病情的价值,对治疗中期PET-CT的应用价值正在探索中,然而PET-CT不能取代头MRI和骨髓活检的价值。
PB-DLBCL预后因素存在争议[1-2, 12],较为确定的不良预后因素包括:改良IPI评分(stage-modified IPI)、肿块直径>4~5 cm、临床分期、病理类型和治疗方案。且肿物双侧累及也是CNS复发较为确定的高危因素[18]。
综上所述,PB-DLBCL发病率低,目前均为小样本临床研究。PB-DLBCL常表现为无痛性单侧乳腺肿块,难与乳腺癌鉴别。推荐空心针穿刺活检后行免疫组织化学确诊,应避免术中快速冷冻病理,临床医生需与病理医生有良好的沟通。治疗模式尚无定论,R-CHOP方案首选,后可续加以同侧全乳房照射巩固治疗,手术仅作为诊断用途,而非治疗手段。所有诊断为PB-DLBCL患者,尤其是危险分层为高危的患者必须给予CNS预防。推荐化疗前后用PET-CT评估。最优化疗周期数、化疗间隔时间、是否行预防性鞘内注射、何时放疗、放疗范围和剂量及PET-CT评估后维持或改变化疗方案等仍在探索中。
| [1] | Cheah CY, Campbell BA, Seymour JF. Primary breast lymphoma[J]. Cancer Treat Rev, 2014, 40(8): 900–908. DOI:10.1016/j.ctrv.2014.05.010 |
| [2] | Hosein PJ, Maragulia JC, Salzberg MP, et al. A multicentre study of primary breast diffuse large B-cell lymphoma in the rituximab era[J]. Br J Haematol, 2014, 165(3): 358–363. DOI:10.1111/bjh.2014.165.issue-3 |
| [3] | Thomas A, Link BK, Altekruse S, et al. Primary breast lymphoma in the United States:1975-2013[J]. J Natl Cancer Inst, 2017, 109(6): 1–8. |
| [4] | Hans CP, Weisenburger DD, Greiner TC, et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray[J]. Blood, 2004, 103(1): 275–282. DOI:10.1182/blood-2003-05-1545 |
| [5] | Shao YB, Sun XF, He YN, et al. Clinicopathological features of thirty patients with primary breast lymphoma and review of the literature[J]. Med Oncol, 2015, 32(2): 448–553. |
| [6] | Telesingle PU, Anthony PP. Primary lymphoma of the breast[J]. Histopathology, 1985, 9(3): 297–307. DOI:10.1111/his.1985.9.issue-3 |
| [7] | Hugh JC, Jackson FI, Hanson J, et al. Primary breast lymphoma.An immunohistologic study of 20 new cases[J]. Cancer, 1990, 66(12): 2602–2611. |
| [8] | Bicchierai G, Rigacci L, Miele V, et al. Role of core needle biopsy in primary breast lymphoma[J]. Radiol Med, 2017, 122(9): 651–655. DOI:10.1007/s11547-017-0773-3 |
| [9] | Jennings WC, Baker RS, Murray SS, Howard CA, et al. Primary breast lymphoma:the role of mastectomy and the importance of the importance of lymph node status[J]. Ann Surg, 2007, 245(5): 784–789. |
| [10] | Radkani P, Joshi D, Paramo JC, et al. Primary breast lymphoma:30 years of experience with diagnosis and treatment at a single medical center[J]. JAMA Surg, 2014, 149(1): 91–93. DOI:10.1001/jamasurg.2013.2283 |
| [11] | Uesato M, Miyazawa Y, Gunji Y, et al. Primary non-Hodgkin's lymphoma of the breast:report of a case with special reference to 380 cases in the Japanese literature[J]. Breast Cancer, 2005, 12(2): 154–158. DOI:10.2325/jbcs.12.154 |
| [12] | Yhim HY, Kim JS, Kang HJ, et al. Matched-pair analysis comparing the outcomes of primary breast and nodal diffuse large B-cell lymphoma in patients treated with rituximab plus chemotherapy[J]. Int J Cancer, 2012, 131(1): 235–243. DOI:10.1002/ijc.v131.1 |
| [13] | Wei ZL, Huang DP. Advances in diagnosis and treatment of primary breast lymphoma -Review[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2017, 25(2): 604–607. |
| [14] | Avilés A, Delgado S, Nambo MJ, et al. Primary breast lymphoma:results of a controlled clinical trial[J]. Oncology, 2005, 69(3): 256–260. DOI:10.1159/000088333 |
| [15] | Ryan G, Martinelli G, Kuper-Hommel M, et al. Prinary diffuse large B-cell lymphoma of the breast:prognostic fators and outcomes of a study by the Intemational Extranodal Lymphoma Study Group[J]. Ann Oncol, 2008, 19: 233–241. DOI:10.1093/annonc/mdm471 |
| [16] | Cahan B, Chen YJ. Modern radiation therapy for extranodal lymphomas:field and dose guildlines from the International Lymphoma Radiation Oncology Group[J]. Int J Radiat Oncol Biol Phys, 2015, 93(2): 471–472. |
| [17] | Weiler-Sagic M, Bushelev O, Epelbaum R, et al. (18)F-FDG avidity in lymphoma readdressed:a study of 766 patients[J]. J Nucl Med, 2010, 51(1): 25–30. DOI:10.2967/jnumed.109.067892 |
| [18] | 单冬勇, 曹科, 宾石珍, 等. 鼻腔NK/T细胞淋巴瘤行全脑全脊髓照射的放疗计划设计[J]. 中国医学物理学杂志, 2016, 33(2): 177–180. |
 2018, Vol. 44
2018, Vol. 44


