扩展功能
文章信息
- 李秋菊, 李亚龙, 刘国民, 鄂锐
- LI Qiuju, LI Yalong, LIU Guomin, E Rui
- 依那西普和英夫利昔单抗治疗青少年强直性脊柱炎的临床疗效和安全性评价
- Clinical efficacy and safety evaluation of etanercept and infliximab in treatment of adolescent ankylosing spondylitis
- 吉林大学学报(医学版), 2018, 44(01): 151-156
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 151-156
- 10.13481/j.1671-587x.20180129
-
文章历史
- 收稿日期: 2017-05-18
强直性脊柱炎(ankylosing spondylitis, AS)是一种累及中轴骨,以特征性炎症性背痛为特点的慢性自身免疫性疾病[1]。AS不仅可累及脊柱和骶髂关节,也可累及外周关节和关节外组织,表现为外周关节炎、附着点炎、急性葡萄膜炎和肠道炎症等[2-3]。AS的发病原因至今尚未明确,有学者[1, 4]认为:其发病机制与遗传、感染、免疫和理化因素有关。流行病学研究[5]显示:青少年为AS的高发人群,且男性发病率明显高于女性。AS患者关节软骨和椎间盘遭到破坏,可造成脊柱或受累关节僵硬畸形, 甚至终身残疾, 结构和功能的损伤严重影响了患者的生活质量[1]。目前AS尚无特异的根治手段,但及时妥善的治疗可缓解疼痛、稳定病情并可改善AS患者的生活质量[6]。近年来,相关研究[1, 7]表明:导致AS发生的重要原因是肿瘤坏死因子α(tumor necrosis factor-α, TNF-α),可促进滑膜成纤维细胞增生,并不断分泌白细胞介素6、趋化因子等效应分子,加重AS的病情。现有的相关生物制剂产品多为TNF-α拮抗剂,如依那西普和英夫利昔单抗等。依那西普(etanercept,商品名益赛普)是重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,作为一种可溶性TNF-α受体融合蛋白,可有效阻断TNF-α与细胞表面受体的结合,抑制异常免疫反应及炎症过程,是目前临床上治疗AS应用最广泛的TNF-α拮抗剂;英夫利昔单抗(infliximab,商品名Remicade、类克)是人鼠嵌合的TNF-α单克隆抗体,能与人体TNF-α快速构成稳定复合物,阻止TNF-α与细胞表面的TNF-α受体相结合,使TNF-α丧失生物活性,发挥其抗TNF-α的生物学作用,对于炎症有很好的控制效果,但二者治疗青少年AS的临床疗效并不相同[8]。选择合适的药物、进行更有效的治疗,可以降低AS患者的医疗费用支出,缩短治疗时间,降低医疗资源的消耗。本文作者研究了依那西普和英夫利昔单抗治疗青少年AS的临床疗效和安全性,为其临床应用提供参考依据。
1 资料与方法 1.1 一般资料回顾性选取本院自2013年4月—2014年9月期间收治的青少年AS男性患者60例,年龄13~25岁,平均年龄(19±5)岁,所有患者在接受治疗前的半年之内以及治疗期间,均未曾服用过改善病情抗风湿药物(disease modifying antirheumatic drugs,DMARDS),且所有患者在接受治疗前的半年内均无其他系统疾病体征。
1.2 纳入和排除标准纳入标准:60例患者均符合1984年美国风湿协会修订的AS诊断标准,骶髂关节X线、CT和MRI显示骶髂关节融合改变,且改变程度相似;实验室检查,血沉(ESR)和C反应蛋白(CRP)等炎性因子水平升高,人类白细胞抗原(HLB-27)阳性。
排除标准:确诊为完全僵直患者;3个月内接受过依那西普、英夫利昔单抗治疗者或其他临床试验者;半年内接受过DMARDS治疗者;严重肝肾功能异常及心功能不全者,内分泌和循环系统病变者;HIV抗体阳性或乙肝表面抗原阳性者。
1.3 分组在进行研究之前,本课题组成员已与患者及其家属取得联系,告知本研究的目的和方法,并签署知情同意书。根据用药不同,将60例患者随机分为依那西普组和英夫利昔单抗组,每组30例,治疗周期均为24周。在治疗前及治疗12和24周后对所有患者进行随访评估。本研究已获得吉林大学第二医院伦理委员会批准。
1.4 治疗方法 1.4.1 依那西普组本组患者共30例,采用依那西普(辉瑞制药有限公司,生产批号:F85516),共24周间断给药,单次剂量为25 mg,1~8周给予每周2次皮下注射,9~16周给予每周1次皮下注射,17~24周给予每2周1次皮下注射,逐渐减量(30例患者共注射840次)。
1.4.2 英夫利昔单抗组本组患者共30例,采用英夫利昔单抗(瑞士Cilag AG公司,生产批号:S20060024),共24周间断给药,首次剂量为100 mg,然后在首次给药后的第2周、第6周及以后每隔6周各给予1次相同剂量药物(30例患者共注射180次)。
1.5 疗效评价指标 1.5.1 AS活动性及功能性检查分别在治疗前、治疗12及24周后对所有患者进行以下检查:晨起僵直时间、枕墙距、指地距、Schöber试验、AS活动指数(BASDIA)、AS功能指数(BASFI)、ESR和CRP水平。
1.5.2 影像学检查骶髂关节X线、CT和MRI检查。骶髂关节MRI分级标准参照Bollow等[9]提出的分级方法:0级,无炎症改变;Ⅰ级,骨髓局限性脂肪堆积和(或)局限性软骨下硬化和(或)>2处侵蚀;Ⅱ级,中度脂肪堆积、中度软骨下硬化和(或)>2处无融合的侵蚀;Ⅲ级,关节间隙假性扩大和(或)轻度部分强直,严重软骨下硬化以及普遍脂肪堆积;Ⅳ级,肯定强直。
1.5.3 疗效评价治愈:患者躯干关节疼痛消失,无晨僵、活动受限发生,ESR和CRP水平等实验室指标恢复正常,影像学检查有明显改善;显效:躯干关节疼痛明显减轻,晨僵、活动受限明显减轻,实验室指标明显下降,影像学检查有所改善;有效:躯干关节疼痛有所减轻,晨僵、活动受限有所减轻,实验室指标有所下降,影像学检查无改善;无效:躯干关节疼痛没有减轻,晨僵、活动受限没有减轻,实验室指标未下降,影像学检查无改善。总有效率=(治愈病例数+显效病例数+有效病例数)/总病例数×100%。
1.6 安全性评价不良反应分为轻、中和重度。①轻度:皮肤过敏,大量出汗和潮热;②中度:感染,呼吸道反应和胃肠道反应;③重度:呼吸困难和感染。观察并记录治疗及随访期间患者出现不良反应的临床症状,计算不良反应发生率(不良反应发生率=发生不良反应总例数/总病例数×100%)。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。各项疗效评价指标如晨僵时间、ESR和CRP水平等均以x±s表示,2组间均数比较采用两独立样本t检验;患者治愈率和不良反应发生率以百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果 2.1 2组患者治疗前后各项疗效评价指标2组患者在治疗前各项指标基本相同,组间比较差异无统计学意义(P>0.05);治疗12和24周后,患者晨僵时间、指地距、枕墙距、Schöber试验、BASDAI、BASFI、ESR和CRP水平等指标较治疗前均有明显改善(P<0.05)。治疗24周后,依那西普组患者指地距、Schöber试验、ESR和CRP水平等指标优于英夫利昔单抗组(P<0.05)。英夫利昔单抗组患者BASDAI和BASFI优于依那西普组(P<0.05)。见表 1。
| (n=30, x±s) | ||||||||
| Group | Morning stiffness (t/h) |
Finger-ground distance (l/cm) |
Occiput to wall (l/cm) |
Schöber test (l/cm) |
BASDAI | BASFI | ESR(mm·h-1) | CRP [ρB/(mg·L-1)] |
| Infliximab | ||||||||
| Before treatment | 71.45±29.60 | 20.83±14.04 | 2.90±5.93 | 4.67±2.62 | 3.98±0.91 | 33.38±18.69 | 54.01±20.54 | 38.81±22.76 |
| 12 weeks after treatment | 38.78±15.09* | 15.87±9.86* | 1.01±2.93* | 3.01±1.62* | 2.89±1.78* | 9.82±5.34* | 15.43±5.83* | 6.25±3.83* |
| 24 weeks after treatment | 28.26±9.79* | 15.67±8.76* | 1.28±2.73* | 2.56±1.89* | 1.32±0.46* | 8.26±1.83* | 16.82±6.79* | 7.83±2.01* |
| Etanercept | ||||||||
| Before treatment | 71.38±27.50 | 21.55±15.36 | 3.82±6.75 | 3.38±1.42 | 3.58±1.12 | 34.91±17.18 | 51.74±19.68 | 37.54±13.67 |
| 12 weeks after treatment | 30.89±10.75* | 10.57±10.49* | 1.51±3.11* | 2.47±0.42* | 2.55±0.92* | 12.47±7.47* | 12.61±2.45* | 8.78±3.92* |
| 24 weeks after treatment | 25.68±8.34* | 7.88±8.89*△ | 0.82±2.10* | 1.37±0.32*△ | 1.98±0.58*△ | 9.83±2.91*△ | 9.72±1.28*△ | 5.19±4.01*△ |
| * P < 0.05 compared with before treatment; △ P < 0.05 compared with infliximab group. | ||||||||
治疗24周后,2组患者腰背部及腰骶部疼痛明显减轻或消失,脊柱活动程度及腰部晨僵症状均有所改善。依那西普组与英夫利昔单抗组患者总有效率分别为96.67%和93.33%,组间比较差异无统计学意义(P>0.05)。见表 2。
| (n=30) | ||||||
| Group | Control | Marked | Effective | Invalid | Efficiency(η/%) | Control rate(η/%) |
| Etanercept | 21 | 5 | 3 | 1 | 96.67 | 70.00 |
| Infliximab | 18 | 6 | 4 | 2 | 93.33 | 60.00 |
2组患者在治疗前,MRI表现为双侧骶髂关节不对称,可观察到高强度信号。在治疗12和24周后随访,2组患者骶髂关节MRI表现:依那西普组患者的骨性关节面有不同程度的破坏,可见有局部脂肪沉积、骨髓水肿等表现, 高强度信号消失,炎性损伤有明显改善,并无新病变;英夫利昔单抗组患者的骨性关节面有不同程度的破坏,可见骨性不完全融合表现,双侧骶髂关节关节间隙信号减弱,炎性损伤有明显改善。见图 1。
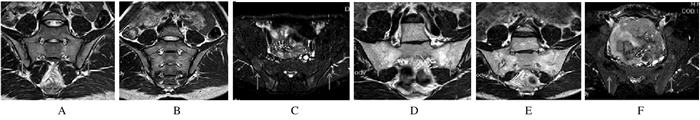
|
| Arrows showed the sacroiliac joints. A-C:Etanercept group; D-F:Infliximab group; A, D:Before treatment; B, E:12 weeks after treatment; C, F:24 weeks after treatment. 图 1 2组患者治疗前后MRI表现 Figure 1 MRI performance of patients in two groups before and after treatment |
|
|
依那西普组患者在治疗期间仅1例(3.33%)出现与治疗药物相关的不良反应,表现为注射位置的局部反应,中度皮肤红斑、瘙痒,持续2周后自行消退。英夫利昔单抗组患者在治疗期间5例(16.67%)出现与治疗药物相关的不良反应,其中2例出现中度感染,确诊为呼吸道感染和泌尿道感染,为避免并发症的发生,联合应用抗感染药物(喹诺酮类)3d后症状明显消退;2例患者在首次剂量使用后,出现消化系统反应,表现为恶心、呕吐,症状持续2~3 d后自行好转;1例患者在用药8周后出现过敏样反应,表现为皮肤瘙痒、风团样皮肤隆起,给予5%葡萄糖注射剂250 mL+葡萄糖酸钙2g+维生素C 1 g静滴,每天2次,3d后皮肤瘙痒及皮肤隆起消失。英夫利昔单抗组患者不良反应发生率明显高于依那西普组(P<0.05)。
3 讨论AS是一种以中轴关节和骶髂关节为主要病变的风湿性疾病[10],多发于青少年,目前发病原因尚不清楚。研究[11-12]表明:AS的发病与人类白细胞抗原B27(HLA-B27)抗原密切关联,且家族集聚倾向性明显。AS病理表现为浸润性骨质破坏、软骨下囊性病变及增生性炎症,AS若发展至病情晚期会导致患者出现严重的关节功能障碍,因此疾病的早期诊断对AS患者十分重要。ESR和CPR的快速升高是AS在病情初期活动的主要表现,表明AS患者炎症表现可以作为有无活动性病变的重要评估指标。本研究结合纽约诊断标准,通过临床症状及血清检测,明确AS诊断;通过对晨起僵直时间、枕墙距、指地距和Schöber试验等指标进行检测,对患者进行临床症状评估;通过影像学检查,如骶髂关节X线、骶髂关节CT和骶髂关节MRI等反映疾病的解剖学异常及严重程度的影像学信息,直观观察疾病;ESR和CRP水平的监测,可为判断病情提供参考依据。
TNF-α拮抗剂是一种在免疫应答和炎症反应中出现的细胞因子,其对AS的治疗效果显著[13-14]。对于传统治疗不敏感的AS患者来说,TNF-α拮抗剂在控制慢性炎症方面有明显优势。在短疗程治疗的AS患者中,约有1/3患者使用TNF-α拮抗剂后,症状达到70%~80%的缓解[15]。目前,临床上常用的TNF-α抑制剂主要为英夫利昔单抗、依那西普及阿达木单抗。本研究显示:治疗24周后,依那西普组和英夫利昔单抗组患者晨僵时间、指地距、枕墙距、Schöber试验、BASDAI、BASFI、ESR和CRP水平等均较治疗前明显下降;2组AS患者治愈率组间比较差异无统计学意义,说明二者疗效相当;依那西普组和英夫利昔单抗组治疗后与治疗前的影像学检查未见明显变化,说明依那西普及英夫利昔单抗无法完全消除病变组织。本研究结果提示:依那西普和英夫利昔单抗治疗青少年AS的临床疗效基本相同。
目前,TNF-α拮抗剂在改善AS患者症状、缓解病情等方面的疗效得到了一致肯定,但随着临床应用的增多,其不良反应也逐渐受到重视[16]。其常见的不良反应包括皮肤过敏、大量出汗、潮热、感染、呼吸道反应、胃肠道反应和呼吸困难等,注射部位的皮肤反应和呼吸道感染是依那西普与英夫利昔单抗最常见的不良反应。本研究中,依那西普组仅1例出现轻度不良反应,不良反应发生率为3.33%,英夫利昔单抗组仅出现5例轻度不良反应,不良反应发生率为16.67%,依那西普不良反应发生率低于英夫利昔单抗,表明依那西普和英夫利昔单抗治疗AS均安全有效,可优先选用依那西普。出现这种结果,也可能与本研究样本例数过少有关,同时,本组研究对象虽然在纳入研究前的半年内无其他系统疾病体征,但不可能完全排除隐匿性疾病,这也可能导致这种结果,因此需进行进一步的研究。
综上所述,依那西普和英夫利昔单抗均对青少年AS有较好的治疗作用,可有效改善AS髋关节受累患者的关节症状,降低疾病活动强度,2种药物短期疗效比较差异无统计学意义,均有较好的安全性,但依那西普不良反应发生率略低于英夫利昔单抗,该结果为指导二者的临床用药提供了一定的参考依据。但本研究样本量较小,同时纳入的研究对象虽已尽可能排除其他系统疾病,但不可能完全排除隐匿性疾病对研究结果的影响,且因技术问题,未对其治疗前后的影像学表现进行统计分析,这些都是本研究的不足之处,仍需要进行更深入的研究。
| [1] | Braun J, Sieper J. Ankylosing spondylitis[J]. Lancet, 2007, 369(9570): 1379–1390. DOI:10.1016/S0140-6736(07)60635-7 |
| [2] | Quaden DH, De Winter LM, Somers V. Detection of novel diagnostic antibodies in ankylosing spondylitis:An overview[J]. Autoimmun Rev, 2016, 15(8): 820–832. DOI:10.1016/j.autrev.2016.06.001 |
| [3] | Stolwijk C, Essers I, van Tubergen A, et al. The epidemiology of extra-articular manifestations in ankylosing spondylitis:a population-based matched cohort study[J]. Ann Rheum Dis, 2015, 74(7): 1373–1378. DOI:10.1136/annrheumdis-2014-205253 |
| [4] | Smith JA. Update on ankylosing spondylitis:current concepts in pathogenesis[J]. Curr Allergy Asthma Rep, 2015, 15(1): 489. DOI:10.1007/s11882-014-0489-6 |
| [5] | Exarchou S, Lindström U, Askling J, et al. The prevalence of clinically diagnosed ankylosing spondylitis and its clinical manifestations:a nationwide register study[J]. Arthritis Res Ther, 2015, 17: 118. DOI:10.1186/s13075-015-0627-0 |
| [6] | Machado MA, Moura CS, Ferré F, et al. Treatment persistence in patients with rheumatoid arthritis and ankylosing spondylitis[J]. Rev Saude Publica, 2016, 50: 50. |
| [7] | Liu KG, He QH, Tan JW, et al. Expression of TNF-α, VEGF, and MMP-3 mRNAs in synovial tissues and their roles in fibroblast-mediated osteogenesis in ankylosing spondylitis[J]. Genet Mol Res, 2015, 14(2): 6852–6858. |
| [8] | Escudero-Vilaplana V, Ramírez-Herráiz E, Alañón-Plaza E, et al. Efficiency of adalimumab, etanercept and infliximab in ankylosing spondylitis in clinical practice[J]. Int J Clin Pharm, 2015, 37(5): 808–814. DOI:10.1007/s11096-015-0124-1 |
| [9] | Bollow M, Braun J, Taupitz M, et al. CT guided intraarticular corticosteroid injection into the sacroiliac joints in patients with spondyloarthropathy:Indication and follow-up with contrast-enhanced MRI[J]. JComput Assist Tomogr, 1996, 20(4): 512–521. |
| [10] | 欧阳苏珊, 王高亚, 李敏, 等. 骨盆正位像评价强直性脊柱炎髋关节病变临床意义研究[J]. 中国实用内科杂志, 2017, 7(6): 537–539. |
| [11] | Akkoç N, Yarkan H, Kenar G, et al. Ankylosing spondylitis:HLA-B*27-positive versus HLA-B*27-negative disease[J]. Curr Rheumatol Rep, 2017, 19(5): 26. DOI:10.1007/s11926-017-0654-8 |
| [12] | Ranganathan V, Gracey E, Brown MA, et al. Pathogenesis of ankylosing spondylitis-recent advances and future directions[J]. Nat Rev Rheumatol, 2017, 13(6): 359–367. DOI:10.1038/nrrheum.2017.56 |
| [13] | Prince DS, McGuigan LE, McGirr EE. Working life and physical activity in ankylosing spondylitis pre and post anti-tumor necrosis factor-alpha therapy[J]. Int J Rheum Dis, 2014, 17(2): 165–172. DOI:10.1111/apl.2014.17.issue-2 |
| [14] | Maxwell LJ, Zochling J, Boonen A, et al. TNF-alpha inhibitors for ankylosing spondylitis[J]. Cochrane Database Syst Rev, 2015, 4(4): CD005468. |
| [15] | Poddubnyy DA, Song IH, Sieper J. The safety of celecoxib in ankylosing spondylitis treatment[J]. Expert Opin Drug Saf, 2008, 7(4): 401–409. DOI:10.1517/14740338.7.4.401 |
| [16] | Joshi N, Nautiyal A, Walton T. Infliximab therapy for inflammatory discitis in ankylosing spondylitis[J]. J Clin Rheumatol, 2012, 18(2): 109–110. |
 2018, Vol. 44
2018, Vol. 44


