扩展功能
文章信息
- 伍继成, 赵爽, 伍威, 杨雷, 丁晓青, 郑华川
- WU Jicheng, ZHAO Shuang, WU Wei, YANG Lei, DING Xiaoqing, ZHENG Huachuan
- 十全大补汤对SV40T抗原转基因小鼠晶状体自发肿瘤的抑制作用及其分子机制
- Inhibitory effect of Shiquandabu decoction on spontaneous len tumor of SV40 T antigen transgenic mice and its molecular mechanisms
- 吉林大学学报(医学版), 2018, 44(01): 13-17
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 13-17
- 10.13481/j.1671-587x.20180103
-
文章历史
- 收稿日期: 2017-07-04
2. 武汉大学人民医院消化内科, 湖北 武汉 430060
2. Department of Gastroenterology, Renmin Hospital, Wuhan University, Wuhan 430060, China
猴空泡病毒40(Simian vacuolating virus 40 or Simian virus 40,SV40)属瘤病毒科,其基因组是一种环形双链的DNA,全长5 200 bp,是第一个完成基因组DNA全序列分析的动物病毒[1]。采用α晶状体球蛋白特异性启动子和SV40 T抗原基因建立了一种晶状体肿瘤转基因(T antigen transgenic,TG)小鼠模型,使得SV40 T抗原可以特异性地在晶状体中表达,进而自主发生肿瘤[2],进而用于抗肿瘤药物的体内筛选。十全大补汤是一种结合了10种草本药物的天然药物,由南君子汤、四物汤加黄芪和肉桂组成[3],具有舒养心肝、补脾益气的功效,并能通过促进粒细胞集落刺激因子的生成,增强患者免疫力,有效降低重度化疗不良反应发生率及缓解慢性疾病疼痛等[4-6];此外,其已显示出通过增强吞噬功能,诱导细胞因子和抗体的产生来抑制肿瘤生长的作用[7]。本研究旨在通过给予SV40TG小鼠十全大补汤来研究其潜在的抗肿瘤作用,并通过氨基酸水平和基因芯片分析探讨其对于肝脏的保护作用及抗肿瘤作用机制。
1 材料与方法 1.1 实验动物和药物处理α晶状体蛋白启动子调控的SV40TG小鼠构建方法见参考文献[8]。TG小鼠饲养在SPF动物房中,给予相对恒定的温度和湿度,12h昼夜交替照明。本实验选取出生3周离乳后的TG小鼠(n=64),标记后随机分为对照组(n=39)和药物处理组(n=25),对照组小鼠给予标准维持饲料;药物处理组小鼠给予含1.5%十全大补汤的合成饲料(10.5%黄芪,10.5%人参,10.5%桂皮,10.5%当归,10.5%川芎,10.5%白芍药,10.5%熟地,10.5%白术,10.5%茯苓,5.5%甘草)。分别在喂食8和15周时采集对照组和药物处理组TG小鼠血清,取肝脏组织,样本存储于-80℃冰箱。
1.2 TG小鼠生存率检测出生3周的TG小鼠标记后分为对照组(n=33)和药物处理组(n=19),饲养同上,每日早晚各观察1次,分别记录每只小鼠生存时间,并计算各组小鼠生存率。
1.3 TG小鼠血清氨基酸水平检测TG小鼠在喂食十全大补汤8周(对照组n=3,药物处理组n=3)和15周(对照组n=3,药物处理组n=3)时,禁食过夜,尾静脉采集各组小鼠血液,立即置于冰上,3 000 min-1、4℃离心15 min,抽取上清存储于-80℃冰箱。血样解冻后,5%三氯乙酸脱蛋白,10 000 r·min-1、4℃离心15 min,收集上清液通过再生纤维素膜(美国密理博公司)过滤后,采用高效液相色谱-串联质谱法(MSQ Plus LC/MS液质联用系统, 美国Thermo公司)检测各组小鼠血清中氨基酸水平。谷氨酸、天冬氨酸和半胱氨酸由于在血清中不稳定,故排除在外不做检测。
1.4 基因芯片杂交含有24 000个转录本的MM8-60mer-expr-X4(NimbleGen)芯片用于肝脏基因表达分析检测。依据NimbleGen GeneChip®表达检测的说明书进行样品准备(3只/组)。提取肝脏组织总RNA,利用基因芯片®表达3′扩增试剂单循环cDNA合成试剂盒(美国昂飞公司)将10 μg总RNA反转成cDNA。利用Cy3标记试剂盒标记cDNA (美国罗氏公司),然后与基因芯片点阵杂交(42℃、16 h)。清洗芯片,生物芯片扫描仪(NimbleGen)扫描,Subio平台(Affymetrix)分析结果。杂交后有明显变化的基因吸光度(A)值数据转换为百分率,利用比较分析检测组间基因表达的改变。基因表达变化达到或者超过2倍被认为有意义。
1.5 基因网络与信号通路分析将基因编号输入国立变态反应与传染病研究所(National Institute of Allergy and Infectious Diseases,NIAID)网站的DAVID Bioinformatics Resources 6.7数据库(http://david.abcc.ncifcrf.gov/tools.jsp),分级聚类法研究对照组和药物处理组TG小鼠基因表达。
1.6 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组TG小鼠血清氨基酸水平以x±s表示,组间比较采用两独立样本的t检验。采用Kaplan-Meier法比较2组小鼠生存时间。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组TG小鼠生存率对照组TG小鼠平均生存32周,药物处理组TG小鼠平均生存39周。与对照组比较,药物处理组TG小鼠总体生存率明显提高(P < 0.05)。见图 1。

|
| 图 1 2组TG小鼠的生存率 Figure 1 Survival rates of TG mice in two groups |
|
|
与对照组比较,喂食十全大补汤8周时,药物处理组TG小鼠血清赖氨酸,缬氨酸、亮氨酸、异亮氨酸、苏氨酸、甲硫氨酸、脯氨酸、酪氨酸、丙氨酸、肌氨酸、瓜氨酸、鸟氨酸和羟赖氨酸水平升高(P < 0.05),胱硫醚、牛磺酸、甲基组氨酸、肌肽和乙醇胺水平降低(P < 0.05)。15周时,与对照组比较,药物处理组TG小鼠血清中苏氨酸和瓜氨酸水平升高(P < 0.05),其他氨基酸水平无明显变化(P>0.05)。见表 1。
| [n=3, x±s, cB/(μmol·L-1)] | |||||
| Amino acid | Control group | Drug treatment group | |||
| 8 weeks | 15 weeks | 8 weeks | 15 weeks | ||
| Lysin | 227.65±7.45 | 308.29±3.75 | 357.34±6.39* | 296.75±13.45 | |
| Valine | 197.21±3.35 | 300.29±5.76 | 268.34±13.45* | 295.62±5.35 | |
| Leucine | 138.81±3.29 | 208.15±0.81 | 231.96±6.27* | 201.37±5.15 | |
| Isoleucine | 82.92±3.71 | 122.34±2.95 | 150.67±5.10* | 118.76±6.08 | |
| Threonine | 142.60±1.95 | 150.75±3.55 | 201.87±4.15* | 13.56±8.83 | |
| Methionine | 38.24±0.35 | 71.17±2.56 | 73.09±7.88* | 79.06±2.35* | |
| Pronine | 88.47±0.64 | 112.35±5.83 | 142.19±7.75* | 112.79±5.25 | |
| Lyrosine | 68.41±3.06 | 76.04±0.35 | 112.29±3.56* | 84.06±2.28 | |
| Alanine | 288.18±4.79 | 449.76±5.07 | 526.29±4.08* | 462.19±5.36 | |
| Scrcosine | 1.88±1.05 | 4.47±3.72 | 6.41±4.35* | 3.85±4.50 | |
| Citrulline | 68.24±4.46 | 76.31±4.39 | 92.74±4.31* | 97.49±4.20* | |
| Ornithine | 72.17±2.45 | 165.38±1.79 | 204.58±2.56* | 178.32±2.56 | |
| Hydroxylysine | 0.82±0.50 | 2.35±3.58 | 2.46±3.55* | 1.96±3.60 | |
| Cystathionine | 8.29±1.10 | 3.97±3.64 | 4.78±3.72* | 4.82±1.50 | |
| Taurine | 1 082.19±5.43 | 529.08±4.46 | 523.96±3.08* | 511.85±2.73 | |
| Methylhistidine | 8.85±3.49 | 7.55±1.18 | 5.76±0.95* | 6.88±2.85 | |
| Anserine | 6.02±0.11 | 3.98±4.53 | 3.85±1.53* | 3.20±1.80 | |
| Ethanolamine | 32.65±3.60 | 36.16±1.94 | 18.38±5.50* | 19.26±1.43 | |
| * P < 0.05 compared with control group. | |||||
基因芯片杂交结果分析显示:喂食十全大补汤后,与对照组比较,TG小鼠肝组织表达的9 083个基因中与核糖体功能相关的13个基因发生改变(P < 0.05);功能分析及基因本体中发生明显改变的基因也与核糖体相关(P < 0.05)。见图 2(插页一)和表 2~4。
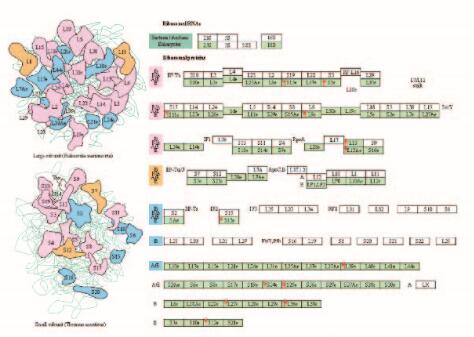
|
| Note: Red arrow (left) indicated up-regulation. 图 2 2组TG小鼠肝脏核糖体途径的变化 Figure 2 Changes of ribosomal pathways in liver of TG mice in two groups |
|
|
| Accession number | Gene name | Fold change | P |
| NM_011295 | Rps12 | 2.11 | 2.29e-3 |
| NM_011297 | Rps24 | 3.72 | 1.05e-2 |
| NM_011292 | Rpl9 | 3.12 | 1.30e-2 |
| NM_011289 | Rpl27 | 2.16 | 1.33e-2 |
| NM_018730 | Rpl36 | 2.9 | 2.32e-2 |
| NM_026533 | Rps13 | 2.73 | 2.50e-2 |
| NM_024266 | Rps25 | 4.99 | 3.09e-2 |
| NM_026759 | Mrpl13 | 2.65 | 3.48e-2 |
| NM_009091 | Rps15 | 2.52 | 3.51e-2 |
| NM_012052 | Rps3 | 2.05 | 3.79e-2 |
| NM_009438 | Rpl13a | 3.00 | 4.02e-2 |
| NM_026055 | Rpl39 | 2.72 | 4.49e-2 |
| NM_013725 | Rps11 | 2.68 | 4.73e-2 |
| Note:e-n=10-n. | |||
| Term | Count | P |
| Acetylation | 190 | 1.99e-18 |
| Mitochondrion | 85 | 3.38e-14 |
| Ribosomal protein | 35 | 2.65e-13 |
| Ribonucleoprotein | 43 | 4.58e-13 |
| Protein biosynthesis | 23 | 1.67e-7 |
| Note:e-n=10-n. | ||
| Term | Count | P |
| Mitochondrion | 132 | 1.80e-20 |
| Ribosome | 37 | 7.94e-14 |
| Ribonucleoprotein complex | 52 | 8.17e-10 |
| Mitochondrial part | 53 | 2.22e-8 |
| Ribosomal subunit | 16 | 1.13e-7 |
α晶状体蛋白启动子调控的SV40 T抗原诱发的晶状体上皮自发肿瘤转基因动物模型可通过观察动物视力和肿瘤大小,初步判断晶状体上皮细胞病变和肿瘤侵袭进程,且不影响动物生存,不用处死动物就可以直接观察到肿瘤生长情况。该肿瘤动物模型用于抗肿瘤药物疗效筛选,可排除其他环境致癌物对筛查抗肿瘤药物的影响,并且具有操作简单、方便和快捷的特点。
十全大补汤是补血保肝的著名方剂,各成分之间相辅相成,对各种疾病有滋补治疗的作用,文献[9]也较早的报道了其明显的抗肿瘤作用。Satoh等[10]研究发现:十全大补汤可以有效延长晚期肺癌患者生存期,治疗组患者在给予十全大补汤后,血清中6种必需氨基酸水平(缬氨酸、亮氨酸、异亮氨酸、苏氨酸、甲硫氨酸和赖氨酸)升高,而胱硫醚、牛磺酸、甲基组氨酸、肌肽和乙醇胺水平降低,与本研究的检测结果一致。研究[11]表明:胱硫醚、牛磺酸、甲基组氨酸、肌肽和乙醇胺的高表达与肝脏疾病有密切关联,十全大补汤能有效降低TG小鼠血清中此类氨基酸的水平,可能是其发挥保肝作用的基础。必需氨基酸是机体不能合成而必需从饮食中摄入的氨基酸, 可反映动物食欲,非必需氨基酸主要由肝脏合成,可反映肝脏功能,TG小鼠喂食十全大补汤后血清中氨基酸水平得到改善。综合文献报道及本研究结果,本文作者推测:十全大补汤能促使TG小鼠食欲增加,改善营养状态,提高肝脏的合成功能,并通过汤剂中的部分成分缓解肿瘤疼痛,发挥抑制晶状体肿瘤的作用,且对肝脏无损伤。这一假设也解释了药物治疗的小鼠具有更高的生存率的原因。此外,较长时间的治疗会导致药物诱导的营养改善作用消失,这可能与TG小鼠食欲的稳定或随着年龄的增长肝脏解毒能力的增强有关,其具体机制还需进一步研究。
核糖体蛋白是组成核糖体的主要成分,其通过促进核糖体RNA折叠而使之处于最利于其执行翻译功能的构象状态,提高蛋白质生物合成的效率和准确度[12];此外,核糖体蛋白还存在核糖体外的功能如参与细胞增殖、分化和凋亡,调节生物体的生长发育。研究[13-15]显示:多种核糖体蛋白参与肿瘤的发生演进。核糖体蛋白可通过调控癌基因和抑癌基因表达,调控细胞周期和凋亡,促进血管生成,调节肿瘤的生物学行为。基因芯片杂交结果显示:十全大补汤饲养后的TG小鼠肝脏与核糖体功能相关的基因发生明显改变,肝脏显示出了高水平的蛋白质的合成,功能分析和基因本体也同样证明了这一点。十全大补汤喂食后上调了TG小鼠的肝脏解毒功能导致高水平的蛋白质合成可解释这种现象,高水平的蛋白质合成也可同时保护肝脏避免进一步的损伤。因此,综合本研究中氨基酸检测和基因芯片杂交结果推测:十全大补汤可促进TG小鼠肝脏对部分氨基酸的合成,提高肝脏核糖体蛋白的合成能力,缓解晶状体自发肿瘤。
综上所述,十全大补汤可通过改善TG小鼠的食欲来改善其营养状态,提高血清中必需氨基酸的水平,促进肝脏非必需氨基酸及核糖体蛋白的合成能力,在不伴有肝损害的情况下延长TG小鼠的生存时间,发挥抗肿瘤作用。十全大补汤中各成分在该模型中的分子靶点有待进一步研究。
| [1] | Poulin DL, DeCaprio JA. The carboxyl-terminal domain of large T antigen rescues SV40 host range activity in trans independent of acetylation[J]. Virology, 2006, 349(1): 212–221. DOI:10.1016/j.virol.2006.01.046 |
| [2] | 王建平, 张梅英, 徐小燕, 等. JCV病毒T抗原诱发晶状体上皮肿瘤动物模型建立[J]. 中国医科大学学报, 2011, 40(1): 27–29. |
| [3] | 任华, 沈初. 观察十全大补汤联合肠内营养对食管癌术后患者免疫功能的影响[J]. 新中医, 2016, 48(10): 204–206. |
| [4] | 杜春海, 戎瑞雪, 王梦, 等. 十全大补汤多糖成分抑瘤及免疫调节作用的初步研究[J]. 河北中医药学报, 2014, 29(4): 3–6. |
| [5] | 唐妮. 十全大补汤对卵巢癌术后化疗疗效的影响及安全性评价[J]. 西南国防医药, 2017, 27(7): 762–764. |
| [6] | 王本军, 白克运, 李云霞. 结直肠癌患者术后服用十全大补汤联合化疗对血清TGF-β1水平的影响[J]. 山东医药, 2017, 57(10): 42–44. DOI:10.3969/j.issn.1002-266X.2017.10.013 |
| [7] | 宋红, 包素珍, 郑小伟, 等. 血管内皮细胞生长因子在Lewis肺癌组织中表达的意义及十全大补汤对其干预作用[J]. 中华中医药杂志, 2008, 23(8): 684–687. |
| [8] | Zheng HC, Nakamura T, Zheng Y, et al. SV40 T antigen disrupted the cell metabolism and the balance between proliferation and apoptosis in lens tumors of transgenic mice[J]. J Cancer Res Clin Oncol, 2009, 135(11): 1521–1532. DOI:10.1007/s00432-009-0599-z |
| [9] | 刘华岩, 王军. 十全大补汤对小鼠骨髓源性细胞向脑内迁移的影响[J]. 中国医科大学学报, 2011, 40(12): 1075–1078. |
| [10] | Satoh H, Ishikawa H, Ohtsuka M, et al. Japanese herbal medicine in patients with advanced lung cancer:prolongation of survival[J]. J Altern Complement Med, 2002, 8(2): 107–108. DOI:10.1089/107555302317371370 |
| [11] | Ghandforoush-Sattari M, Mashayekhi S. Evaluation of taurine as a biomarker of liver damage in paracetamol poisoning[J]. Eur J Pharmacol, 2008, 581(1/2): 171–176. |
| [12] | 田媛, 张俊平. 核糖体蛋白质的新功能及其与相关疾病的关系[J]. 生命的化学, 2011, 31(4): 488–491. |
| [13] | 袁飞, 王树斌, 王月丽. 核糖体蛋白家族在肿瘤发生、发展中作用的研究进展[J]. 肿瘤代谢与营养电子杂志, 2017, 4(1): 109–112. |
| [14] | 祁岳坤, 吴凌云. 核糖体蛋白异常与相关血液疾病[J]. 中国实验血液学杂志, 2016, 24(6): 1892–1896. |
| [15] | 彭文苗, 秦传蓉, 张志敏, 等. 核糖体蛋白L23参与肿瘤进程的研究[J]. 国际肿瘤学杂志, 2016, 43(11): 835–837. DOI:10.3760/cma.j.issn.1673-422X.2016.11.008 |
 2018, Vol. 44
2018, Vol. 44


