扩展功能
文章信息
- 齐若, 周晓利, 顾志敏, 霍银平
- QI Ruo, ZHUO Xiaoli, GU Zhimin, HUO Yinping
- 当归多糖对青光眼大鼠视网膜神经细胞的保护作用及其机制
- Protective effect of Angelica polysaccharide on retinal nerve cells in glaucoma rats and its mechanism
- 吉林大学学报(医学版), 2018, 44(01): 111-115
- Journal of Jilin University (Medicine Edition), 2018, 44(01): 111-115
- 10.13481/j.1671-587x.20180121
-
文章历史
- 收稿日期: 2017-06-29
青光眼是以视神经节细胞损伤为特征的眼科多发疾病,是导致视功能严重受损的重要原因,眼压升高是其主要的危险因素,目前尚不清楚其具体致病机制[1]。临床治疗以降低眼压和保护视神经为主。眼压升高可引起视网膜神经节细胞的损伤,造成视功能减退,引起一系列链式反应[2]。近年来研究[3-5]显示:眼压升高引起神经毒素因子一氧化氮(NO)和自由基的大量释放,通过与超氧自由基再结合,产生出毒性更大的羟基自由基,直接或间接造成视网膜节细胞的凋亡。研究[6-8]证明:在视神经损伤过程中天冬氨酸特异性半胱氨酸蛋白酶3 (Caspase-3)介导蛋白酶级联反应,降低Caspase-3可改善活体感光细胞光损伤程度及保证视网膜细胞存活。随着研究的深入,治疗青光眼的根本环节是保护视网膜节细胞,减少节细胞的不断丢失[9-10]。
中医对视神经保护具有独特优势,国内外学者进行了大量中药对视网膜视神经节细胞损伤保护作用的研究。当归多糖是植物当归的主要药理成分,现代药理研究[11-12]表明:当归多糖能增加机体的免疫功能,能够清除活性氧自由基并且具有极强的抗氧化能力。目前国内外尚未见相关研究报道。当归多糖具有神经保护作用,基于此,本文作者通过动物实验观察当归多糖对青光眼致模型大鼠视网膜神经细胞损伤的保护作用,探讨其抗氧化损伤的分子机制,为进一步研究当归多糖保护视网膜神经细胞损伤提供实验依据。
1 材料与方法 1.1 实验动物、药物、主要试剂和仪器SPF级、健康雄性SD大鼠84只,6周龄,体质量180~220 g,购自第四军医大学实验动物中心,动物合格证号:SYXK(陕)2014-001。当归多糖(糖含量85.1%,自制),维生素E滴丸(广东中山市三才医药集团有限公司),超氧化物歧化酶(SOD)、丙二醛(MDA)和一氧化氮(NO)试剂盒(南京建成生物工程研究所),Caspase-3、GAPDH兔抗大鼠多克隆抗体(美国Sigma公司)。CX7型全自动生化检测仪(美国Beakman公司),Blofuge28RS型高速冷冻离心机(德国贺利氏集团公司),FLUOR plus型多功能酶标仪(瑞典Tecan公司),Stepone Plus型荧光定量PCR仪(美国ABI公司),AEL-160电子分析天平(日本岛津公司)。
1.2 青光眼大鼠模型制备及分组将84只SD大鼠随机分为对照组、模型组、阳性药组、低剂量当归多糖组、中剂量当归多糖组和高剂量当归多糖组,每组14只。参照参考文献[13],除对照组外,其余4组大鼠采用烧灼烙闭巩膜上静脉法建立大鼠青光眼模型。10 d后,大鼠平均眼压维持在22 mmHg以上者为造模成功。低、中和高剂量当归多糖组大鼠每日分别灌胃给予0.3 mL当归多糖溶液(12、24和48 g·L-1),阳性药组大鼠按成动物给药剂量灌胃维生素E溶液(0.2 g·d-1),对照组和模型组大鼠灌胃等量生理盐水。连续给药2周。
1.3 各组大鼠眼压测定分别于造模后3、5、7、10和14 d,用笔式眼压计测量各组大鼠眼压,测量前用丁卡因药水滴双眼,取其平均值,测量结束后用药水冲洗大鼠眼结膜囊。
1.4 各组大鼠视网膜组织中SOD活性及MDA和NO水平给药2周后,脱颈处死大鼠,摘取眼球,显微镜下剥离视网膜后称质量,加9倍预冷生理盐水,低温条件下,以3000 r·min-1离心20 min,取上清液,按试剂盒操作说明,采用比色法测定大鼠视网膜组织中SOD活性及MDA和NO水平。
1.5 RT-PCR法检测各组大鼠视网膜组织中Caspase-3 mRNA表达水平按照Trizol试剂盒操作步骤提取大鼠视网膜组织总RNA,紫外分光光度计法测定总RNA含量,采用RT-PCR试剂盒操作说明进行逆转录合成cDNA,进行扩增,取扩增产物电泳,采用凝胶图像计算光密度积分,进行半定量分析,计算Caspase-3 mRNA表达水平。引物序列:Caspase-3,上游引物5′-AGAGCTGCACTGCGGTATTGAG-3′,下游引物5′-GAACCATGACCCGTCCCTTG-3′;GAPDH,上游引物5′-ATCTTCCAGGAGCGAGAT-3′,下游引物5′-TAAGCAGTTGGTGGTGCA-3′。
1.6 Western bloting法检测各组大鼠视网膜组织中Caspase-3蛋白表达水平给药2周后,剥取大鼠视网膜组织,粉碎,加入组织裂解液提取蛋白,用Western blotting试剂盒进行蛋白定量,采用湿转的转膜方式,加入兔抗鼠抗体Caspase-3过夜,山羊抗兔抗体孵育90 mim,每组取10 μg蛋白进行SDS-PAGE电泳,得到的条带用凝胶成像分析仪进行分析,计算视网膜组织中Caspase-3蛋白相对表达水平,蛋白表达水平=目的蛋白吸光度(A)值/内参蛋白A值。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析。各组大鼠眼压、视网膜组织中SOD活性及MDA和NO水平、Caspase-3 mRNA和蛋白表达水平均以x±s表示,组间比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠眼压与对照组比较,模型组大鼠各时间点眼压明显升高(P < 0.05),青光眼模型制备成功;与模型组比较,阳性药组及低、中和高剂量当归多糖组大鼠眼压明显降低(P < 0.05),且呈剂量依赖性。7d以后,与低剂量当归多糖组和阳性药组比较,高剂量当归多糖组大鼠眼压明显降低(P < 0.05)。见表 1。
| (n=4, x±s, P/mmHg) | |||||
| Group | Intraocular pressure | ||||
| (t/d) 3 | 5 | 7 | 10 | 14 | |
| Control | 13.61±0.83 | 13.94±0.75 | 13.87±0.93 | 13.52±0.75 | 13.88±0.73 |
| Model | 21.44±0.79* | 25.38±1.05* | 28.72±1.11* | 30.48±1.06* | 31.51±1.20* |
| Positive drug | 20.22±1.13 | 20.67±1.81△ | 19.83±1.21△ | 19.54±1.37△ | 17.55±0.98△ |
| Angelica polysaccharide | |||||
| Low dose | 20.18±1.21 | 20.46±1.34△ | 21.48±0.86△ | 19.01±0.54△ | 18.20±0.66△ |
| Middle dose | 19.46±0.98 | 18.61±1.64△ | 19.27±0.91△ | 17.63±0.81△ | 15.43±0.79△ |
| High dose | 19.01±1.13 | 18.13±0.87△ | 18.44±1.02△#○ | 15.44±0.97△#○ | 15.61±0.91△#○ |
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group; # P < 0.05 compared with low dose of Angelica polysaccharide group; ○ P < 0.05 compared with positive drug group. | |||||
与对照组比较,SOD活性明显降低(P < 0.05),模型组大鼠视网膜组织中MDA和NO水平升高(P < 0.05);与模型组比较,阳性药组及低、中和高剂量当归多糖组大鼠视网膜组织中SOD活性明显升高(P < 0.05),MDA和NO水平均明显降低(P < 0.05),呈剂量依赖性。与低剂量当归多糖组比较,高剂量当归多糖组大鼠视网膜组织中SOD活性明显升高(P < 0.05),MDA和NO水平明显降低(P < 0.05)。见表 2。
| (n=14, x±s) | |||
| Group | SOD[λB/(U·L-1)] | MDA [cB/(μmol·L-1)] | NO [cB/(μmol·L-1)] |
| Control | 151.74±17.26 | 4.56±0.79 | 13.13±1.67 |
| Model | 107.60±12.54* | 7.47±0.84* | 34.75±2.51* |
| Positive drug | 140.27±11.81△ | 5.01±0.92△ | 15.44±1.40△ |
| Angelica polysaccharide | |||
| Low dose | 133.23±11.39△ | 5.88±0.66△ | 15.67±1.04△ |
| Middle dose | 148.35±13.67△ | 4.43±0.87△ | 13.52±1.36△ |
| Middle dose | 156.27±11.98△# | 4.39±0.61△# | 12.89±1.11△# |
| * P < 0.05 compared with control group; △ P < 0.05 compared with model group; # P < 0.05 compared with low dose of Angelica polysaccharide group. | |||
与对照组比较,模型组大鼠视网膜组织中Caspase-3 mRNA和蛋白表达水平明显升高(P < 0.01);与模型组比较,阳性药组及低、中和高剂量当归多糖组大鼠视网膜组织中Caspase-3 mRNA和蛋白表达水平明显降低(P < 0.05)。与低剂量当归多糖组比较,高剂量当归多糖组大鼠视网膜组织中Caspase-3 mRNA和蛋白表达水平明显降低(P < 0.05)。见表 3和图 1。
| Group | Caspase-3 | |
| mRNA | Protein | |
| Control | 0.52±0.01 | 0.96±0.09 |
| Model | 2.42±0.21* | 3.52±0.22* |
| Positive drug | 1.43±0.18△ | 1.54±0.04△ |
| Angelica polysaccharide | ||
| Low dose | 2.01±0.17△ | 2.98±0.31△ |
| Middle dose | 1.57±0.05△ | 2.34±0.07△ |
| Middle dose | 0.97±0.03△# | 1.38±0.19△# |
| * P < 0.01 compared with control group; △ P < 0.05 compared with model group; # P < 0.05 compared with low dose of Angelica polysaccharide group. | ||
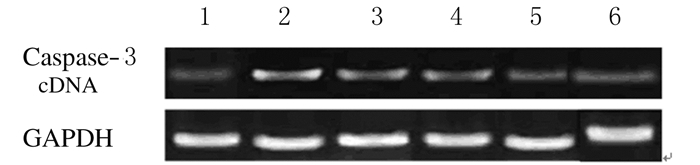
|
| Lane 1:Control group; Lane 2:Model group; Lane 3: Low dose of Angelica polysaccharide group; Lane 4:Middle dose of Angelica polysaccharide group; Lane 5:High dose of Angelica polysaccharide group; Lane 6:Prositive drug group. 图 1 各组大鼠视网膜组织中Caspase-3蛋白表达电泳图 Figure 1 Eletrophoregram of expressions of Caspase-3 protein in retina tissue of rats in various groups |
|
|
青光眼是以视神经萎缩和视野缺损为特征的疾病,眼压升高是其主要危险因素[14]。当归是我国传统常用“补血”中药,为伞形科植物当归干燥根,性温,味甘、辛,具有补血活血、调经止痛、抗氧化、抗炎和增强免疫等功效,为最常用的无毒上品药物[15]。当归多糖为当归水溶性提取物,主要由葡萄糖和半乳糖组成,现代药理研究[16]表明:当归多糖可促进造血功能,调节免疫系统,具有较强的抗氧化作用。本研究观察当归多糖对青光眼模型大鼠保护作用的结果显示:当归多糖作用于青光眼大鼠2周后,大鼠眼压明显降低,提示当归多糖对青光眼大鼠眼压具有明显的改善作用。
研究[17-18]表明:青光眼患者视网膜组织中脂质过氧化升高,而抗氧化酶活性降低。MDA是膜过氧化产物之一,SOD是主要抗氧化酶。因此通过检测视网膜组织中MDA水平可以反映视网膜组织中脂质过氧化水平,反映出视网膜组织自由基损伤程度。本研究结果显示:经不同剂量当归多糖作用后,大鼠视网膜组织中MDA水平明显降低,而SOD活性较模型组明显升高,提示当归多糖通过降低MDA水平,提高抗氧化酶活性,降低自由基含量,从而减轻青光眼大鼠视网膜组织过氧化水平及自由基氧化损伤,保护视网膜神经细胞。
NO广泛存在于体内,与细胞凋亡密切相关,可诱导细胞凋亡[19]。在视网膜神经细胞损伤中,NO的毒性作用可能是细胞毒性作用,其通过与超氧自由基再结合,产生毒性更大的羟基自由基,直接或间接地造成视网膜节细胞的凋亡。NO属自由基结构,是一种非传统的神经传导介质。研究[20]证明:NO由星形胶质细胞产生,过量的NO有潜在的神经毒性,可存在于突触间隙,刺激谷氨酸盐的释放,对青光眼神经破坏起主要作用。研究[21]显示:NO还可以破坏DNA的螺旋结构,导致细胞损害,还可以与某些铁原子结合形成亚硝酰铁螯合结构,抑制与细胞呼吸有关的关键酶的活性,加重神经元破坏。Caspase-3作为凋亡级联反应中的关键酶,存在于细胞内,受上游蛋白酶影响。研究[22]证实:Caspase-3在视神经损伤病理过程中起重要作用。本研究结果显示:给予当归多糖后青光眼大鼠视网膜组织中NO水平及Caspase-3 mRNA和蛋白表达水平明显低于模型组,肯定了当归多糖在青光眼大鼠视网膜神经细胞损伤中的保护作用,可能与当归多糖抑制视网膜神经细胞损伤后Caspase-3表达及减少视网膜细胞凋亡有关。此外,当归多糖还具备抗氧化效应,可减少视网膜神经细胞组织的耗氧量,快速清除NO,阻断NO合成,减轻青光眼大鼠视网膜神经细胞损伤。
综上所述,当归多糖对青光眼模型大鼠的视网膜组织有保护作用,可以降低视网膜组织中MDA和NO水平,升高SOD活性,同时降低视网膜组织中Caspase-3 mRNA和蛋白表达水平,这可能是当归多糖保护视网膜组织神经细胞的机制之一,但其相互调控关系仍需进一步深入研究。本研究为临床开发当归多糖防治青光眼视网膜神经损伤提供了实验依据。
| [1] | 张诚, 张殷建. 青光眼视神经节细胞内外源性凋亡机制及中西医保护研究新进展[J]. 西部中医药, 2017, 30(1): 134–138. |
| [2] | 刘晓坤, 张晓宇, 王赟, 等. 米诺环素对大鼠视神经挫伤后视网膜Caspase-3表达的影响[J]. 眼科新进展, 2013, 33(12): 1132–1135. |
| [3] | Nishikawa Y, Oku H, Morishita S, et al. Negative impact of AQP-4 channel inhibition on survival of retinal ganglion cells and glutamate metabolism after crushing optic nerve[J]. Exp Eye Res, 2016, 146: 118–127. DOI:10.1016/j.exer.2015.12.012 |
| [4] | Sánchez-Migallón MC, Valiente-Soriano FJ, Nadal-Nicolás FM, et al. Apoptotic retinal ganglion cell death after optic nerve transection or crush in mice:delayed RGC loss with BDNF or a caspase 3 inhibitor[J]. Invest Ophthalmol Vis Sci, 2016, 57(1): 81–93. DOI:10.1167/iovs.15-17841 |
| [5] | 刘恬, 刘奕志, 钟惟德, 等. 色素上皮衍生因子对晶状体上皮细胞生长的促进作用及其机制[J]. 中华实验眼科杂志, 2015, 33(4): 342–346. |
| [6] | 何家全, 杨忠, 蔡文琴, 等. 大鼠视神经的发育学研究[J]. 西部医学, 2015, 27(4): 486–489. |
| [7] | Lossi L, Cocito C, Alasia S, et al. Ex vivo imaging of active caspase 3 by a FRET-based molecular probe demonstrates the cellular dynamics and localization of the protease in cerebellar granule cells and its regulation by the apoptosis-inhibiting protein survivin[J]. Mol Neurodegener, 2016, 11(4): 34. |
| [8] | Shiri R, Yari F, Ahmadinejad M, et al. The caspase-3 inhibitor (peptide Z-DEVD-FMK) affects the survival and function of platelets in platelet concentrate during storage[J]. Blood Res, 2014, 49(1): 49–53. DOI:10.5045/br.2014.49.1.49 |
| [9] | Noristani R, Kuehn S, Stute G, et al. Retinal and optic nerve damage is associated with early glial responses in an experimental autoimmune glaucoma model[J]. J Mol Neurosci, 2016, 58(4): 470–482. DOI:10.1007/s12031-015-0707-2 |
| [10] | Bell K, Wilding C, Funke S, et al. Neuroprotective effects of antibodies on retinal ganglion cells in an adolescent retina organ culture[J]. J Neurochem, 2016, 139(2): 256–269. DOI:10.1111/jnc.2016.139.issue-2 |
| [11] | 李贵荣, 吕昌银, 杨胜圆. 当归多糖清除活性氧自由基作用的研究[J]. 南华大学学报:理工版, 2002, 16(3): 18–20. |
| [12] | 刘丽花. 当归多糖抗氧化作用的研究[J]. 当代医药论丛, 2014, 12(3): 284–285. |
| [13] | Park KH, Cozier F, Ong OC, et al. Induction of heat shock protein 72 protects retinal ganglion cells in a rat glaucoma model[J]. Invest Ophthalmol Vis Sci, 2001, 42(7): 1522–1530. |
| [14] | Tham YC, Aung T, Fan Q, et al. Joint effects of intraocular pressure and myopia on risk of primary open-angle glaucoma:The singapore epidemiology of eye diseases study[J]. Sci Rep, 2016, 6: 19320. DOI:10.1038/srep19320 |
| [15] | 冯学花, 梁肖蕾. 当归化学成分与药理作用的研究进展[J]. 广州化工, 2012, 40(22): 16–18. |
| [16] | 曹蔚. 当归多糖的结构与抗肿瘤作用及其机制研究[D]. 西安: 第四军医大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-90026-2006142022.htm |
| [17] | 马园, 王大朋, 许熙国, 等. 活性氧、丙二醛及超氧化物歧化酶在NaAsO2致人角质形成细胞恶性转化过程中的动态变化[J]. 卫生研究, 2015, 44(3): 456–561. |
| [18] | 施月欢, 邹秀兰, 赵松滨. 川芎嗪对大鼠缺血再灌注视网膜SOD、MDA和NO水平及细胞凋亡的影响[J]. 眼科研究, 2001, 19(4): 301–303. |
| [19] | Ho MF, Low LM, Rose'Meyer RB. Pharmacology of the adenosine A3 receptor in the vasculature and essential hypertension[J]. PLoS One, 2016, 11(2): e0150021. DOI:10.1371/journal.pone.0150021 |
| [20] | Estíbaliz GF, María Victoria SG, Alberto PS, et al. A3 adenosine receptors mediate oligodendrocyte death and ischemic damage to optic nerve[J]. Glia, 2014, 62(2): 199–216. DOI:10.1002/glia.v62.2 |
| [21] | 王爽, 梁申芝, 万光明, 等. 高度近视对糖尿病豚鼠视网膜血管内皮生长因子和色素上皮衍生因子表达的影响[J]. 中华实验眼科杂志, 2014, 32(5): 398–402. |
| [22] | 林琳, 买买江·阿不力孜, 张永辉, 等. 视神经减压术干预兔视神经损伤模型视网膜Caspase-3变化[J]. 中华神经外科疾病研究杂志, 2016, 15(1): 82–84. |
 2018, Vol. 44
2018, Vol. 44


